Här är saken med täckningen av ”aminer” i Org 2: det finns ingen berättelse.
Till skillnad från de flesta kapitel börjar det inte med en uppsättning begrepp och bygger sedan upp en serie exempel som du sedan kan tillämpa dessa begrepp på.
Nej. Ett typiskt kapitel om aminer i en introducerande lärobok är i huvudsak bara ett sammelsurium av till synes slumpmässiga ämnen som slängts ihop och som inte passade någon annanstans. Det enda som förenar dem är att de innehåller kväve på något sätt.
Ett exempel: Dagens slumpmässiga inlägg om aminer handlar om Hofmanns och Curtius omarrangemang.
Vad föranleder detta, undrar du kanske? Det finns inget bra svar. De flesta kurser tar upp dem någon gång, och de måste passa in någonstans. Så vad i helvete. Varför inte nu?
Innehållsförteckning
- Hofmann och Curtius omarrangemang
- Mekanismen för Hofmann och Curtius omarrangemang, del ett – att sätta upp omarrangemanget
- Del två: Det viktigaste omarrangemangssteget i Hofmann och Curtius omarrangemang
- Del tre: Bildning av isocyanat
- Sammanställning av stegen
- Isocyanatets öde: Bildning av karbamater, aminer och uréer
- Sammanfattning: Hofmanns och Curtius omarrangemang
- Anteckningar
- (Avancerat) Referenser och vidare läsning
- Hofmann- och Curtius-omarrangemangen
- Mekanismen för Hofmanns och Curtius omarrangemang, del 1: Att sätta upp omarrangemanget
- Del 1: Förspel
- 3. Det viktiga omarrangemangssteget i Hofmann och Curtius
- Förmering av isocyanaten
- Sätta ihop stegen
- Isocyanatens öde
- Sammanfattning: Hofmanns och Curtius omarrangemang
- Noter
- (Avancerad) Referenser och vidare läsning
Hofmann- och Curtius-omarrangemangen
Hofmann- och Curtius-omarrangemangen är två exempel på en hel familj av omarrangemangsreaktioner som har ett gemensamt mekanistiskt steg.
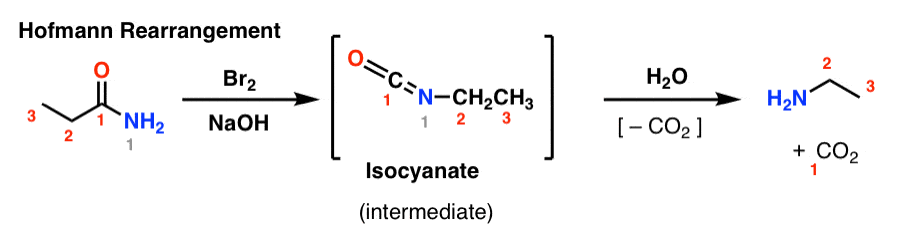
I Hofmann-rearrangemanget behandlas en amid med brom och bas (vanligtvis NaOH eller KOH). Vid upphettning bildas en intermediär isocyanat som inte isoleras. I närvaro av vatten förlorar isocyanatet koldioxid (”dekarboxyleras”) för att ge en amin.
Den nyckelbindning som bildas i Hofmann är C2-N-bindningen. Observera hur karbonylgruppen (C1) förloras och bildar koldioxid (CO2). (Observera: detta är inte IUPAC-numrering, bara numrering för att underlätta diskussionen)
I Curtius-omarrangemanget värms en acylazid upp och en isocyanat bildas. I Curtius kan isocyanatet isoleras, men omvandlas vanligen vidare till andra arter, t.ex. en karbamat, en urea eller (via dekarboxylering, som i Hofmann) till en amin (mer om dessa nedan).
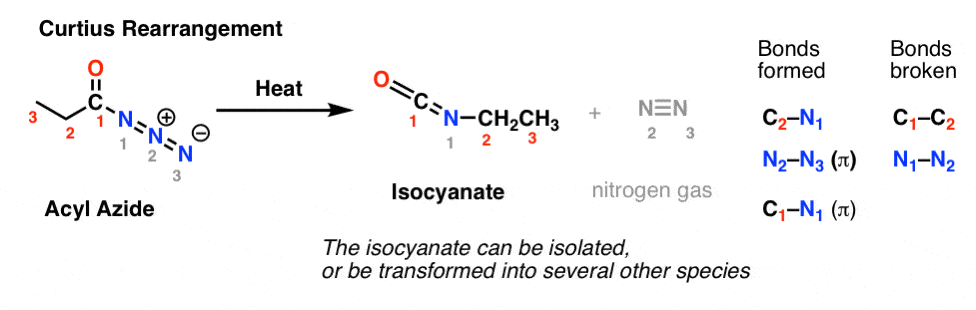
Den viktigaste observationen att notera i båda fallen är att C1-C2-bindningen har brutits och att en ny C2-N-bindning har bildats.
Frågan är HUR?
Mekanismen för Hofmanns och Curtius omarrangemang, del 1: Att sätta upp omarrangemanget
Det finns fyra viktiga delar i mekanismen för Curtius- och Hofmann-omarrangemangen, och vi kommer att gå igenom dem alla.
- Förspelet (enkelt)
- Det viktigaste migrationssteget (knepigt, men mindre knepigt om du inser att du har sett en variant av det i Org 1 !).
- Bildning av isocyanat (okomplicerat)
4. Epilog: Omvandlingar av isocyanatet
Del 1: Förspel
- Hofmann-omarrangemanget sker med en amid.
- Curtius-omarrangemanget sker med en acylazid.
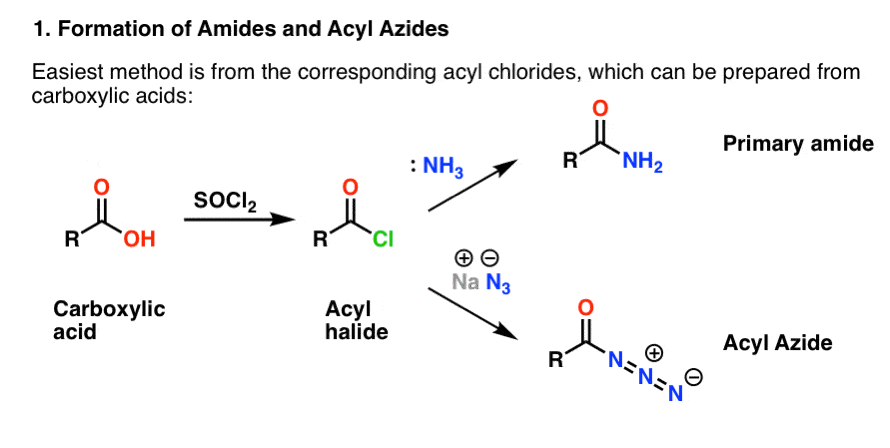
Båda framställs lämpligen från acylhalogenider genom en additions-elimineringsreaktion. Om du behandlar aminer nu är karbonylreaktioner troligen ett välkänt område. Acylhalogeniderna kan framställas från karboxylsyror genom att använda en reagens som thionylklorid (SOCl2) eller fosforpentaklorid (PCl5).
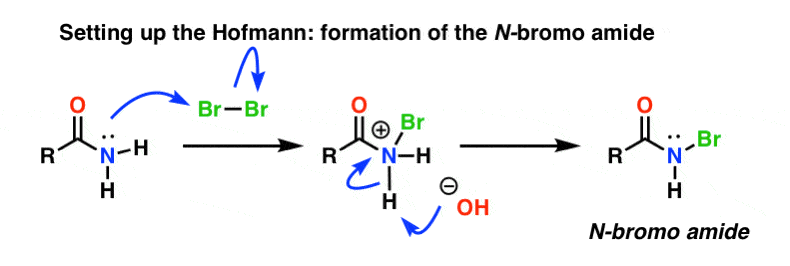
Sätt upp Hofmann
I Hofmann-omarrangemanget behandlas amiden med brom (Br2) och en bas som NaOH. Detta resulterar i att N-H bryts och att N-Br bildas, vilket leder till att en bra avgångsgrupp installeras på kvävet. Vi kallar detta för en ”N-bromoamid”.
Curtius behöver inte ”sättas upp”, eftersom acylaziden redan har en utmärkt inbyggd avgångsgrupp: N2. Detta är anledningen till att organiska azider bör behandlas med försiktighet, eftersom grov behandling kan leda till explosioner.
3. Det viktiga omarrangemangssteget i Hofmann och Curtius
Nu kommer vi till saken.
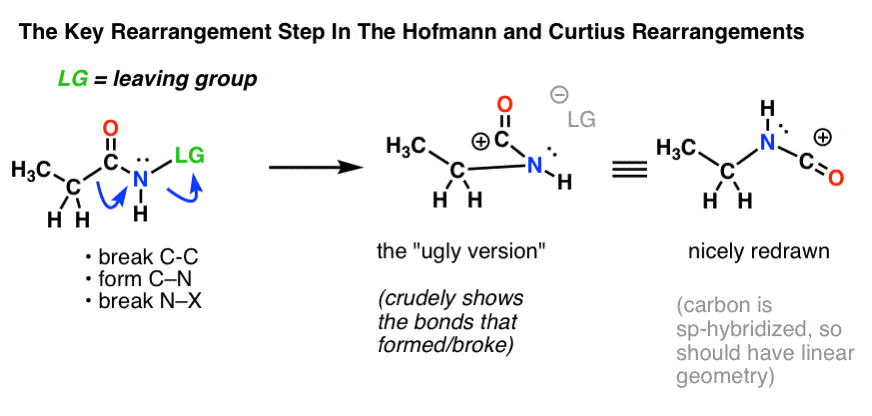
Det viktigaste steget i Hofmanns och Curtius omarrangemang är migration av en kolatom för att förskjuta en avgångsgrupp på ett intilliggande kväve.
Detta kräver två böjda pilar att rita, vilket visas i strukturen längst till vänster (nedan).
- I den första böjda pilen bryts C-C-bindningen och en ny C-N-bindning bildas.
- I den andra böjda pilen bryts N-LG-bindningen (leaving group).
Det är dock inte alltid lätt att gå direkt från strukturen längst till vänster till strukturen längst till höger (som är ritad snyggt och prydligt! ).
Otaliga poäng förloras i onödan i tentor varje år av elever som får de krökta pilarna rätt men som till slut ritar fel struktur! Det är därför jag uppmuntrar eleverna att först rita en ”ful version”, som ser ut som skit men som åtminstone har alla bindningar på rätt plats. Det finns alltid tid att rita om den och få den att se snygg ut senare.
Det här omarrangemanget ser förmodligen först… konstigt ut. Men det är faktiskt en reaktion som du har sett förut! (men i förklädd form).
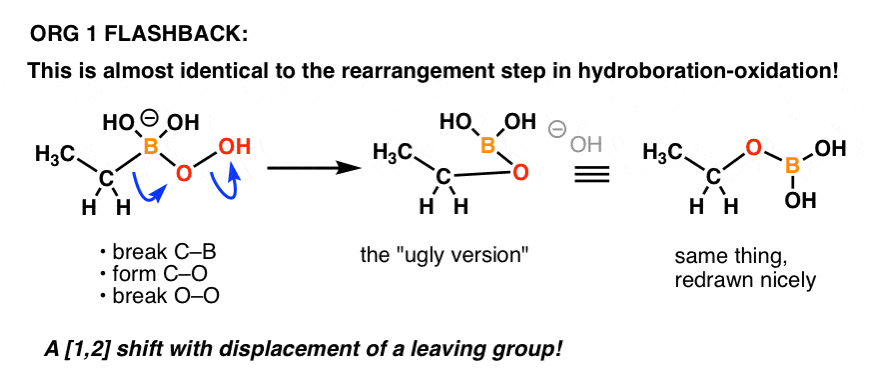
Någon som kommer ihåg mekanismen för ”oxidationssteget” i hydroboration-oxidation?
Det är i princip samma sak!
Här är en repetition:
Ett annat exempel på hur saker man lär sig i en tidigare del av organisk kemi kan komma tillbaka i en senare del av kursen!
Låt oss besöka det specifika omarrangemangssteget i Hofmanns och Curtius omarrangemang med konkreta exempel.
Här är nyckelsteget i Hofmann, där upphettning leder till att C-C bryts, att C-N bildas och att N-Br bryts.
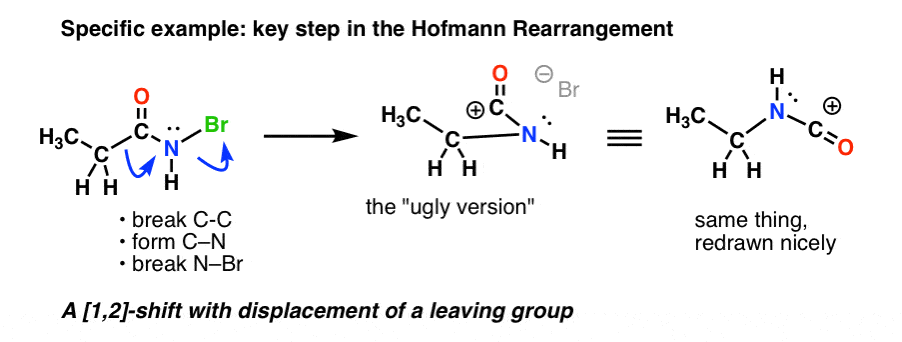
Om du följer alla pilarna bör du få en konstigt utseende karbokation (ovan till höger) som vi tar itu med om en minut.
I Curtius resulterar upphettning av acylaziden i omarrangemang. Den avgående gruppen är kvävegas (N2).
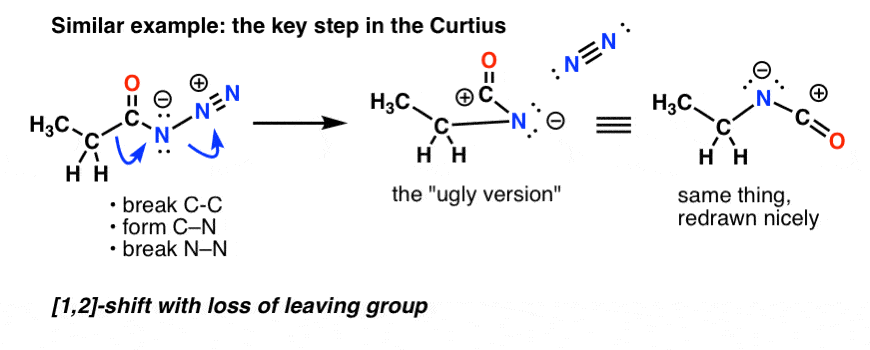
(En subtil skillnad mellan Curtius och Hofmann är att det inte finns något väte knutet till N i Curtius, så vi hamnar med en negativ laddning på kvävet i den omarrangerade arten.)
Förmering av isocyanaten
Nästan går vi från vår omarrangerade art till isocyanaten. För den som är van vid att rita resonansformer borde detta inte vara alltför svårt.
(Som vi kommer att diskutera nedan har studier fastställt att isocyanatbildningen sker samtidigt som migrationen. Men för vårt undervisningssyfte tror jag att det hjälper att behandla detta steg isolerat. Vi kan sätta ihop allt om en minut).
Som ni kanske minns från waayyyy back i Org 1 är en resonansform med fullständiga oktetter överlägsen en utan (snabbgenomgång). Vår konstiga produkt från omarrangemanget har en karbokation intill ett kväve som innehåller ett ensamt par. Så det första steget är att teckna bildandet av en ny C-N pi-bindning. Detta är i huvudsak bara en resonansform.
Hofmann-omarrangemanget sker i närvaro av bas. Så efter att ha ritat resonansformen är nästa steg deprotonering av N-H-bindningen vilket ger den neutrala isocyanaten.
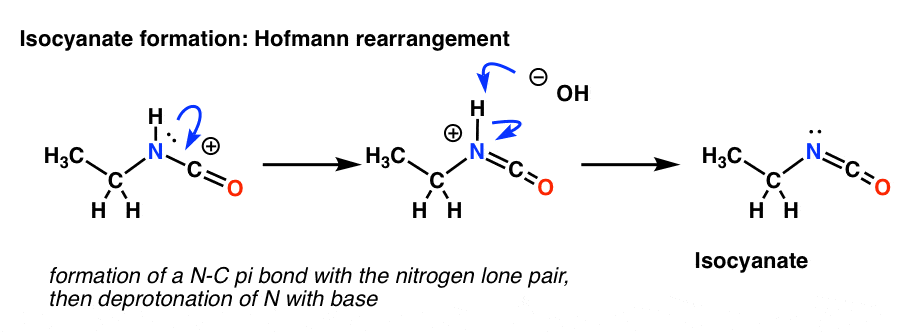
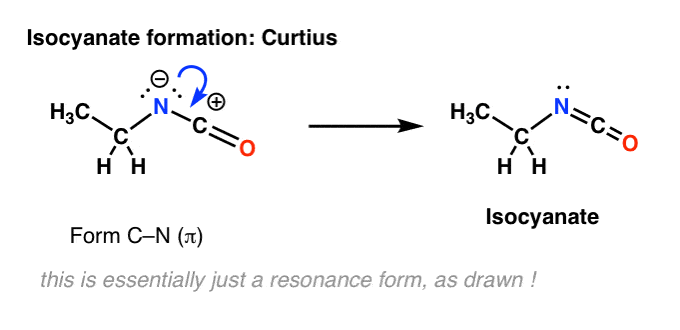
Det finns inget väte på kvävet i Curtius. Så isocyanatbildningen sker enbart genom donation av ett ensam par från kvävet till karbokationen. Man kan bara se det som att man ritar en resonansform.
Sätta ihop stegen
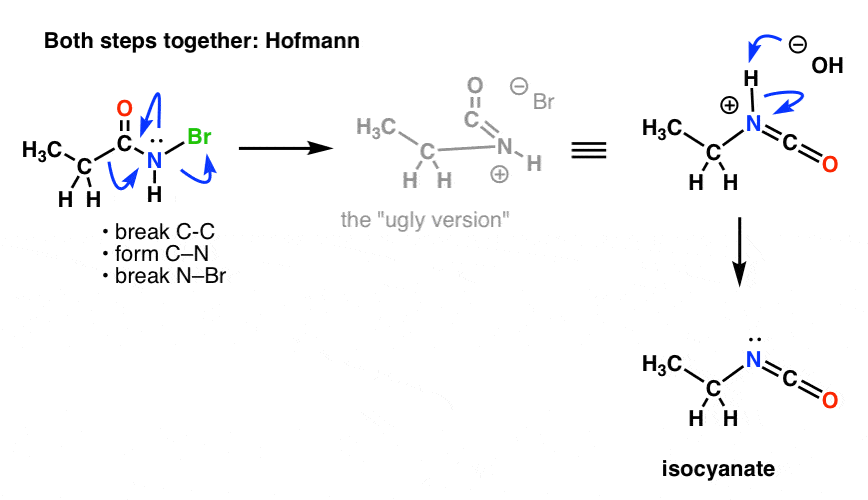
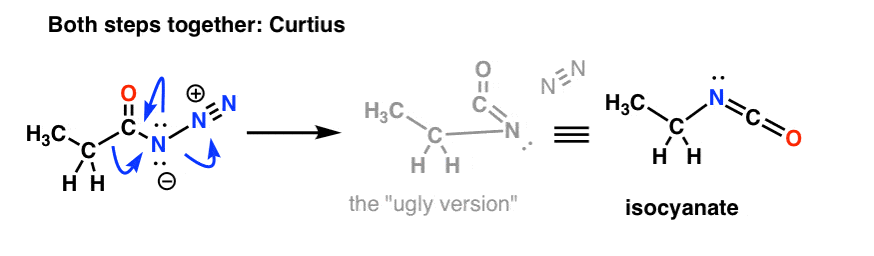
Studier av mekanismen för Hofmann- och Curtius-omarrangemangen har fastställt att de här två stegen inte sker sekventiellt; de sker faktiskt samtidigt! (Hur vet vi detta? se anmärkning 1 )
Det vill säga, migrationen sker samtidigt som isocyanatbildningen.
Vi måste rita om mekanismerna hos Hofmann och Curtius för att återspegla detta och införliva båda stegen.
Här är Hofmann (observera att deprotoneringshändelsen faktiskt är separat).
Och Curtius:
Isocyanatens öde
Både Hofmann och Curtius ger upphov till en isocyanat. Du har troligen inte stött på isocyanater tidigare. Vid första anblicken är de ganska märkliga arter, men deras kemi skiljer sig inte så mycket från kemin hos andra karbonylarter som estrar, amider och acylhalogenider.
Isocyanatens struktur påminner mycket om koldioxids, CO2, struktur. Kolet är pi-bundet till två starkt elektronegativa atomer. Detta gör kolet till en utmärkt elektrofil.
Genom att tillsätta olika nukleofiler kan isocyanater omvandlas till andra användbara arter.
– Tillsats av en alkohol resulterar i bildandet av en karbamat
– Tillsats av en amin resulterar i en urea
– Tillsats av vatten resulterar i en karbaminsyra, som är instabil. Karbaminsyror förlorar snabbt koldioxid för att ge en amin.
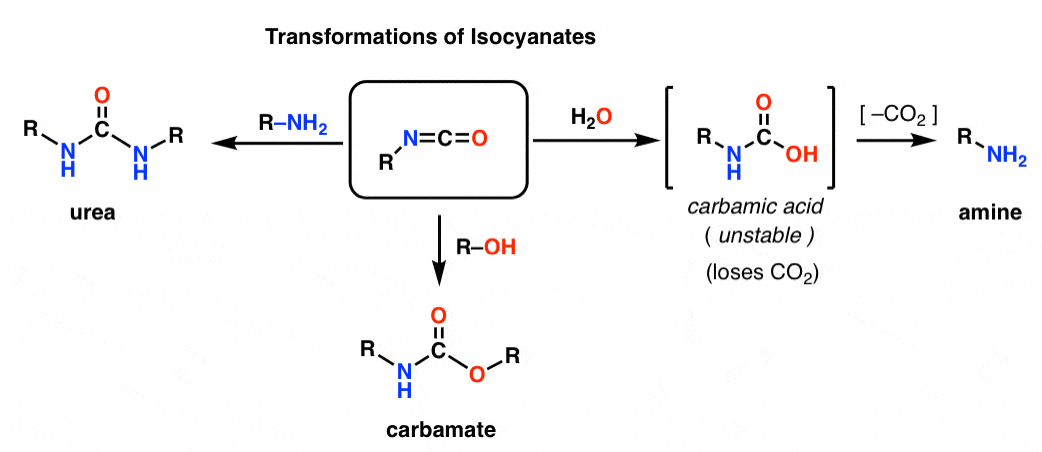
I synnerhet är dekarboxyleringsvägen ett fiffigt sätt att framställa aminer. Vi har lärt oss massor av sätt att göra karboxylsyror, men inte alltför många sätt att göra aminer (förutom nukleofil substitution och reduktiv aminering). Hofmann är ett bra knep att ha i bakfickan i situationer där ingen av dessa situationer kan gälla – som att tillverka substituerade aniliner, till exempel.
Mekanismer? Okej, bra. Se bonusämne 1.
Sammanfattning: Hofmanns och Curtius omarrangemang
Mekanismen för dessa omarrangemang är knepig vid första anblicken, men underlättas avsevärt när du inser att du har sett en variant av migrationsreaktionen tidigare (dvs.t.ex. i hydroboration-oxidation).
Jag rekommenderar starkt att du ritar den fula versionen först, eftersom det hjälper dig att fokusera på att se bindningarna som bildas och bryts, innan du försöker rita om den till en mer estetiskt tilltalande struktur. Detta gäller även Beckmanns och Wolffs omarrangemang, som har ett liknande steg (se nedan)
Noter
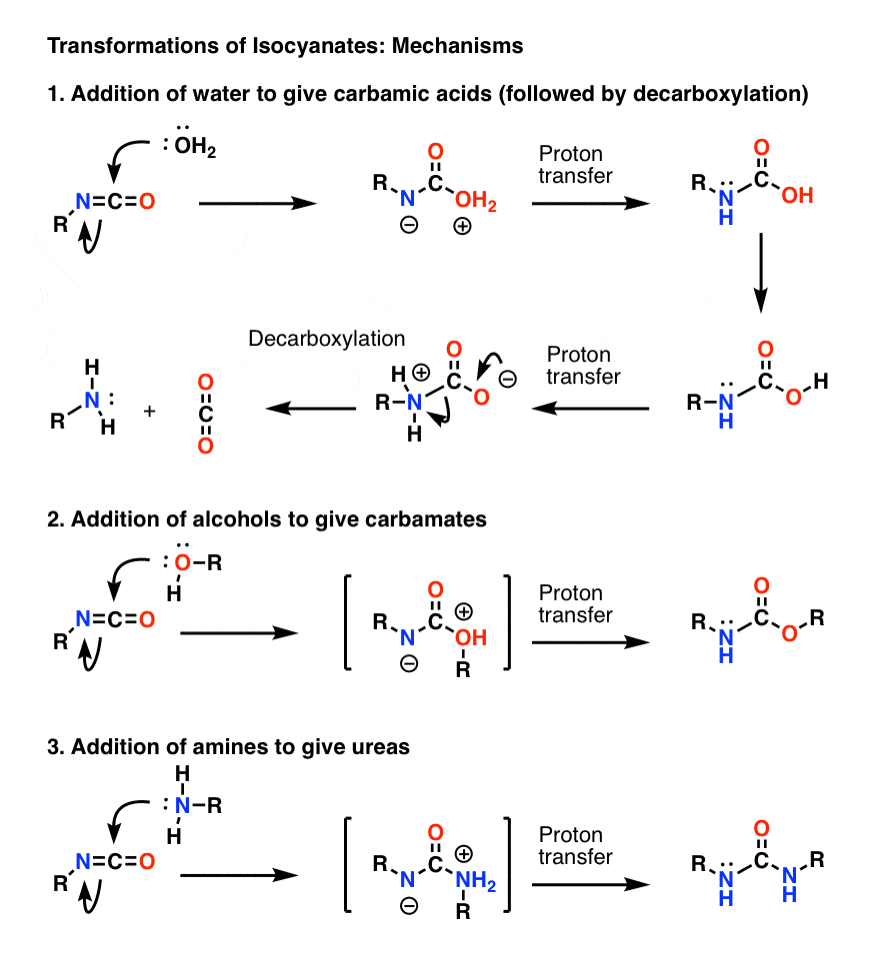
Bonusämne 1: Isocyanater
Den viktigaste mekanismen för isocyanater är elektrofil addition (dvs. att lägga till en nukleofil till det centrala, elektrofila kolet). I mekanismen nedan visade jag att nukleofilen adderar till kolet så att det bildas en anjon på kvävet, även om detta sannolikt inte är den bästa resonansformen (syret är bättre på att stabilisera negativ laddning än kvävet). Protonöverföring från syre till kväve resulterar i en neutral art. (Jag använde här den magiska staven för protonöverföring, eftersom den är snabbare).
Bemärk att decarboxyleringssteget i 1) inte behöver föregås av deportation av syret, även om det definitivt måste ske på ett sådant sätt att kvävet protoneras under steget (man vill till exempel inte bilda en starkt basisk amidjon).
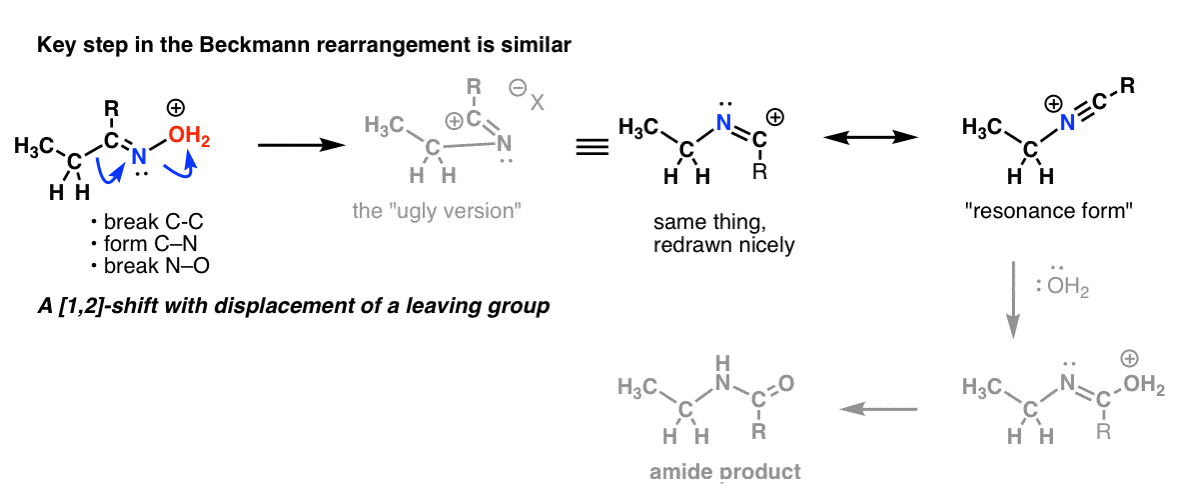
Bonusämne 2: Beckmann-, Wolff- och andra omarrangemang har ett liknande steg
Men vänta, det finns mer!
Det finns en 1,2-förskjutning med förlust av en avgående grupp i Beckmann-omarrangemanget. Nyckelsteget är i huvudsak detsamma som vi såg i Hofmann och Curtius.
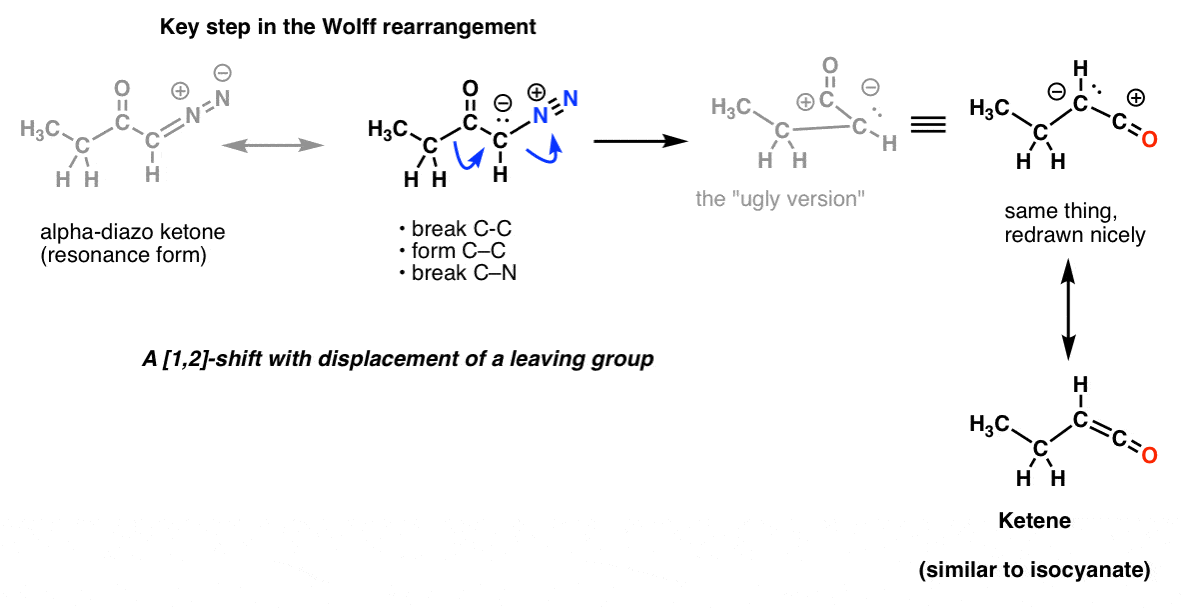
Och i Wolff-omarrangemanget, som också brukar behandlas, kan du också känna igen samma nyckelsteg.
Och det är inte allt! Det finns en reaktion som kallas Schmidt-rearrangemanget, som liknar Curtius, men som kommer från tillsats av HN3 till en acylklorid (eller karboxylsyra). Och det finns en annan som kallas Lossen-omarrangemanget och som inträffar med hydroxiaminsyror. Det finns inga priser för att gissa nyckelsteget i dessa två processer. Och vi har inte ens nämnt Baeyer-Villiger, som inte involverar kväve, men som i stort sett är samma typ av process.
När jag lärde mig hydroborations-oxidationssteget i Org 1 för många månar sedan, förväntade jag mig verkligen inte att jag skulle få se samma reaktionsmönster upprepas i så många olika skepnader.
Summan av kardemumman är att det finns en hel del reaktioner som går under olika namn men som går igenom samma mekanistiska process. Detta understryker vikten av att lära sig de viktigaste mönstren i organisk kemi, eftersom de verkligen upprepar sig mycket.
Endnote. Samordnad, inte separat?
Om Curtius var stegvis skulle förlusten av kväve leda till ett nitren. Nitrener genomgår en mängd intressanta reaktioner, till exempel insättning i C-H-bindningar (!). Så man kan utforma ett experiment för att testa detta: om man försöker med följande Curtius-omarrangemang skulle man kunna leta efter tecken på bildning av en femledad ring.
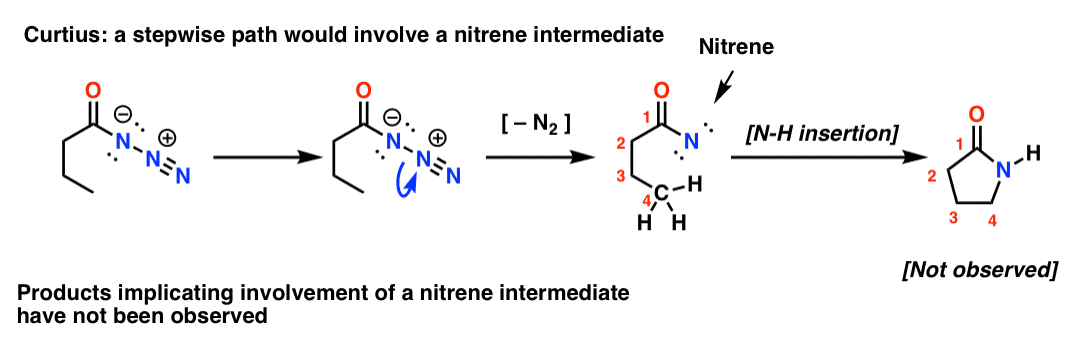
Frånvaron av sådana produkter, tillsammans med andra bevis, pekar på en samordnad mekanism.
(Avancerad) Referenser och vidare läsning
- Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide
W. Hofmann
Chem. Ber. 1881, 14, 2725-2736
DOI: 10.1002/cber.188101402242
Originalartikel av A. W. Hofmann (som var en mycket produktiv kemist och har sitt namn tillskrivet många andra omvandlingar) om nedbrytning av amider till primära aminer. - A Mild and Efficient Modified Hofmann Rearrangement
Xicai Huang, Mehran Seid, and Jeffrey W. Keillor
The Journal of Organic Chemistry 1997, 62 (21), 7495-7496
DOI:10.1021/jo9708553
Detta är en modifierad Hofmann-rearrangemang som utförs i metanol – i detta fall kan den intermediära karbaminsyran reagera med metanol-lösningsmedlet för att producera metylkarbamater med god avkastning. - METYLKARBAMATBILDNING VIA MODIFIERADE HOFMANN REARRANGEMENT REACTIONS: METYL N-(p-METHOXYPHENYL)CARBAMAT
Jeffrey W. Keillor och Xicai Huang
Org. Synth. 2002, 78, 234
DOI: 10.15227/orgsyn.078.0234
En tillförlitlig och oberoende testad procedur för den modifierade Hofmann-rearrangemanget i Ref #2. - The Hofmann Reaction
Wallis, Everett L.; Lane, John F.
Org. React. 1946, 3, 267-306
DOI: 10.1002/0471264180.or003.07
En gammal men omfattande (för sin tid) genomgång av Hofmann-reaktionen (reaktionen från amid till amin, inte att förväxla med hans andra reaktioner). - Notes – A Re-examination of the Limitations of the Hofmann Reaction
Ernest Magnien and Richard Baltzly
The Journal of Organic Chemistry 1958, 23 (12), 2029-2032
DOI:10.1021/jo01106a630
Detta är en intressant artikel där författarna har försökt att utvidga Hofmann-omarrangemanget utöver vad som beskrevs i den ursprungliga artikeln genom att noggrant justera reaktionsförhållandena. - 20. Hydrazide und Azide organischer Säuren
Curtius, T. I. Abhandlung.
Journal Für Praktische Chemie, 50(1), 275-294. (1894).
DOI:1002/prac.18940500125 - Ueber Stickstoffwasserstoffsäure (Azoimid) N3H.
Curtius, T.
Berichte Der Deutschen Chemischen Gesellschaft, 23(2), 3023-3033.(1890).
DOI:1002/cber.189002302232
De första artiklarna av Theodore Curtius som beskriver reaktiviteten hos acylhyrazider och acylazider. - The Curtius Reaction
Smith, P. A. S.
Org. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
En gammal men omfattande genomgång av Curtius-reaktionen, som omfattar historien om upptäckten av denna omarrangemang, substratets räckvidd, begränsningar, jämförelser med andra liknande reaktioner och experimentella förfaranden. - UNDECYL ISOCYANATE
F. H. Allen och Alan Bell
Org. Synth. 1944, 24, 94
DOI: 10.15227/orgsyn.024.0094
En gammal men reproducerbar och testad procedur för att syntetisera isocyanater genom Curtius-omarrangemanget. - En smidig skyddsgruppsfri totalsyntes av (±)-Dievodiamin
William P. Unsworth, Christiana Kitsiou, and Richard J. K. Taylor
Organic Letters 2013 15 (13), 3302-3305
DOI:1021/ol4013469
Det första steget i denna totalsyntes använder en Curtius-omläggning för att åstadkomma en intramolekylär cyklisering av den indolsubstituerade karboxylsyran. - Syntesmetoder och reaktioner. 121. Zinkjodidkatalyserad framställning av aroylazider från aroylklorider och trimetylsilylazid
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi och George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051
En bekväm procedur för framställning av aromatiska arylazider från nobelpristagaren professor George A. Olah. Dessa kan sedan användas för Curtius-omläggningar.