I den här serien ger Colin Baker från Bedford School spektakulära demonstrationer som är utformade för att fånga elevernas fantasi. Demonstrationerna är lätta att förbereda, säkra att ta hand om och de fungerar.
Inget tenderar att prägla kemiska fakta i sinnet så mycket som utställningen av intressanta experiment – Samuel Parkes, 1816
I september 1931 rapporterade den amerikanske kemisten Wallace Carothers, som arbetade i DuPonts laboratorier, om forskning om ”jättelika” molekyler, så kallade polymerer, som baserades på en förståelse av ullens kemiska struktur. Hans arbete inriktades på en fiber som helt enkelt kallades ”66”, ett nummer som härrörde från dess molekylära struktur. År 1935 föddes nylon, ”mirakelfibern”, som blev en stor framgång på sin första marknad, damstrumpor. När USA gick in i andra världskriget i december 1941 tilldelade War Production Board all produktion av nylon för militärt bruk, inklusive fallskärmar och däck för B29-bombare.

Källa: Colin Baker
Reaktionen mellan decandiodiklorid och 1,6-diaminohexan
En diacidklorid i ett organiskt lösningsmedel bildar ett omblandbart skikt med en alifatisk diamin i vatten. Vid gränssnittet, där de två färglösa lösningarna möts, bildas en vit, långkedjig polymer. Denna polymerfilm kan dras från gränssnittet och ersätts omedelbart när den avlägsnas. Om man slutar dra verkar ingenting hända – reaktionen stannar upp, men den återupptas omedelbart när man börjar dra igen. Reaktionen kan ske under flera timmar.

Källa: Colin Baker
Kit
- Cyclohexan, 100cm3 (irriterande, lättantändligt);
- Dekanedioyldiklorid, 5.0cm3;
- Destillerat vatten, 100cm3;
- Vattenfri natriumkarbonat, 10g;
- 1,6-diaminohexan, 5.0g;
- Två bägarbägare, 250cm3;
- Bägarbägare, 5cm3;
- Tväljare;
- Glasstavar.
Säkerhet
Dekanedioyldiklorid och 1,6-diaminohexan är frätande. De är skadliga om de sväljs eller inandas, och i kontakt med huden orsakar de brännskador. De är starkt irriterande. Cyklohexan är lättantändligt och irriterande.
Förfarande
Förbered följande två lösningar:
Lösning A: dekandiodiklorid i cyklohexan. Häll 100 cm3 cyklohexan i en 250 cm3 bägare, tillsätt 5,0 cm3 dekanedioyldiklorid och rör om för att lösa upp den. Denna lösning håller i ungefär fyra veckor.
Lösning B: 1,6-diaminohexan i vattenhaltigt natriumkarbonat. Häll 100 cm3 destillerat vatten i en 250 cm3 bägare, tillsätt 10 g vattenfri natriumkarbonat och rör om för att lösa upp. Tillsätt 5,0 g fast 1,6-diaminohexan och rör om för att lösa upp det.
Häll 2 cm3 lösning A i en 5 cm3 bägare. Tillsätt försiktigt en lika stor volym lösning B. Lösning A innehåller det organiska lösningsmedlet, är tätare än vattenskiktet och är därför bottenskiktet. Ta tag i polyamidfilmen (ett vitt fast ämne) som börjar bildas vid gränssnittet mellan dessa två lösningar med en pincett och dra sakta ut den ur bägaren. Linda fibern runt en glasstav och fortsätt att dra. Stoppa processen när en av reaktanterna är förbrukad.
Särskilda tips
Du måste vara försiktig när du tillsätter den andra lösningen för att undvika blandning. Visa hur fibern kan dras ut i en enda kontinuerlig tråd och anordna sedan en tävling för att se vilket elevpar som kan producera den längsta fibern. De bör kunna producera upp till 5 meter innan fibern går sönder. De kommer snabbt att inse att de behöver hjälp för att stödja fibern – jag delar upp klassen i två stora grupper som var och en är beväpnad med glasstavar. Mina elever har producerat fibrer på över 30 meter och har till och med försökt gå runt hörn. Du måste begränsa den maximala volymen av varje lösning till 10 cm3. Eleverna måste bära handskar och undvika kontakt med fibrerna. Om fibrerna går sönder ska de lindas in i absorberande papper. Eventuellt spill ska torkas upp med absorberande papper och läggas i avfallet.
Undervisningsmål
Polyamider är polymerer där de upprepade enheterna hålls samman av amidlänkar, -CO-NH-.
Nylon-6,10
Nylon-6,10 tillverkas av två monomerer, varav den ena innehåller sex kolatomer och den andra tio – därav namnet. Den monomer med 10 kolväten är decandiodiklorid (ClOC(CH2)8 COCl), en syraklorid med en -COCl-grupp i vardera änden. Den andra monomeren är en kedja med sex kol med en aminogrupp, -NH2, i varje ände. Detta är 1,6-diaminohexan (H2 N(CH2)6 NH2, även känt som hexan-1,6-diamin).
När dessa två föreningar polymeriserar kombineras amin- och syragrupperna, varje gång med förlust av en molekyl väteklorid:
n ClOC-(CH2)8-COCl + n H2N-(CH2)6-NH2 → -(CO-(CH2)8-CONH-(CH2)6-NH)n – + n HCl
Denna polymerbildande process där en liten molekyl går förlorad kallas kondensationspolymerisation.
Nylon-6,6
Denna polymer framställs genom kondensering av två molekyler med sex kol, hexandisyra och 1,6-diaminohexan. Inom industrin används cyklohexan för att framställa båda monomererna. Om cyklohexan oxideras öppnas ringen och kedjans båda ändar har en syragrupp – hexandisyra bildas. Om denna syra neutraliseras med ammoniak bildas diammoniumsaltet (NH4 OOCCH2 CH2 CH2 CH2 CH2 COONH4) som kan dehydratiseras (genom upphettning till 350 °C) och reduceras (med H2/Ni) till 1,6-diaminohexan. Kondensationspolymerisation av diaciden och diaminen sker med förlust av vatten:
n HOOC-(CH2)4 -COOH + n H2 N-(CH2)6 -NH2 → -(CO-(CH2)4 -CONH-(CH2)6 -NH)n – + n H2 O
Nylon-6
Det är möjligt att framställa nylon från den enkla monomeren kaprolaktam (hexahydro-2H-azepin-2-on, 1).
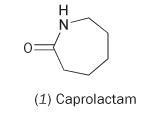
Caprolactam innehåller en inre amidlänk. Polymerisering av denna molekyl resulterar i att ringen öppnas och förenas för att bilda en kontinuerlig kedja:
-(NH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CO)n –
Nylon revolutionerade textilindustrin och var föregångare till många av dagens moderna syntetfibrer. Det är fortfarande ett viktigt och allmänt använt material inom tillverkningsindustrin.