Användningen och betydelsen av celler och batterier är obestridlig. I vårt dagliga liv använder vi oss av celler på så många olika sätt. Under de senaste koncepten har vi redan introducerat dig till batterier i allmänhet. Här ska vi dock ge dig en djupgående analys av galvaniska celler. Så låt oss komma igång.
Föreslagna videor
Galvaniska celler
En galvanisk cell är bland annat en typ av elektrokemisk cell. Den används för att leverera elektrisk ström genom att göra överföringen av elektroner genom en redoxreaktion. En galvanisk cell är en exemplifierande idé om hur energi kan utnyttjas med hjälp av enkla reaktioner mellan några få givna element. Det är häpnadsväckande att studera hur en galvanisk cell kan sättas upp och användas för att få energi.
Förklarat i de enklaste termerna fungerar en galvanisk cell som en anordning där samtidiga oxidations- och reduktionsreaktioner äger rum. Dessa reaktioner används för att omvandla den kemiska energin till elektrisk energi, som kan utnyttjas för alla kommersiella ändamål.
Se fler ämnen under Elektrokemi
- Batterier
- Konduktans hos elektrolytiska lösningar
- Korrosion
- Elektrokemiska celler
- Elektrolytiska celler och elektrolys
- Bränsleceller
- Nernst-ekvation
- Konduktivitetens och den molära konduktivitetens variation med koncentrationen
Galvaniska cellers funktion

Funktionen hos en galvanisk cell är ganska enkel. Det handlar om en kemisk reaktion som gör den elektriska energin tillgänglig som slutresultat. Under en redoxreaktion utnyttjar en galvanisk cell energiöverföringen mellan elektroner för att omvandla kemisk energi till elektrisk energi.
Galvanisk cell utnyttjar förmågan att separera flödet av elektroner i oxidations- och reduktionsprocessen, vilket orsakar en halvreaktion och förbinder var och en med en tråd så att en väg kan bildas för flödet av elektroner genom en sådan tråd. Detta flöde av elektroner kallas i huvudsak för en ström. En sådan ström kan fås att flöda genom en tråd för att slutföra en krets och få sin utgång i någon anordning som en tv eller en klocka.
En galvanisk cell kan tillverkas av två valfria metaller. Dessa två metaller kan utgöra anod och katod om de lämnas i kontakt med varandra. Denna kombination möjliggör galvanisk korrosion av den metall som är mer anodisk. En anslutningskrets ska krävas för att denna korrosion ska kunna äga rum.
Uppbyggnad av en galvanisk cell
För att skapa en galvanisk cell måste man gå igenom följande uppställning. Cellen skulle helst innehålla två elektroder. En av dessa elektroder, katoden, ska vara en positivt laddad elektrod medan den andra ska vara anoden, den negativt laddade elektroden.
Dessa två elektroder ska utgöra de två väsentliga komponenterna i den galvaniska cellen. Den kemiska reaktionen som rör reduktion ska äga rum vid katoden medan oxidationshalvreaktionen ska äga rum vid anoden. Som redan sagts kan två valfria metaller användas för att skapa den kemiska reaktionen.
Förstå den galvaniska cellen med ett exempel
Låt oss ta ett exempel där de två metaller som ingår i den kemiska reaktionen är zink och koppar. När den kemiska reaktionen äger rum skulle zink till slut förlora två elektroner. Dessa kommer att tas upp av koppar för att bli elementär koppar. Eftersom dessa två metaller kommer att placeras i två separata behållare och skulle förbindas med en ledande tråd, skulle en elektrisk ström bildas, som skulle överföra alla elektroner från den ena metallen till den andra.
Samtidigt ska de två metallerna nedsänkas i en saltlösning, låt oss säga zinksulfat och kopparsulfat i det här fallet. I detta fall blandas de två lösningarna inte direkt utan kan sammanfogas med hjälp av en bro eller ett medium. Detta medium ska ansvara för överföringen av joner men också se till att de två lösningarna inte blandas med varandra.
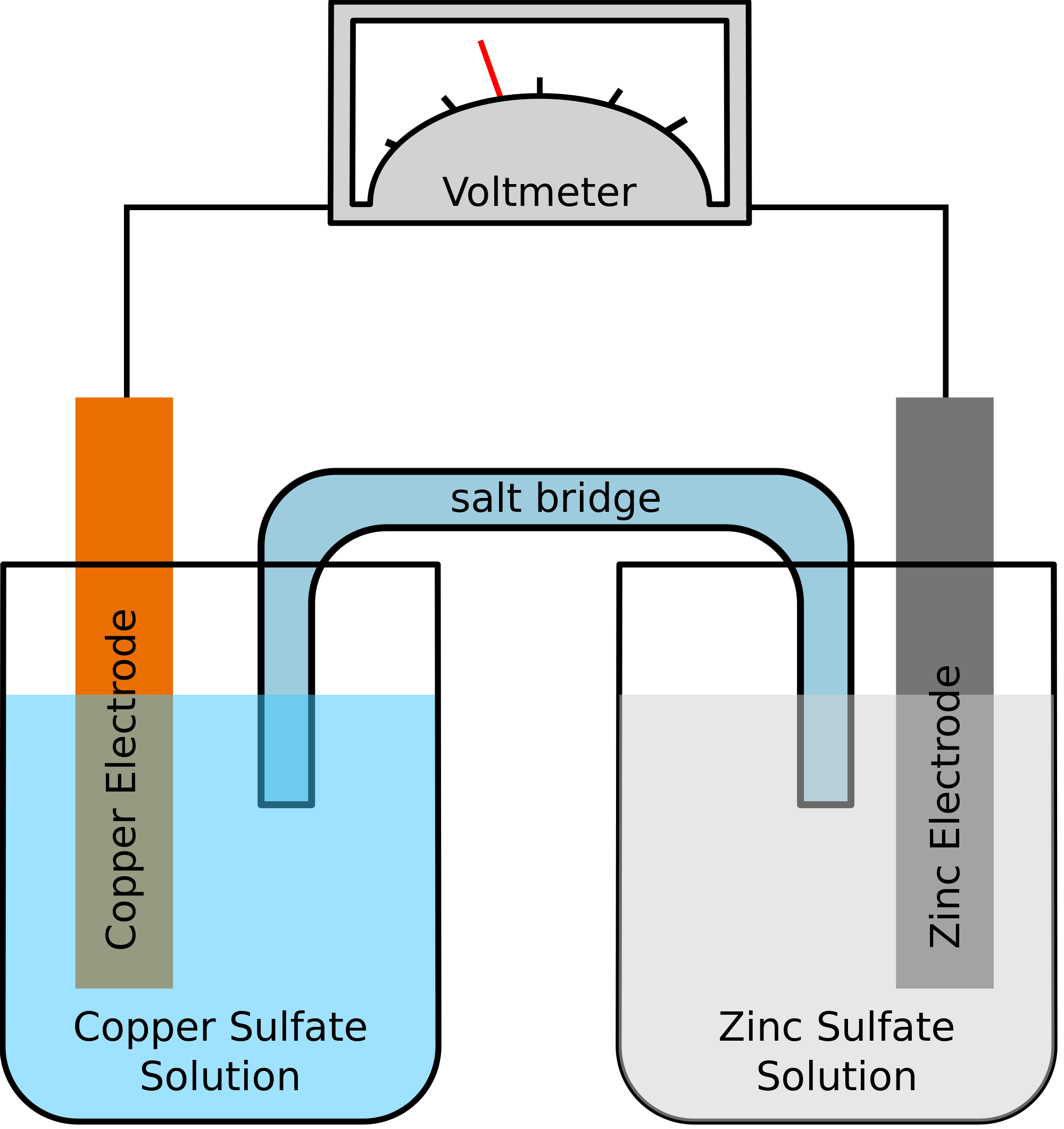
En sådan bro hjälper till att sluta kretsen för att bära den elektriska laddningen och ser också till att lösningarna i behållarna med metallerna förblir neutrala och inte blandas med varandra. Så länge saltbryggan inte stör redoxreaktionen, under vilken oxidation och reduktion äger rum, spelar det ingen roll vilken saltbrygga som används i den kemiska reaktionen.
Några viktiga termer
Några viktiga termer som tas i bruk i en galvanisk cell är listade nedan:
- Fasegränser: Det avser de två metaller som fungerar som katod och anod.
- Saltbrygga: Den anslutande bron eller det medium som gör det möjligt för en redoxreaktion att äga rum.
- Oxidation och reduktion: De kemiska processer som gör att den elektriska strömmen kan bildas och flöda genom en galvanisk cell.
Lösta exempel för dig
Fråga: Vad skulle hända i en galvanisk cell om ingen saltbrygga används medan redoxreaktionen äger rum?
Lösning: I avsaknad av en saltbrygga i varje behållare som innehåller metallerna skulle redoxreaktionen börja på ungefär samma sätt. Men i avsaknad av saltbryggan skulle samma sak komma till ett ganska abrupt slut. De respektive lösningarna kommer inte att kunna bibehålla sin elektriska neutralitet. Utöver detta kommer det inte att ske någon förändring i den kemiska reaktionen eller någon förändring av något slag på grund av avsaknaden av saltbryggan eller mediet.