Generell översikt
En stor del av mikroorganismerna finns inte bara inom oss utan lever också på oss. Människans hud hyser faktiskt en heterogen blandning av mestadels icke-patogena bakterier, svampar och virus som troligen bidrar till hudens ythälsa (figur 1). Propionibacterium acnes (P. acnes) är en allestädes närvarande, långsamt växande, stavformad, icke-sporbildande, Gram-positiv anaerobe (figur 2) som finns på många ställen på kroppen, bland annat i talgfolliklar i ansiktet och på halsen (Funke et al., 1997; Grice och Segre, 2011; Findley och Grice, 2014). Den anses ofta vara en del av vår kommensala mikrobiota på barriärplatser (Cogen et al., 2008) som etableras via mekanismer för adaptiv immuntolerans under den tidiga neonatperioden (Scharschmidt et al., 2015). Även om den topografiska fördelningen av anaeroben i talgställen är betydande, är den rumsliga och personliga fördelningen av P. acnes mer individspecifik än platsspecifik (Oh et al., 2014). Dessutom är P. acnes biogeografi och individualitet mycket dynamisk eftersom förändringar i hälsa eller förändringar i pH, temperatur, fuktighet och/eller talghalt också kan påverka det utbud av nischer som upptas av mikroorganismen (Grice et al., 2009). I likhet med fördelningen av hudmikrober kan hudförhållanden också forma P. acnes funktion när det gäller patogenutbredning vid sjukdom. P. acnes har till exempel kopplats till hudinslag som acne vulgaris i ansiktet och på halsen och progressiv makulär hypermelanos på ryggen (Bojar och Holland, 2004; Kurokawa et al., 2009; Barnard et al., 2016). Dessutom har vissa sjukdomsassocierade fylotyper av P. acnes förmågan att persistera på kroppsimplantat och kirurgisk utrustning som orsakar ett brett spektrum av postoperativa infektionstillstånd, t.ex. endokardit, endoftalmit och intravaskulära infektioner i nervsystemet (Perry och Lambert, 2011; Portillo et al., 2013). De oönskade egenskaperna hos P. acnes sträcker sig även till prostatakörteln där vävnadsinvasion och intracellulär deponering av bakterien ofta har noterats i körtelepitelceller och cirkulerande makrofager; ett fenomen som tros indirekt bidra till godartad prostatahyperplasi (BPH) och prostatacancer (Tanabe et al, 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016). Det är dock oklart vilka underliggande mekanismer som P. acnes använder för att inducera infektion, inflammation och/eller metastasering utanför huden. Vad som är känt med viss säkerhet är att bakterieinfekterade keratinocyter, sebocyter och/eller adipocyter utsöndrar flera proinflammatoriska kemokiner och cytokiner samt antimikrobiella faktorer (t.ex, cathelicidin) som tyder på specifika sjukdomsmekanismer (Graham et al., 2004; Nagy et al., 2006; Lee et al., 2010; Zhou et al., 2015; Sanford et al., 2016; Yu et al., 2016).
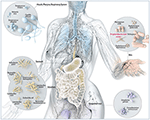
Figur 1. Schematisk illustration av vanliga mikrober som finns på barriärställen hos människor, inklusive P. acnes. Även om P. acnes förekommer på alla yttre och inre ytor (dvs. mun- och gastrointestinal epitel, konjunktiva) är den vanligast på människans hud. Där bor den i hårsäckar i ansiktet och på ryggen, där den förknippas med den vanliga hudsjukdomen acne vulgaris. De flesta anser fortfarande att P acnes är en godartad och kommensal mikroorganism, men rapporterna om dess skadliga opportunistiska sida ökar. Anpassad och med vänligt tillstånd från Bryan Christie Design (http://bryanchristiedesign.com/).
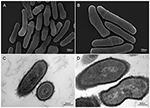
Figur 2. Skanning- och transmissionselektronmikroskopiska bilder (SEM och TEM) av P. acnes stam KPA (A, B = SEM; C, D = TEM). De senaste framstegen inom isolering och odlingsteknik avslöjar att P. acnes-infektioner har varit grovt underskattade och kastar ett nytt ljus över denna opportunistiska bakterieart. Mikroskopi av Volker Brinkmann, Max Planck Institute for Infection Biology, Berlin, Tyskland. Skalstreck = 200/300nm.
Sarkoidos
Sarkoidos är en sjukdom av okänd etiologi som leder till inflammation i så skilda organ som lungor, lever, hud och lymfkörtlar. En förmodad koppling mellan sarkoidos och P. acnes föreslogs först när bakterien isolerades från sarkoidförändringar i hud och lymfkörtlar (Eishi et al., 2002; Yamada et al., 2002). Dessa fynd har bekräftats avsevärt (de Brouwer et al., 2015) och utökats ytterligare genom olika in vitro-experiment som visar på P. acnes invasionsförmåga i cellinjerna HEK293T (humana embryonala njurar) och A549 (humant alveolärt epitelkarcinom) (Tanabe et al., 2006). Det senaste arbetet i sarkoid bronko-alveolär lavage (BAL) vätska och celler visade en betydande uppreglering av ett P. acnes-specifikt immunsvar (Schupp et al., 2015). Dessutom har försök på möss visat att livskraftig P. acnes kan inducera lunggranulom som liknar dem som observeras hos sarkoidospatienter (Werner et al., 2017). En allmän översikt som beskriver kopplingen mellan sarkoidos och P. acnes ges vidare av Eishi (2013).
Studier som försökte karaktärisera de signalvägar som aktiveras av P. acnes under infektion visade att kärnfaktor-kappaB , en transkriptionsfaktor som reglerar uttrycket av gener som är involverade i immun- och inflammatoriska kaskader, aktiveras av P. acnes (Kim et al., 2002). Mer allmänt visades toll-like receptor 2 (TLR2) vara en kritisk receptor för det NF-κB-beroende svaret på P. acnes, vilket avslöjade denna bakteries förmåga att framkalla en selektiv aktivering av gener för det medfödda immunförsvaret (Inohara och Nuñez, 2001; Chamaillard et al., 2003; Moreira och Zamboni, 2012). Vidare undersöktes värdgenetikens roll i sarkoidosfall som var associerade med P. acnes-infektion. Enskilda nukleotidpolymorfismer (SNP) i den nukleotidbindande oligomeriseringsdomänen (NOD) för proteinerna NOD1 och NOD2 korrelerades med P. acnes-infektion bland 73 sarkoidospatienter med 52 interstitiella lunginflammationer och 215 friska kontroller (Tanabe et al., 2006). NOD1 och NOD2 är intracellulära mönsterigenkänningsreceptorer som kan känna av bakteriella molekyler såsom peptidoglykanmolekyler. I samma anda har in vitro-experiment visat att internalisering av P. acnes i HEK293T-celler kan leda till aktivering av NOD1 och NOD2, vilket tyder på en sjukdomsmekanism som bygger på kronisk inflammation eller lokal immunosuppression (Tanabe et al., 2006). Dessa fynd tyder också på att invasiva P. acnes kan fungera som bakteriella ligander för att orsaka avvikande NOD-receptoraktivering hos vissa individer med långvarig känslighet för sarkoidos. Framtida experiment måste dock klargöra den exakta mekanistiska kronologin för om eller hur P. acnes-medierad aberrant NF-κB-aktivering kan inducera granulombildning på ett NOD1/NOD2-beroende sätt.
Och även om invasiva P. acnes skulle kunna vara en möjlig etiologi för sarkoidos och kanske andra sjukdomar, så är det inte möjligt att belysa orsakssamband och korrelation mellan P. acnes-infektion och patologi är dunkelt eftersom bakteriestammarnas heterogenitet, värdens genetik samt värdens miljöer måste beaktas när en studie kopplar ett mikrobiom till ett sjukdomstillstånd.
Benign prostatahyperplasi (BPH) och prostatacancer
Kroniska eller återkommande inflammatoriska processer har länge varit inblandade i utvecklingen av BPH och prostatacancer (De Marzo et al., 1999; Nelson et al., 2004; Sfanos et al., 2014). Inflammation tillskrivs förekomsten av specifika biomarkörer såsom förhöjt interleukin (IL)-6, tumörnekrosfaktor alfa (TNFα) och akutfasprotein, C-reaktivt protein (Mechergui et al., 2009; Menschikowski et al., 2013; Yu et al., 2015). Nyligen utförda arbeten på urologiska vätskor (dvs. urin, sädesvätska, prostatasekret) samt prostatabiopsier tyder på en betydande konditionell förskjutning mot vissa mikrobiella arter som kan användas som ett diagnostiskt index (Yu et al., 2015; Ni et al, 2016).
En hel del arbete tyder på att den specifika associeringen av P. acnes med prostatan och invasionen av prostatans epitelceller i synnerhet (figur 3) kan bidra till patologin vid BPH eller prostatacancer med en inflammatorisk komponent (Sfanos et al., 2013; Davidsson et al., 2016). Det är dock för närvarande oklart om P. acnes representerar ett verkligt infektionsmedel i prostatan, en kommensal eller oavsiktlig mikrobion i prostatan. Det är troligt att prostatalokaliserade P. acnes härstammar från huden som oavsiktligt introduceras, till exempel under en prostatabiopsi – en synpunkt som bör väcka farhågor i samband med vissa scenarier för diagnostisk bearbetning.
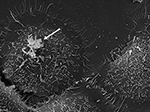
Figur 3. SEM av P. acnes stam P6 (pil) in vitro på odlade prostatapitelceller RWPE1. P. acnes invasiva beteende i prostataceller är väl dokumenterat i både in vivo och cellbaserade studier där en vimentinmedierad invasionsprocess verkar trolig (Mak et al., 2012). Mikroskopi av Volker Brinkmann, Max Planck Institute for Infection Biology, Berlin, Tyskland. Skalstreck = 2 μm.
Oavsett intrångsväg eller patogen potential har ett betydande antal prostatavävnader som erhållits genom transuretral resektion för BPH, eller radikal prostatektomi för cancer, tidigare testats positiva för P. acnes-aggregat som uppenbarligen befinner sig i kringvandrande makrofager (Alexeyev et al., 2007; Bae et al., 2014). Ytterligare rapporter baserade på mänskliga prover har gett ytterligare bevis för en koppling mellan BPH eller prostatacancer och P. acnes med hjälp av olika tekniska tillvägagångssätt, inklusive odling, konfokalmikroskopi för visualisering av bakterien och in situ-hybridisering, immunohistokemi (figur 4) och PCR-baserad profilering av bakteriens 16S rRNA (Hochreiter et al., 2000; Cohen et al., 2005; Sfanos et al., 2008; Fassi-Fehri et al., 2011; Bae et al., 2014; Davidsson et al., 2016). Ytterligare bevis kommer från djurstudier som visar att inokulering av P. acnes i prostatan och urinblåsan hos murin eller råtta leder till ett uppenbart, långvarigt inflammatoriskt svar och ett brett spektrum av cellulära störningar i prostatakörteln (Olsson et al., 2012; Shinohara et al., 2013).
Figur 4. Immunohistokemi av mänskliga prostatavävnadsprover färgade med P. acnes-antikropp (röd). Anpassad med tillstånd från Fassi-Fehri et al., 2011 (kompletterande figur 2B). Förekomst av P. acnes i prostatavävnadsprover från människa med benign prostatahyperplasi (A, B) eller adenokarcinom (C, D). Omfattande bakteriebelastning påvisades i båda fallen.
Fylogenetiska försök att analysera sjukdomsassocierade P. acnes-stammar från prostatakörtlar med cancer har visat att de flesta isolat från prostatan tillhör fylogenetiska klasser som är sällsynta på mänsklig hud, vilket tyder på att en kontaminering från huden under provtagningen är osannolik (Mak et al., 2013; Davidsson et al., 2016). I samma anda verkar liknande inflammatoriska vägar som de som beskrivs för sarkoidos, inklusive NF-κB, IL-6, STAT3 och COX2, aktiveras av P. acnes både under in situ- och in vitro-förhållanden (Drott et al., 2010; Fassi-Fehri et al., 2011; Mak et al., 2013; Tsai et al., 2013; Bae et al., 2014). Även om den exakta etiologin för dessa inflammatoriska förändringar ännu inte är klarlagd är flera membranbundna receptorvägar för mönsterigenkänning brett spridda i däggdjurens urin- och genitala system som ivrigt känner igen bakteriella och virala komponenter (Jorgensen och Seed, 2012; Gambara et al., 2013). Dessa värdcellsreceptorer, till exempel TLRs, främjar cytokinproduktion som är ett centralt inslag i den medfödda immuniteten mot mikrobiella patogener. Sammantaget tyder dessa fynd på att invaderande P. acnes genom sin förmåga att utlösa olika aspekter av immunitet kan fungera som primär drivkraft och/eller förstärkare av sjukdomens svårighetsgrad.
Spondylodiscitis och ryggsmärta
En av flera postoperativa komplikationer där P. acnes är inblandad är inflammation av den intervertebrala skivan och det omgivande intervertebrala utrymmet (diskit) efter diskektomi (Harris et al., 2005). Samtidig degenerativ infektion av intilliggande kotor (spondylodiscitis) kan vara ett vanligt inslag och grundorsaken till allvarliga neurologiska skador och smärta om behandlingen fördröjs (Uçkay et al., 2010). Förutom oavsiktlig kirurgisk introduktion rakt in i kotpelaren kan patogener också komma in via den arteriella och venösa blodtillförseln från ryggraden (hematogen spridning). Staphylococcus aureus, Escherichia coli och Proteus-arter isoleras oftast, men P. acnes är den vanligaste anaeroba patogenen i detta sammanhang och är sannolikt underrapporterad på grund av odlingsproblem. Det har funnits vissa kliniska bevis för att patienter med diskmaterial med herniation (nucleus pulposus) som infekterats med anaeroba patogener i allmänhet, och P. acnes i synnerhet, är mer benägna att utveckla inflammation och ödem i de intilliggande kotorna (Modic-förändringar typ I) och ryggsmärta (Albert et al., 2013; Urquhart et al., 2015). Kliniska och djurbaserade uppföljningar bekräftar nu de första fynden som visar att lokal P. acnes-proliferation orsakar uppreglering av inflammatoriska markörer och diskdegeneration som överensstämmer med Modic-förändringar (Aghazadeh et al., 2016; Dudli et al., 2016). Det finns nu även första kliniska bevis som tyder på att bakteriell infektion av den intervertebrala disken med P. acnes och/eller Staphylococcus epidermidis faktiskt kan föregå alla andra problem som grundorsak till diskbråck och tillhörande patologiska förändringar (Rajasekaran et al, 2017).
Parkinsons sjukdom (PD)
Den degenererande hjärnan kännetecknas av skador på det neurala systemet som kan tillskrivas atypisk aggregering och deponering av muterade eller felveckade proteiner (t.ex. Lewy-kroppar och Lewy-neuriter), vilket är tydligt dokumenterat vid idiopatisk PD (Taylor et al., 2002). Vad som i allmänhet inte uppskattas är att hjärnan också är mottaglig för invaderande patogener som sträcker sig från virus och bakterier till svampar. Dessa patogener, eller mer specifikt deras endogena komponenter och/eller metaboliter, kan ge upphov till centrala neurologiska brister som sträcker sig från subtila tecken på demens och dystoni, som är ett resultat av kronisk, återkommande infektion (De Chiara et al., 2012; Bibi et al., 2014), till allvarligare motoriska neuronsjukdomar som till exempel observerats med det humana endogena retroviruset K (Li et al., 2015). Det står alltså klart att människor har en enormt tung systemisk belastning av mikrober (Potgieter et al., 2015; Spadoni et al., 2015) som kan bidra till patologin i progressiva neurodegenerativa sjukdomar med atypiska proteinkomponenter. Denna arbetshypotes får förvisso stort stöd eftersom kognitivt, emotionellt eller patologiskt beteende tycks påverkas indirekt av den rumsliga och personliga fördelningen av mikrober som verkar genom axeln mellan tarm och hjärna (figur 5) (Collins et al., 2012; Dinan et al., 2013; Mayer et al., 2014; Burokas et al., 2015). En nyligen genomförd fall-kontrollstudie visade faktiskt att mikrobiell variation i mag-tarmkanalen, både mellan och inom individer; korresponderar mest signifikant med fenotypiska variationer i PD (Scheperjans et al., 2015; Vizcarra et al., 2015). Även om de underliggande mekanismerna som kopplar samman sammansättningen av mikrobiota med skillnader i PD inte är klara, kan ovanstående resultat åtminstone förklara den höga prevalensen av gastrointestinala avvikelser som ses hos PD-patienter (Dobbs et al., 2016). Ytterligare en koppling mellan mikrobiota och svårighetsgrad av PD, visade sigmoidmukosala biopsier och avföringsmaterial som samlats in från PD-patienter förekomst av opportunistiska och proinflammatoriska bakteriearter som ofta orsakar kronisk förstoppning, irritabelt tarmsyndrom och ulcerös kolit (Keshavarzian et al., 2015). Sammantaget tyder dessa första resultat på att relationer mellan olika mikrobiella samhällen i tarmen är en vanlig komorbiditet vid PD, och att unika individuella signaturer i tarmekosystemet kan förstärka klassiska motoriska funktionsnedsättningar vid PD.
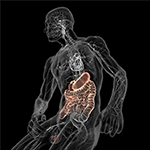
Figur 5. Schematisk illustration av axeln mellan tarm och hjärna (färgad) med det mikrobfyllda matsmältningssystemet i ena änden och hjärnan med dess homeostascentra (hypotalamus och hypofys) i den andra. Båda är sammankopplade genom det kardiovaskulära och autonoma nervsystemet, inklusive vagusnerven (kranialnerv X) som skulle kunna underlätta mikrobiell övergång till det centrala nervsystemet (CNS). Med tillstånd från Bryan Christie Design (http://bryanchristiedesign.com/).
Med denna bakgrund är frågan om det finns några bevis för att P. acnes spelar någon roll i patofysiologin vid PD. För att denna möjlighet ska kunna uppstå måste två villkor vara uppfyllda: (1) P. acnes-infektion måste föregå förekomsten av klassiska symtom på sjukdomen såsom skakningar, motorisk initiering och långsamma rörelser, och (2) P. acnes-inokulering måste i tillräcklig utsträckning framkalla symtom på PD och/eller leda till förlust av dopaminprojektionsneuroner i mellanhjärnans kärna som kallas substantia nigra pars compacta. Hittills har vårt laboratorium upptäckt kluster av P. acnes lokaliserade till neuroner i mellanhjärnan och närliggande kortikala strukturer i autopsierade PD-hjärnor (figur 6). Detta oväntade fynd ger ytterligare trovärdighet åt att P. acnes indirekt bidrar till lokala inflammationsattacker som liknar dem som ses vid sarkoidos och BPH. En öppen fråga är i vilken utsträckning P. acnes indirekt kan förstärka vissa patologiska egenskaper hos PD. Eftersom PD är en mycket heterogen sjukdom är det osannolikt att en sjukdomsmekanism gäller för alla PD-fenotyper. Det är dock spännande att spekulera i att inhemska hudmikrober kan initiera eller förstärka PD-progressionen genom inflammatoriska och/eller genetiska predispositionsfaktorer.

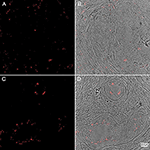
Figur 6. Immunohistokemi av vävnadsprover från mänsklig PD-mellanhjärna färgade för P. acnes (grönt; A+B), neuronala mikrotubuli (MAP2; rött; A) och kärnor (DAPI; blått; A+B). Åldersrelaterad lipofuscin-fluorescens släcktes med Sudan Black B. Förekomst av P. acnes (pil) i det periplasmatiska utrymmet i en mänsklig neuron (A) mellan kärna (n) och cytoskelett, eller neutrofil (B) med dess karakteristiska flerväxande kärna i en kapillär i mellersta hjärnan (Cap). Dessa fynd är typiska för PD och saknas i de flesta kontrollsektioner. Retrograda rörelser längs kranialnerver, traumainducerade mikroblödningar samt det nyupptäckta glymphatiska systemet utgör potentiella mikrobiella vägar in i CNS.
Om P. acnes kan få tillgång till dopaminceller i mellanhjärnan, vilken är då den mest sannolika vägen för inokulering och infektion? Även om huden är fysiskt uppdelad från hjärnan förblir korsinokulering en riskfaktor. Till exempel kan näsan potentiellt hysa patogena P. acnes-stammar som sedan translokeras till hjärnans parenkym för att hyperaktivera lokala makrofager som kallas mikroglia; ett fenomen som är ett genomgående inslag i PD-patologin (granskad av Chao et al., 2014). Forskning om nosokomiala infektioner visar att så olika bakteriearter som Pneumococcus sp. (Zwijnenburg et al., 2001) och Salmonella sp. (Bollen et al., 2008) lätt vandrar längs luktnerven (kranialnerv 1; CN 1) och slutligen in i luktbulben. En annan potentiell ingångsväg för skadliga mikrober eller farliga felveckade proteiner är vagusnerven (kranialnerv 10; CN 10). Under vissa omständigheter verkar felveckade aggregat i form av Lewy-kroppar och Lewy-neuriter faktiskt vandra från vagusnerven till hjärnan, vilket ger ytterligare bevis för att patogena bakterier i förening med toxiska proteiner potentiellt kan bidra till selektiv neuronal sårbarhet (Holmqvist et al., 2014). Av intresse är att hjärnkärnor i CN 1 och CN 10 är bland de första platserna som företrädesvis visar deponering av Lewy-kroppar och Lewy-neuriter under PD-progressionen (Braak et al., 2004). Denna särskilda observation lyfter inte bara fram en trolig ingångsväg för bakterier till hjärnan, utan ger också en potentiell mekanism för observationen att truncal vagotomi signifikant minskar risken för PD (Svensson et al., 2015). Kopplingen mellan huvudtrauma och PD (Harris et al., 2013; Jafari et al., 2013; Pearce et al., 2015), tillsammans med föreställningen om ett diversifierat blodmikrobiom (Potgieter et al., 2015), innebär en stor potential för patogen opportunism när traumatiska brott i blod-hjärnbarriären uppstår. Med den nyligen gjorda upptäckten av ett lymfatiskt system i hjärnan (glymphatiskt system) (Iliff et al., 2012; Hitscherich et al., 2016) måste ytterligare en potentiell väg för infektion i hjärnan beaktas.
Tillsammantaget finns det prekliniska och vissa kliniska bevis för att indirekt involvera P. acnes som en oberoende variabel som påverkar förekomst eller svårighetsgrad av PD. Dessa bevis kompletteras av rapporter som associerar en allvarlig hudsjukdom, acne inversa, med Alzheimers sjukdom (Wang et al., 2010). Ur ett terapeutiskt perspektiv utgör möjligheten att P. acnes driver eller förstärker centrala egenskaper hos PD en viktig resurs för antibiotiska metoder mot neurodegenerativa sjukdomar. Och ur ett forskningsperspektiv skulle det vara värt att undersöka patienter med hudsjukdomar närmare för att hitta tecken på neuropatologi med tidigare debut och en allvarligare sjukdomsfenotyp.
Framtida utsikter
Den översikt som presenteras i den här artikeln skisserar en oväntad mörk sida av P. acnes med avseende på patologi. Intracellulär persistens av P. acnes är inblandad i sjukdomar i lungorna och prostatakörteln och möjligen i hjärnan. Detta är ett tydligt vittnesbörd om patogeniteten hos bakterier som härstammar från huden i vissa sjukdomsfenotyper. Ytterligare undersökningar kommer att behöva inriktas på flera frågor om P. acnes biologi: (1) Vilka är de avgörande interaktionerna mellan P. acnes och sjukdomskänslighet? (2) Vilka mekanismer använder P. acnes för att påverka sjukdomsutvecklingen? (3) Om vissa populationer av P. acnes kan öka känsligheten för sjukdomens svårighetsgrad, finns det då andra konfigurationer av P. acnes som är skyddande? (4) Bevis på att P. acnes-infektion har ett direkt samband med sjukdomspatologi, eller mer specifikt, visar studien av konceptet på orsakssamband eller bara korrelation? Och slutligen (5) Kan P. acnes-driven sjukdomspatologi behandlas med konventionell antibiotikabehandling och diagnostiska tillämpningar?
Författarnas bidrag
JL, KER, JC, KR, CH, AM, HB och GT har utarbetat manuskriptet. JL och MS förberedde figurerna.
Finansiering
Intramurala medel till JL tillhandahölls av NYIT College of Osteopathic Medicine.
Intressekonfliktutlåtande
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna uppfattas som en potentiell intressekonflikt.