Dessa konformationsförändringar gör också att de katalytiska resterna i den aktiva platsen kommer nära de kemiska bindningarna i substratet som kommer att förändras i reaktionen. Efter att bindningen har ägt rum sänker en eller flera katalysmekanismer energin i reaktionens övergångstillstånd genom att tillhandahålla en alternativ kemisk väg för reaktionen. Det finns sex möjliga mekanismer för katalys ”över barriären” samt en mekanism ”genom barriären”:
Närhet och orienteringRedigera
Sambanden mellan enzym och substrat anpassar de reaktiva kemiska grupperna och håller dem nära varandra i en optimal geometri, vilket ökar reaktionshastigheten. Detta minskar reaktanternas entropi och gör därmed additions- eller överföringsreaktioner mindre ogynnsamma, eftersom en minskning av den totala entropin när två reaktanter blir en enda produkt. Detta är dock en allmän effekt och ses i reaktioner som inte är additions- eller överföringsreaktioner, där den uppstår på grund av en ökning av den ”effektiva koncentrationen” av reagenserna. Man förstår detta när man ser hur en ökad koncentration leder till ökad reaktionshastighet: när reaktanterna är mer koncentrerade kolliderar de oftare och reagerar därför oftare. Vid enzymkatalys begränsar reagensernas bindning till enzymet reaktanternas konformationsutrymme och håller dem i den ”rätta orienteringen” och nära varandra, så att de kolliderar oftare och med rätt geometri för att underlätta den önskade reaktionen. Den ”effektiva koncentrationen” är den koncentration som reaktanten skulle behöva vara i fri lösning för att uppleva samma kollisionsfrekvens. Ofta är sådana teoretiska effektiva koncentrationer ofysikaliska och omöjliga att förverkliga i verkligheten – vilket är ett bevis på den stora katalytiska kraften hos många enzymer, med massiva hastighetsökningar jämfört med det okatalyserade tillståndet.
Till exempel:
Samma reaktioner kommer att ske mycket snabbare om reaktionen är intramolekylär.

Den effektiva koncentrationen av acetat i den intramolekylära reaktionen kan uppskattas till k2/k1 = 2 x 105 Molar.
Situationen kan dock vara mer komplicerad, eftersom moderna beräkningsstudier har fastställt att de traditionella exemplen på närhetseffekter inte kan relateras direkt till enzymentropiska effekter. Dessutom har det ursprungliga entropiska förslaget visat sig i hög grad överskatta orienteringsentropins bidrag till katalysen.
Protondonatorer eller -acceptorerRedigera
Protondonatorer och -acceptorer, dvs. syror och baser kan donera och acceptera protoner för att stabilisera utvecklande laddningar i övergångstillståndet. Detta är relaterat till katalysens övergripande princip, nämligen att minska energibarriärerna, eftersom övergångstillstånd i allmänhet är tillstånd med hög energi, och genom att stabilisera dem minskas denna höga energi, vilket sänker barriären. En viktig egenskap hos enzymkatalysen jämfört med många andra icke-biologiska katalyser är att både syra- och baskatalys kan kombineras i samma reaktion. I många abiotiska system kan syror (stora) eller baser (stora koncentrationer av H+-sänkor eller arter med elektronpar) öka reaktionshastigheten, men miljön kan naturligtvis bara ha ett övergripande pH (mått på surhet eller basiskhet (alkalinitet)). Eftersom enzymer är stora molekyler kan de dock placera både syragrupper och basiska grupper i sin aktiva plats för att interagera med sina substrat och använda båda sätten oberoende av det totala pH-värdet.
Ofta används allmän syra- eller baskatalys för att aktivera nukleofila och/eller elektrofila grupper eller för att stabilisera avgående grupper. Många aminosyror med sura eller basiska grupper används i den aktiva platsen, t.ex. glutaminsyra och asparaginsyra, histidin, cystin, tyrosin, lysin och arginin samt serin och threonin. Dessutom används ofta en peptidryggrad med karbonyl- och amid-N-grupper. Cystin och histidin är mycket vanligt förekommande, eftersom de båda har en pKa nära neutralt pH och därför både kan acceptera och donera protoner.
Många reaktionsmekanismer som inbegriper syra/bas-katalys förutsätter en väsentligt förändrad pKa. Denna förändring av pKa är möjlig genom restens lokala miljö.
| Förhållanden | Syror | Baser |
|---|---|---|
| Hydrofobisk miljö | Förhöjning av pKa | Förminskning av pKa |
| Närliggande rester med samma laddning | Förstärkning. pKa | Förlust pKa |
| Saltbryggor (och väte bindningar) bildas |
Förlust pKa | Förlust pKa |
pKa kan också påverkas avsevärt av den omgivande miljön, i så måtto att rester som är basiska i lösningen kan fungera som protondonatorer, och vice versa.
Till exempel:
Katalytisk triad hos ett serinproteas
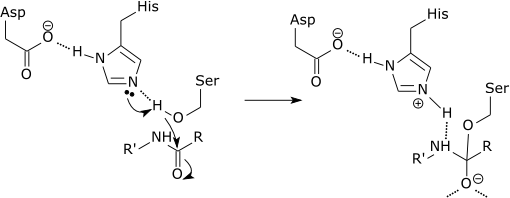
Det första steget i den katalytiska mekanismen hos serinproteaset innebär att histidinet på den aktiva platsen accepterar en proton från serinresterna. Detta förbereder serinet som nukleofil för att angripa substratets amidbindning. Denna mekanism innefattar donation av en proton från serin (en bas, pKa 14) till histidin (en syra, pKa 6), vilket möjliggörs på grund av basernas lokala miljö.
Det är viktigt att klargöra att modifieringen av pKa:erna är en ren del av den elektrostatiska mekanismen. Vidare är den katalytiska effekten i ovanstående exempel huvudsakligen förknippad med minskningen av oxyanjonens pKa och ökningen av histidinets pKa, medan protonöverföringen från serin till histidin inte katalyseras nämnvärt, eftersom den inte är den hastighetsbestämmande barriären.
Elektrostatisk katalysEdit
Stabilisering av laddade övergångstillstånd kan också ske genom att rester i den aktiva platsen bildar joniska bindningar (eller partiella joniska laddningsinteraktioner) med intermediären. Dessa bindningar kan antingen komma från sura eller basiska sidokedjor som finns på aminosyror som lysin, arginin, asparaginsyra eller glutaminsyra eller komma från metallkofaktorer som zink. Metalljoner är särskilt effektiva och kan minska vattnets pKa tillräckligt för att göra det till en effektiv nukleofil.
Systematiska datorsimuleringsstudier fastställde att elektrostatiska effekter ger det överlägset största bidraget till katalysen. De kan öka reaktionshastigheten med en faktor på upp till 107. I synnerhet har man funnit att enzym ger en miljö som är mer polär än vatten och att de joniska övergångstillstånden stabiliseras av fasta dipoler. Detta skiljer sig mycket från stabiliseringen av övergångstillstånd i vatten, där vattenmolekylerna måste betala med ”reorganiseringsenergi”. För att stabilisera joniska och laddade tillstånd. Katalysen är således förknippad med det faktum att enzymets polära grupper är förorganiserade
Storleken på det elektrostatiska fältet som utövas av ett enzyms aktiva plats har visat sig vara starkt korrelerat med enzymets katalytiska hastighetsförbättring
Bindning av substratet utesluter vanligen vatten från den aktiva platsen, vilket sänker den lokala dielektricitetskonstanten till den hos ett organiskt lösningsmedel. Detta stärker de elektrostatiska interaktionerna mellan de laddade/polära substraten och de aktiva platserna. Dessutom har studier visat att laddningsfördelningarna kring de aktiva platserna är arrangerade så att de stabiliserar övergångstillstånden i de katalyserade reaktionerna. I flera enzymer tjänar dessa laddningsfördelningar uppenbarligen till att styra polära substrat mot sina bindningsställen så att hastigheterna för dessa enzymatiska reaktioner är högre än deras uppenbara diffusionskontrollerade gränser.
Till exempel:
Carboxypeptidas katalytiska mekanism

Den tetraedriska intermediären stabiliseras av en partiell jonbindning mellan Zn2+-jonen och den negativa laddningen på syret.
Kovalent katalysEdit
Kovalent katalys innebär att substratet bildar en övergående kovalent bindning med rester i enzymets aktiva plats eller med en kofaktor. Detta tillför ytterligare en kovalent intermediär till reaktionen och bidrar till att minska energin för senare övergångstillstånd i reaktionen. Den kovalenta bindningen måste brytas i ett senare skede av reaktionen för att enzymet ska kunna återskapas. Denna mekanism utnyttjas av den katalytiska triaden hos enzymer som proteaser som chymotrypsin och trypsin, där en acylenzymintermediär bildas. En alternativ mekanism är schiffbasbildning med hjälp av den fria aminen från en lysinrest, vilket ses i enzymet aldolas under glykolysen.
Vissa enzymer använder icke-aminosyrakofaktorer som pyridoxalfosfat (PLP) eller tiaminpyrofosfat (TPP) för att bilda kovalenta intermediärer med reaktantmolekyler. Sådana kovalenta intermediärer fungerar för att minska energin i senare övergångstillstånd, på samma sätt som kovalenta intermediärer som bildas med aminosyrarester på den aktiva platsen möjliggör stabilisering, men kofaktorernas förmåga gör det möjligt för enzymerna att utföra reaktioner som aminosyrasidoresterna ensamma inte skulle kunna utföra. Enzymer som använder sådana kofaktorer är bland annat det PLP-beroende enzymet aspartattransaminas och det TPP-beroende enzymet pyruvatdehydrogenas.
Snarare än att sänka aktiveringsenergin för en reaktionsväg ger kovalent katalys en alternativ väg för reaktionen (via den kovalenta intermediären) och skiljer sig därför från verklig katalys. Exempelvis bör energin för den kovalenta bindningen till serinmolekylen i chymotrypsin jämföras med den välkända kovalenta bindningen till nukleofilen i den okatalyserade lösningsreaktionen. Ett verkligt förslag på en kovalent katalys (där barriären är lägre än motsvarande barriär i lösning) skulle kräva till exempel en partiell kovalent bindning till övergångstillståndet av en enzymgrupp (t.ex. en mycket stark vätebindning), och sådana effekter bidrar inte nämnvärt till katalysen.
MetalljonkatalysRedigera
En metalljon i den aktiva platsen deltar i katalysen genom att samordna laddningsstabilisering och avskärmning. På grund av en metalls positiva laddning kan endast negativa laddningar stabiliseras genom metalljoner. Metalljoner är dock fördelaktiga i biologisk katalys eftersom de inte påverkas av förändringar i pH. Metalljoner kan också verka för att jonisera vatten genom att fungera som en Lewis-syra. Metalljoner kan också vara agenter för oxidation och reduktion.
Bond strainEdit
Detta är den huvudsakliga effekten av inducerad passformsbindning, där enzymets affinitet till övergångstillståndet är större än till själva substratet. Detta inducerar strukturella omarrangemang som spänner substratbindningarna till en position som ligger närmare konformationen i övergångstillståndet, vilket sänker energidifferensen mellan substratet och övergångstillståndet och bidrar till att katalysera reaktionen.
Den så kallade strain-effekten är dock i själva verket en destabiliseringseffekt av grundtillståndet snarare än en stabiliseringseffekt av övergångstillståndet. Dessutom är enzymer mycket flexibla och de kan inte applicera stor straineffekt.
Förutom bindningsspänning i substratet kan bindningsspänning också induceras i själva enzymet för att aktivera rester i den aktiva platsen.
Till exempel:
Substrats-, bundet substrat- och övergångstillståndskonformationer hos lysozym.
Substratet vid bindning, förvrängs från hexoseringens halva stolskonformation (på grund av det steriska hindret med aminosyror i proteinet som tvingar den ekvatoriella c6 att befinna sig i axialläge) till stolskonformationen
Quantum tunnelingEdit
Dessa traditionella ”över barriären”-mekanismer har i vissa fall ifrågasatts av modeller och observationer av ”genom barriären”-mekanismer (quantum tunneling). Vissa enzymer arbetar med en kinetik som är snabbare än vad som skulle förutsägas av den klassiska ΔG‡. I modeller för ”genom barriären” kan en proton eller en elektron tunnla genom aktiveringsbarriärer. Kvanttunnling för protoner har observerats vid tryptaminoxidation av aromatiskt amindehydrogenas.
Kvanttunnling tycks inte ge någon större katalytisk fördel, eftersom tunnlingsbidragen är likartade i de katalyserade och icke-katalyserade reaktionerna i lösning. Tunneldragningen (som vanligtvis förbättrar hastighetskonstanter med en faktor ~1000 jämfört med reaktionshastigheten för den klassiska ”över barriären”-vägen) är dock sannolikt avgörande för biologiska organismers livskraft. Detta understryker den allmänna betydelsen av tunnelreaktioner i biologin.
I 1971-1972 formulerades den första kvantmekaniska modellen av enzymkatalysen.
Aktivt enzymRedigera
Bindningsenergin i enzym-substratkomplexet kan inte betraktas som en extern energi som är nödvändig för substrataktiveringen. Ett enzym med högt energiinnehåll kan först överföra en viss specifik energigrupp X1 från enzymets katalytiska plats till den första bundna reaktantens slutplats, sedan måste en annan grupp X2 från den andra bundna reaktanten (eller från den andra gruppen av den enskilda reaktanten) överföras till den aktiva platsen för att slutföra omvandlingen av substratet till produkt och enzymregenerering.
Vi kan presentera hela den enzymatiska reaktionen som två kopplingsreaktioner:
|
S 1 + EX 1 ⟶ S 1 EX 1 ⟶ P 1 + EP 2 {\displaystyle {\ce {{S1}+ EX1 -> S1EX1 -> {P1}+ EP2}}}}
 |
|
(1) |
|
S 2 + EP 2 ⟶ S 2 EP 2 ⟶ P 2 + EX 2 {\displaystyle {\ce {{S2}+ EP2 -> S2EP2 -> {P2}+ EX2}}}}
 |
|
(2) |
Det framgår av reaktion (1) att gruppen X1 i det aktiva enzymet förekommer i produkten på grund av möjligheten till utbytesreaktion inuti enzymet för att undvika både elektrostatisk hämning och repulsion av atomer. Vi framställer alltså det aktiva enzymet som en kraftfull reaktant i den enzymatiska reaktionen. Reaktionen (2) visar en ofullständig omvandling av substratet eftersom dess grupp X2 finns kvar i enzymet. Detta tillvägagångssätt har tidigare föreslagits med utgångspunkt i hypotetiska extremt höga enzymatiska omvandlingar (katalytiskt perfekt enzym).
Den avgörande punkten för att verifiera det nuvarande tillvägagångssättet är att katalysatorn måste vara ett komplex av enzymet med reaktionens överföringsgrupp. Denna kemiska aspekt stöds av de välstuderade mekanismerna för flera enzymatiska reaktioner. Tänk på reaktionen med hydrolys av peptidbindningar som katalyseras av ett rent protein α-chymotrypsin (ett enzym som verkar utan en kofaktor), som är en välstuderad medlem av serinproteasfamiljen, se.
Vi presenterar de experimentella resultaten för denna reaktion som två kemiska steg:
|
S 1 + EH ⟶ P 1 + EP 2 {\displaystyle {\ce {{S1}+ EH -> {P1}+ EP2}}}}
 |
|
(3) |
|
EP 2 + H – O – H ⟶ EH + P 2 {\displaystyle {\ce {{EP2}+ {H-O-H}-> {EH}+ P2}}}}
 |
|
(4) |
där S1 är en polypeptid, P1 och P2 är produkter. Det första kemiska steget (3) omfattar bildandet av en kovalent acylenzymintermediär. Det andra steget (4) är steget för deacylering. Det är viktigt att notera att gruppen H+, som ursprungligen finns på enzymet, men inte i vatten, förekommer i produkten före hydrolyssteget, varför den kan betraktas som en ytterligare grupp i den enzymatiska reaktionen.
Därmed visar reaktionen (3) att enzymet fungerar som en kraftfull reaktant i reaktionen. Enligt det föreslagna konceptet främjar H-transporten från enzymet den första reaktantomvandlingen, nedbrytning av den första inledande kemiska bindningen (mellan grupperna P1 och P2). Hydrolyssteget leder till nedbrytning av den andra kemiska bindningen och regenerering av enzymet.
Den föreslagna kemiska mekanismen är inte beroende av koncentrationen av substrat eller produkter i mediet. En förskjutning av deras koncentration orsakar dock huvudsakligen förändringar i den fria energin i de första och sista stegen i reaktionerna (1) och (2) på grund av förändringarna i det fria energiinnehållet hos varje molekyl, oavsett om det är S eller P, i vattenlösning.Detta tillvägagångssätt överensstämmer med följande mekanism för muskelkontraktion. Det sista steget i ATP-hydrolysen i skelettmuskulaturen är den produktfrisättning som orsakas av myosinhuvudenas förening med aktin. Stängningen av den aktinbindande klyftan under associationsreaktionen är strukturellt kopplad till öppnandet av den nukleotidbindande fickan på myosinets aktiva plats.
Noterbart är att de sista stegen i ATP-hydrolysen innefattar den snabba frisättningen av fosfat och den långsamma frisättningen av ADP.Frigörandet av en fosfatanjon från bunden ADP-anjon till vattenlösning kan betraktas som en exergonisk reaktion eftersom fosfatanjonen har låg molekylmassa.
Därmed kommer vi fram till slutsatsen att det primära frigörandet av det oorganiska fosfatet H2PO4- leder till att en betydande del av den fria energin från ATP-hydrolysen omvandlas till den kinetiska energin hos den solvatiserade fosfaten, vilket producerar aktiv strömning. Detta antagande om en lokal mekanisk-kemisk transduktion stämmer överens med Tiroshs mekanism för muskelkontraktion, där muskelkraften härrör från en integrerad verkan av aktiv strömning som skapas av ATP-hydrolys.