Acetylering är en reaktion som introducerar en acetylfunktionell grupp i en kemisk förening, där väteatomen i en hydroxylgrupp ersätts med en acetylgrupp (CH3 CO) för att ge en specifik ester, acetat. Proteinacetylering har vanligtvis två olika former. Hos människor blir nästan (80-90 %) av proteinerna samtranslationellt acetylerade vid deras Nα-terminaler i de framväxande polypeptidkedjorna. En annan typ acetyleras vanligtvis på lysinrester.
N-terminal acetylering
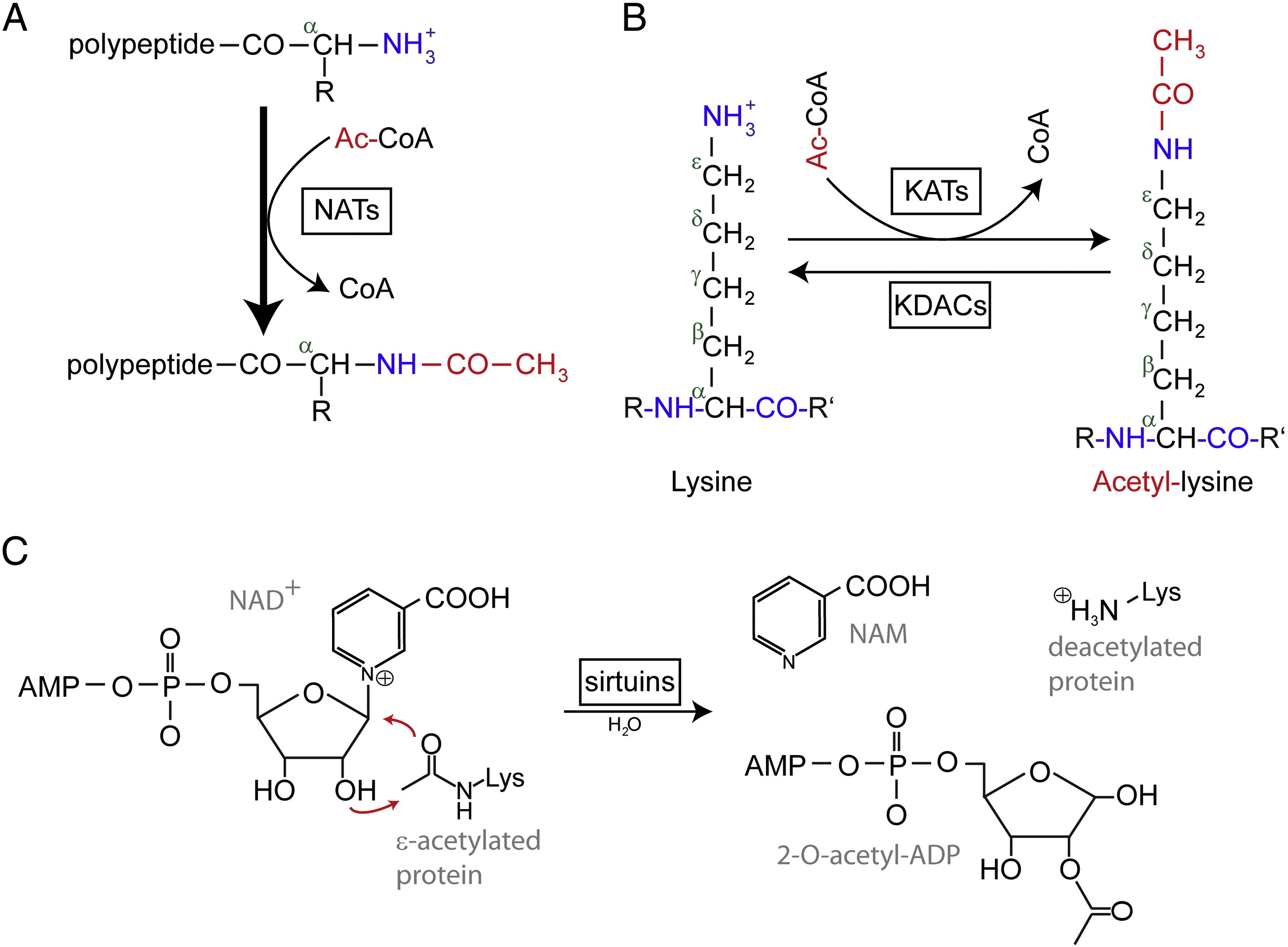
N-terminal (Nt) acetylering katalyseras av Nt-acetyltransferaser (NATs) och har hittills visat sig vara irreversibel. NATs, enzymer med en eller flera enheter som består av en katalytisk underenhet och upp till två hjälpsubenheter, kan överföra en acetylgrupp från acetyl-coenzym A (Ac-CoA) till α-aminogruppen i proteinets första aminosyrarest. I NATs modulerar den stora hjälpsubenheten den katalytiska subenhetens aktivitet och substratspecificitet. Olika NATs är ansvariga för acetyleringen av Nt. Hos människor har man hittills funnit sex NATs, däribland NatA, NatB, NatC, NatD, NatE och NatF. Förutom skillnaden i sammansättningen av underenheterna varierar de olika NAT:erna i sin substratspecificitet.
Nt-acetylering spelar olika roller i molekylära effekter. För det första bestämmer Nt-acetylering den subcellulära lokaliseringen för vissa proteiner. Arl3 och Grh1, två Golgi-associerade proteiner, kan till exempel inte associera sig med Golgiapparaten när de saknar Nt-acetylgruppen. För det andra rapporteras det att Nt-acetylering håller tillbaka proteiner i cytosolen och hämmar en posttranslationell translokaliseringsmigration till endoplasmatiska retikulet (ER) och den sekretoriska vägen. Dessutom kan Nt-acetylering förändra egenskaperna hos N-terminalen så att protein-proteininteraktioner moduleras. Det visades för flera proteiner att affiniteten till deras bindningspartner ökade efter Nt-acetylering. Exempelvis genomgår det E2 ubiquitin-konjugerande enzymet Ubc12 Nt-acetylering av NatC, vilket möjliggör en ökad affinitet till dess interaktionspartner, E3 ubiquitinligaset Dcn1. Dessutom kontrollerar Nt-acetylering proteinets kvalitet och livslängd och reglerar proteinets stökiometri genom N-end rule pathway.
N-terminal acetylering har många funktioner i fysiologin. NATs är viktiga för normal utveckling, ben- och blodkärlsutveckling. N-terminal acetylering kan reglera blodtryck, proteasomlokalisering, hormon samt organell struktur och funktion. I mänskliga sjukdomar är den relaterad till neurodegenerativa sjukdomar (som Alzheimers sjukdom, Parkinsons sjukdom och Lewykroppsdemens) och cancer (som lungcancer, bröstcancer, kolorektalcancer).
Lysinacetylering
Acetylerade lysinrester upptäcktes först i histoner som reglerar gentranskription. Men lysinacetylering är inte begränsad till histoner. Till skillnad från Nt-acetylering är lysinacetylering reversibel. Acetyleringen katalyseras av lysinacetyltransferaser (KAT) och deacetyleringen av lysinrester katalyseras av lysindeacetylaser (KDAC).
Det rapporteras att 17-22 gener KATs har identifierats i det mänskliga genomet (det exakta antalet KATs är kontroversiellt), som kan klassificeras i tre olika familjer, inklusive GCN5 (general control non-derepressible 5)-relaterat acetyltransferas (GNAT)-familjen, MYST-familjen och p300/CBP-familjen (CREB-binding protein). KAT-komplexens kända substrat omfattar inte bara histonproteiner, utan även några olika transkriptionsfaktorer, transkriptionella samreglerare och vissa proteiner i specifika cellulära signalvägar som p53, β-catenin, NF-κB, MyoD eller Rb. Även vissa RNA-molekyler kan acetyleras. Det finns fyra olika typer av KDACs, däribland klass I, II, III och IV. Klass I, II och IV är Zn2 + -beroende amidohydrolaser, medan klass III (även kallad sirtuiner) använder NAD+ som co-substrat för sin katalytiska aktivitet är Zn2 + -beroende amidohydrolaser.
Historonerna är de första upptäckta acetylerade proteinerna. Histonmolekylerna modifieras av olika PTM, inklusive fosforylering, metylering och acetylering. Histonacetylering bestämmer histonernas sammansättning samt vikningen och kompaktheten i DNA-histoninteraktionen och utgör därför en omkoppling mellan tillåtande och repressiv kromatinstruktur. Förutom histoner kan KAT:er katalysera cytoskeletala proteiner. Det finns några nya identifierade acetyleringsställen i andra proteiner, inklusive HMG-proteiner, c-Myc, östrogen- och androgenreceptorer, E2F/Rb och så vidare.
De fysiologiska rollerna av lysinacetylering har rapporterats. Histonproteinerna är förknippade med en noggrann reglering av i princip alla typer av DNA-templerade processer som transkription, replikation, rekombination, reparation samt översättning och bildning av specialiserade kromatinstrukturer. Därför påverkar proteinlysinacetylering en rad cellulära signalvägar samt metabolism, stressreaktioner, apoptos och membrantrafik.
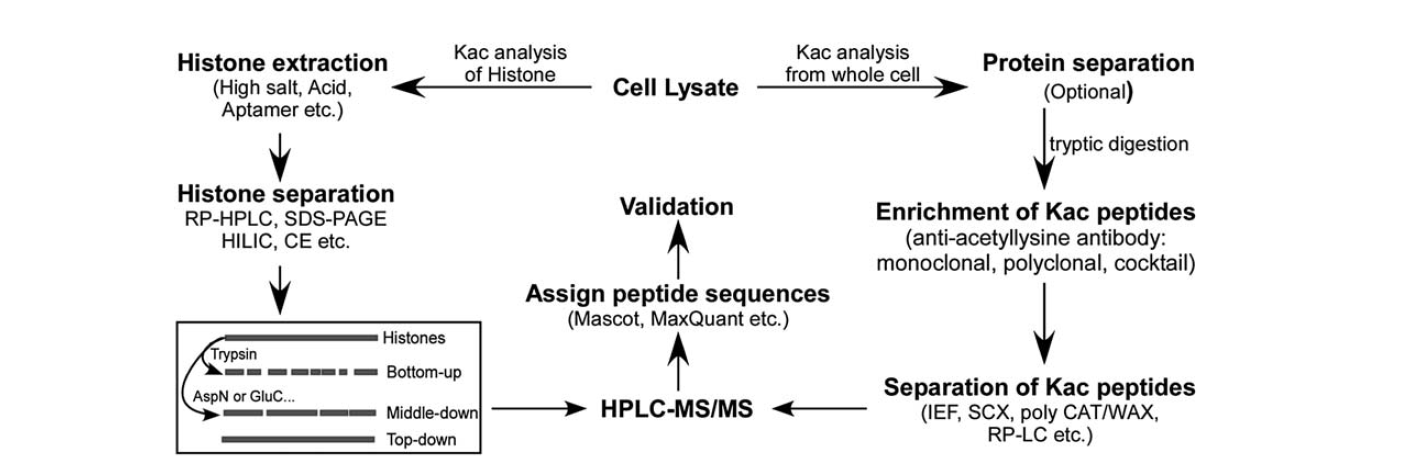
Det finns relativt få verktyg tillgängliga för att identifiera lysinacetylering. I och med utvecklingen av masspektrometri har det blivit ett viktigt verktyg för identifiering och kvantifiering av lysinacetylering. För att analysera histonlysinacetylering finns det flera steg, inklusive celllysat, histonextraktion, histonseparation, masspektrometri och dataanalys. Stegen för analys av lysinacetylering av proteiner från hela cellen omfattar celllysat, proteinseparation, anrikning av lysinacetyleringspeptider, separation av lysinacetyleringspeptider, masspektrometri och dataanalys.