
När klorgas bubblar genom en cylinder med tomatjuice blir klorin/tomatjuice-blandningen nästan helt vit inom fem minuter. Denna spektakulära förändring är ett resultat av klorets kemiska verkan, som fungerar som ett oxiderande blekmedel, på pigmenten i tomatjuice. När gamla tidningsurklipp, som missfärgats av åldrande och exponering för ljus, behandlas med en 1-procentig vattenlösning av natriumborohydrid blir pappret dramatiskt vitare inom tjugo minuter. I detta fall har pappret återfått sin ursprungliga vita färg genom att natriumborohydrid agerar som ett reducerande blekmedel.
Ett blekmedel är ett ämne som kan bleka eller avfärga andra ämnen. Färgade ämnen innehåller i allmänhet grupper av atomer, så kallade kromoforer , som kan absorbera synligt ljus med specifika, karakteristiska våglängder och reflektera eller överföra den del av ljuset som inte absorberas. Om en kromofor till exempel absorberar blått ljus kommer den att reflektera ljus i den komplementära färgen, och det kromoforinnehållande ämnet kommer att framstå som gult. Blekmedel förstör i huvudsak kromoforer (och tar därmed bort färgen) genom oxidation eller reduktion av dessa absorberande grupper. Blekmedel kan således klassificeras som antingen oxidationsmedel eller reduktionsmedel .
Några av användningsområdena för blekmedel är:
- Blekning av textilier och tyger
- Blekning av trämassa
- Borttagning av fläckar
- Kommersiell och hushållstvätt och rengöring
- . Som ingredienser i skurande rengöringsmedel och diskmedel
- Blekning av hår
Oxiderande blekmedel
Ett stort antal oxiderande blekmedel granskades av Jules A. Szilard i Bleaching Agents and Techniques (1973). De oxiderande blekmedel (och blekmedel) som används allmänt idag är: klor, klordioxid, alkaliska hypokloriter, väteperoxid, peroxygenföreningar samt solljus och artificiellt ljus.
Klor (Cl 2 ). Upptäckten av klor av den svenske kemisten Carl Wilhelm Scheele 1774 markerade början på den moderna eran av blekning. Enligt Sidney M. Edelstein i en tidskriftsartikel från 1948 med titeln ”The Role of Chemistry in the Development of Dyeing and Bleaching” var den franske kemisten Claude-Louis Berthollet den förste som använde klor för att bleka bomulls- och linnetyger.
Klor har använts för att bleka trämassa. Många massafabriker som använder Kraftmassaprocessen framställer natriumhydroxid (som behövs för att smälta träflis) på plats genom elektrolys av saltvatten, en koncentrerad vattenlösning av natriumklorid.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Klor är en biprodukt. Efterföljande klorblekning av den bruna massan ger en produkt som kan användas för tillverkning av skriv- och tryckpapper. Tyvärr oxideras och kloreras organiska föreningar i pappersmassan, vilket ger små mängder klororganiska föreningar, bland annat
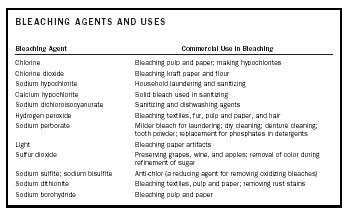
| Blekmedel och användningsområden | |
| Blekmedel | Kommersiell användning vid blekning |
| Klor | Blekning av massa och papper; framställning av hypokloriter |
| Klordioxid | Blekning av kraftpapper och mjöl |
| Natriumhypoklorit | Hushållstvättar och saneringsmedel |
| Kalcium Hypoklorit | Fast blekmedel som används vid sanering |
| Natriumdikloroisocyanurat | Sanerings- och diskmedel |
| Väteperoxid | Blekning av textilier, pälsar, massa och papper samt hår |
| Natriumperborat | Mildare blekmedel för tvätt; kemtvätt; rengöring av proteser; tandpulver; ersättning för fosfater i tvättmedel |
| Ljus | Blekning av pappersföremål |
| Svaveldioxid | Konservering av vindruvor, vin och äpplen; avlägsnande av färg vid raffinering av socker |
| Natriumsulfit; Natriumbisulfit | Antiklor (ett reduktionsmedel för att avlägsna oxiderande blekmedel) |
| Natriumdithionit | Blekning av textilier, massa och papper; Avlägsnande av rostfläckar |
| Natriumborhydrid | Blekning av massa och papper |
dioxiner. Det vanligaste dioxin som produceras i massa- och blekningsprocessen, 2,3,7,8-tetraklorodibenzo- p -dioxin (2,3,7,8-TCDD), har visat sig vara både cancerframkallande och dödligt giftigt. Klor som blekmedel håller därför på att ersättas av de säkrare blekmedlen klordioxid och väteperoxid. Trenden inom massa- och pappersindustrin går faktiskt mot helt klorfri blekning (TCF). Klor används nu inom blekningsindustrin främst för att framställa hypokloritlösningar och torra blekmedel, t.ex. kalciumhypoklorit.
Klordioxid (ClO 2 ). Klordioxid har använts som blekmedel både i gasform och i vattenlösning. På grund av dess explosiva karaktär späds klordioxid i gasform ofta ut med kväve eller koldioxid. Om klordioxid lagras eller transporteras passerar den genom kallt vatten och förvaras i kylskåp.
Klordioxid framställs industriellt genom reduktion av natriumklorat med svaveldioxid i vattenlösning.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
En relativt säker metod för framställning av ClO 2 innebär en reaktion mellan natriumklorit (NaClO 2 ) och formaldehyd (H 2 CO).
H 2 CO + H + + + ClO 2 – → HOCl + HCOOH (3)
När reaktion 3 fortskrider sjunker lösningens pH-värde (på grund av produktionen av myrsyra ). Den ökade surheten i lösningen främjar bildandet av ClO 2 , vilket visas i ekvation 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
I sur lösning beter sig klordioxid som ett oxidationsmedel. Den fullständiga reduktionen av ClO 2 visas i ekvation 5.
ClO 2 + 4H + + + 5 e – → Cl – + 2H 2 O (5)
De enskilda stegen i denna totala reduktionsreaktion ger HClO 2 , HOCl och Cl 2 , som alla beter sig som oxidationsmedel. Ett surt medium krävs, eftersom ClO 2 disproportioneras i alkalisk lösning, vilket visas i ekvation 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Klordioxid används främst för blekning av pappersmassa.
Hypokloriter (OCl – ). Hypokloritblekningslösningar framställs av NaOCl och, i mindre utsträckning, Ca(OCl) 2 . Hypokloriter används vid tvättning, som desinfektionsmedel, vid blekning av pappersmassa och textilier samt vid avlägsnande av bläck från återvunnet papper. Kommersiella blekningslösningar erhålls genom att klorgas leds genom kall, utspädd, vattenhaltig natriumhydroxid, enligt ekvation 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternativt kan hypokloritjonen genereras genom hydrolys av organiska kväveklorföreningar. Några av de viktigare kväveklorföreningar som används på detta sätt är de klorerade isocyanuraterna. Dessa används i rengörings- och diskmaskinsprodukter.
För att vara ett effektivt blekmedel bör hypokloritlösningen hållas alkalisk (pH > 9,0) för att undertrycka hydrolysen av OCl – (se ekvation 8) och förhindra bildandet av instabilt HOCl.
OCl – + H 2 O → HOCl + OH – (8)
I sura lösningar bildas och sönderdelas HOCl.
3HOCl → HClO 3 + 2HCl (9)
HOCl reagerar också med HCl, en av sönderdelningsprodukterna.
HOCl + HCl → H 2 O + Cl 2 (10)
Hypokloritblekningslösningar får inte innehålla tungmetallkatjoner, eftersom dessa katjoner (liksom ljus eller värme) främjar nedbrytningen av HOCl, vilket visas i ekvation 11.
2HOCl → 2HCl + O 2 (11)
De aktiva ingredienserna i hypokloritblekmedel varierar med pH. Vid pH < 2 är Cl 2 den viktigaste komponenten i lösningen, vid pH 4-6 är HOCl den dominerande arten och vid pH > 9 är OCl – den enda förekommande komponenten. Det är hypokloritjonen i den basiska lösningen som är den aktiva beståndsdelen i hushållsblekmedel, som vanligtvis består av cirka 5-6 procent NaOCl. OCl-jonen oxiderar kromoforer i färgade material och reduceras själv till klorid- och hydroxidjoner.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Den blekningsprocess som utförs av kommersiella hypokloritblekmedel förstärks ofta genom användning av optiska vitmedel, föreningar som absorberar infallande ultraviolett ljus och sänder ut synligt ljus, vilket gör att tyget framstår som klarare och vitare.
Väteperoxid (H 2 O 2 ) . Väteperoxid kan framställas genom reaktion mellan bariumperoxid och svavelsyra (se ekvation 13). Eftersom bariumsulfat fälls ut kan väteperoxid lätt avskiljas.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Väteperoxid, som ett blekmedel som används i massa- och pappersindustrin, har fördelen att den inte förorenar. På grund av instabiliteten hos ren väteperoxid används vattenlösningar vid blekning. Vid rumstemperatur sönderdelas väteperoxid mycket långsamt till vatten och syre.
2H 2 O 2 → H 2 O + O 2 (14)
Närvaron av övergångsmetallkatjoner (särskilt Fe 3+ , Mn 2+ och Cu 2+ ) och andra katalysatorer påskyndar dock denna reaktion dramatiskt. Därför måste vattenhaltig väteperoxid stabiliseras med komplexbildare som avskiljer övergångsmetallkatjoner.
Den aktiva blekningsarten i väteperoxid är perhydroxylanjonen , OOH – , som bildas genom jonisering av H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
Den sura joniseringskonstanten för väteperoxid är mycket låg ( K a = 2 × 10 -12 ) med resultatet att lösningar av H 2 O 2 måste göras alkaliska för att

att höja koncentrationen av OOH – . I avsaknad av ett alkaliskt medium är väteperoxid inte längre effektivt som blekmedel. I blekningsfasen vid hårfärgning används till exempel ofta väteperoxid (5-6 %), men även ammoniak för att tillhandahålla ett alkaliskt medium.
Samtidigt får pH-värdet inte stiga över 11, eftersom nedbrytningen av OOH – då börjar ske.
2OOH – → O 2 + 2OH – (16)
Peroxygenföreningar. Det finns ett antal fasta peroxygenföreningar som avger väteperoxid när de löses upp i vatten. Dessa inkluderar natriumperborat (NaBO 3 z 4H 2 O eller NaBO 2 z H 2 O 2 z 3H 2 O) och natriumkarbonatperoxihydrat (2Na 2 CO 3 z 3H 2 O 2 ). Natriumperboratets struktur innehåller peroxoanjonen B 2 (O 2 ) 2 (OH) 4 2- , som innehåller två O-O-bindningar som förenar två tetraedriska BO 2 (OH) 2-grupper. Dessa peroxygenföreningar används i tvättmedel, rengöringsmedel för proteser och tandpulver.
Blekning med ljus. Blekning med hjälp av antingen naturligt solljus eller artificiellt ljus har använts för att avlägsna fläckar från pappersföremål och för att behandla textilier. Materialet som ska blekas sänks först ner i en alkalisk lösning av antingen kalcium- eller magnesiumbikarbonat och skyddas sedan från ultraviolett strålning genom att täckas med plexiglas, Lexan eller Mylar. Därefter exponeras det för ljus i två till fyra timmar för naturligt solljus och två till tolv timmar för artificiellt ljus.
Reducerande blekmedel
Reducerande medel som används vid blekning är bl.a. sulfiter, bisulfiter, dithioniter och natriumborhydrid, som alla används vid blekning av pappersmassa och textilier.
Sulfiter (SO 3 2- ) och bisulfiter (HSO 3 – ). Oxidationstalet för svavel i både SO 3 2- och HSO 3 – är +4, och oxidation till +6 sker lätt, med bildning av SO 4 2- respektive HSO 4 – , vilket gör sulfiter och bisulfiter till goda reduktionsmedel.
Dithioniter (S 2 O 4 2- ) . Både natrium- och zinkdithionit har använts vid blekning av mekanisk massa och textilier. Framställningen av dithionitjonen sker genom reduktion av bisulfitjonen och svaveldioxid med Zn-damm.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
Dithionitjonen, S 2 O 4 2- , som har svavel i oxidationstalet +3, uppträder som ett starkt reduktionsmedel i alkalisk lösning.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
När pH-värdet sänks sjunker dithionitjonens reducerande förmåga, vilket förutses av LeChateliers princip.
Dithioniter är användbara för att avlägsna rostfläckar, och neutrala citratlösningar av Na 2 S 2 O 4 användes för att avlägsna järnkorrosionsprodukter från föremål som återfanns från Titanic.
Natriumborhydrid (NaBH 4 ). Natriumborohydrid har huvudsakligen använts vid industriell blekning av mekanisk massa. BH 4-jonen är ett starkt reduktionsmedel i alkalisk lösning.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Ett problem med att använda natriumborhydrid är att BH 4 – jonen långsamt sönderdelas i vattenlösning.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Som en alternativ metod kan BH 4 – salter lösas upp i antingen CH 3 OH eller det mindre giftiga C 2 H 5 OH. Nedbrytningen av BH 4-jonen i alkoholer sker i en mycket långsammare takt:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Slutsats
Ett blekmedel kan bleka eller avfärga ett ämne genom att reagera med de kromoforer som är ansvariga för ämnets färg. Beroende på kromoforernas beskaffenhet är blekmedlet antingen ett oxiderande eller reducerande medel. Det vill säga att kromoforen antingen oxideras eller reduceras för att producera ett färglöst eller blekt ämne. Blekmedel och deras kommersiella användning sammanfattas i tabell 1.