Trend 2: För oxosyror med en given centralatom ökar surhetsgraden med det centrala elementets oxidationstillstånd eller, med andra ord, antalet syre som är bundet till den centrala atomen.
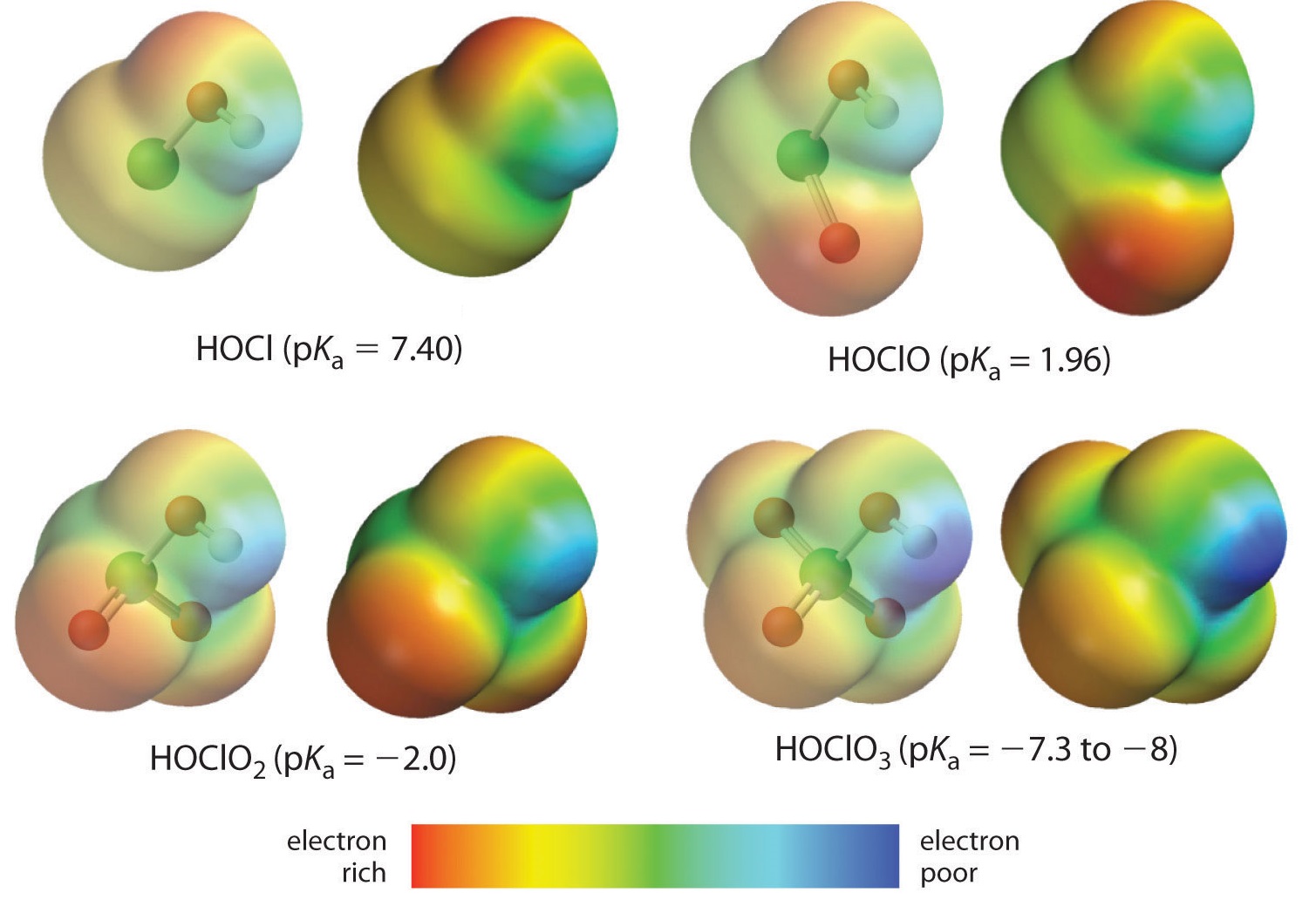
Här tittar vi på trenden för syror där det finns ett varierande antal syre som är bundet till en given centralatom. Ett exempel är serien av perklorsyror (\(\ce{ClO_4^{-}}\)), klorsyror (\(\ce{ClO_3^{-}}}\)), klorsyror (\(\ce{ClO_2^{-}}}\)) och hypoklorsyror (\(\ce{ClO^{-}}\)). I dessa serier är syran starkare ju större antalet oxygener är. Detta kan förklaras på flera sätt. Ur själva syrans synvinkel är nyckelfaktorn återigen den induktiva effekten, som i detta fall innebär att de oxygener som är knutna till den centrala atomen kan dra till sig elektrontätheten över OH-bindningen. Detta framgår av laddningstäthetsdiagrammet för kloroxosyrorna i figur \(\PageIndex{1}\), där den partiella positiva laddningen på det sura väteämnet ökar med antalet närvarande oxygener.
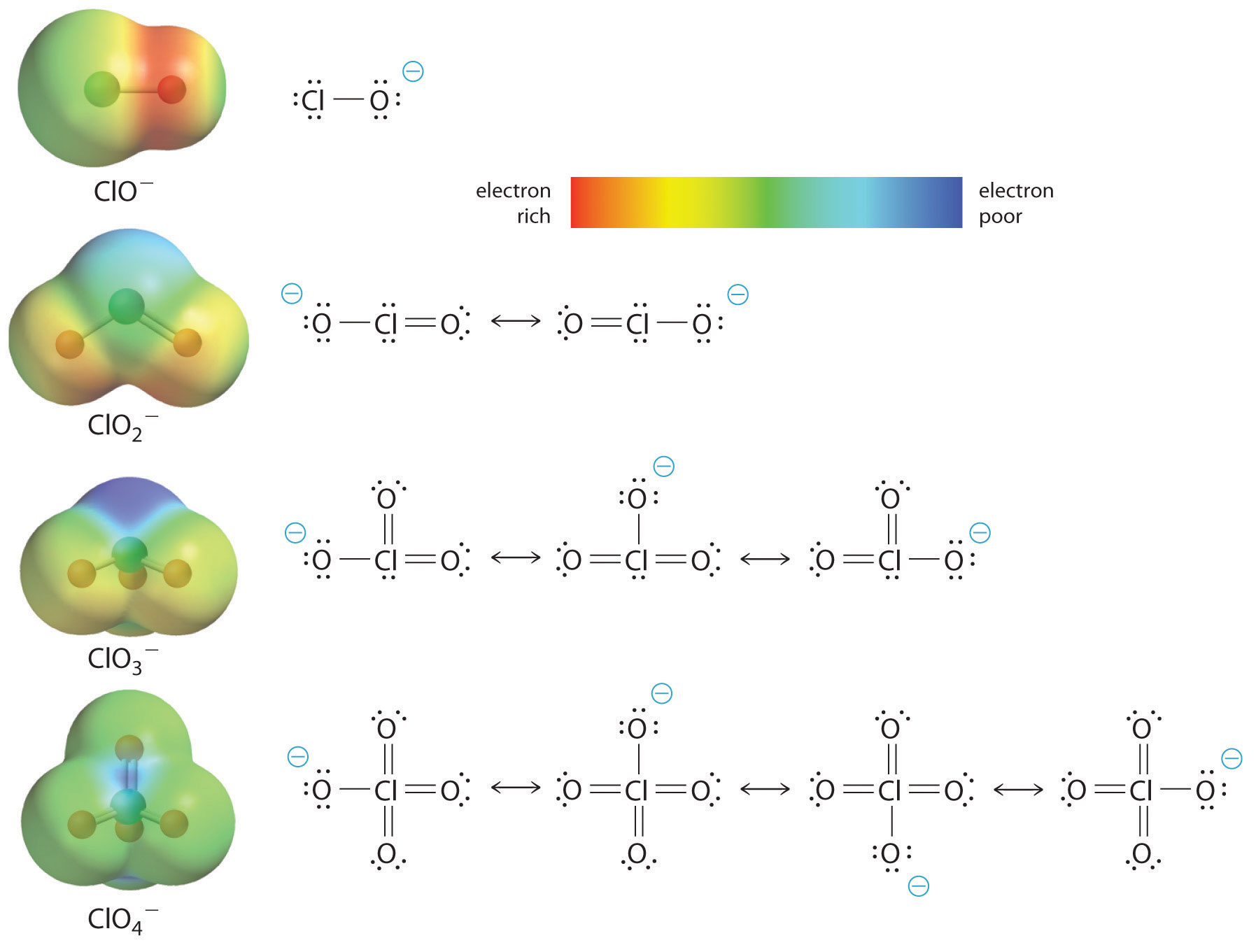
Ökningen av oxosyrans surhet med antalet oxygener som är bundna till den centrala atomen kan också ses genom att betrakta stabiliteten hos den konjugerade oxyanjonen. Att stabiliteten hos den konjugerade basen ökar med antalet oxygener kan ses av laddningsfördelningsdiagrammen och Lewis-bindningsmodellerna för kloroxianjonerna som visas i figur \(\PageIndex{2}\). När den negativa laddningen sprids över fler syreatomer blir den alltmer diffus.
Övningsuppgift \(\PageIndex{1}\)
Svavel och selen bildar båda oxosyror av formeln \(\ce{H_2EO_4}\) där E är antingen S eller Se. Dessa kallas för svavelsyra respektive selenösyra. Vilken oxosyra skulle du förvänta dig att vara mer sur: selenös syra eller svavelsyra?
Svar
Svavelsyra borde vara mer sur. Eftersom svavel är mer elektronegativt än selen kommer svavel att polarisera OH-bindningar i större utsträckning, vilket gör dem surare. Denna förutsägelse bekräftas av en jämförelse av \(pK_a\)-värdena för syrorna:
| Syra | \(pK_{a1}\) | \(pK_{a2}\) |
|---|---|---|
| svavelsyra, \(H_2SO_3\) | 1.85 | 7.2 |
| selenhaltig syra, \(H_2SeO_3\) | 2.62 | 8.32 |