Utilizarea și importanța pilelor și a bateriilor sunt de necontestat. În viața noastră de zi cu zi, ne folosim de celule în atât de multe moduri diferite. Acum, în ultimele câteva concepte, v-am prezentat deja bateriile în general. Cu toate acestea, aici vă vom oferi o analiză aprofundată a celulelor galvanice. Așadar, haideți să începem.
Sugestii video
Pile galvanice
Printre alte celule, o celulă galvanică este un tip de celulă electrochimică. Ea este utilizată pentru a furniza curent electric prin realizarea transferului de electroni printr-o reacție redox. O celulă galvanică este o idee exemplară a modului în care poate fi valorificată energia folosind reacții simple între câteva elemente date. Este uimitor să studiezi modul în care o celulă galvanică poate fi configurată și utilizată pentru a obține energie.
Explicând în termenii cei mai simpli, o celulă galvanică acționează ca un dispozitiv în care au loc reacții simultane de oxidare și reducere. Aceste reacții sunt folosite pentru a converti energia chimică în energie electrică, care poate fi utilizată în orice scop comercial.
Browse more Topics under Electrochimie
- Bateriile
- Conductanța soluțiilor electrolitice
- Coroziunea
- Celele electrochimice
- Celele electrolitice și electroliza
- Pile de combustibil
- Ecuția lui Nernst
- Variația conductivității și a conductivității molare cu concentrația
.
Funcționarea celulelor galvanice

Funcționarea unei celule galvanice este destul de simplă. Implică o reacție chimică care face ca rezultatul final să fie energia electrică disponibilă. În timpul unei reacții redox, o celulă galvanică utilizează transferul de energie între electroni pentru a converti energia chimică în energie electrică.
Celula galvanică utilizează abilitatea de a separa fluxul de electroni în procesul de oxidare și reducere, provocând o jumătate de reacție și conectând fiecare cu un fir astfel încât să se poată forma o cale pentru fluxul de electroni prin acest fir. Acest flux de electroni se numește, în esență, un curent. Un astfel de curent poate fi făcut să circule printr-un fir pentru a completa un circuit și a obține ieșirea acestuia în orice dispozitiv, cum ar fi un televizor sau un ceas.
O celulă galvanică poate fi realizată din oricare două metale. Aceste două metale pot forma anodul și catodul dacă sunt lăsate în contact unul cu celălalt. Această combinație permite coroziunea galvanică a acelui metal care este mai anodic. Un circuit de conectare este necesar pentru a permite ca această coroziune să aibă loc.
Configurarea unei celule galvanice
Pentru a crea o celulă galvanică, ar trebui să se treacă prin următoarea configurație. Celula ar trebui să includă, în mod ideal, doi electrozi. Unul dintre acești electrozi, catodul, va fi un electrod încărcat pozitiv, în timp ce celălalt, va fi anodul, electrodul încărcat negativ.
Cei doi electrozi vor forma cele două componente esențiale ale celulei galvanice. Reacția chimică legată de reducere va avea loc la catod, în timp ce semi-reacția de oxidare va avea loc la anod. După cum s-a spus deja, orice două metale pot fi folosite pentru a crea reacția chimică.
Înțelegerea celulei galvanice cu un exemplu
Să luăm un exemplu în care cele două metale implicate în reacția chimică sunt zincul și cuprul. Pe măsură ce reacția chimică are loc, zincul ar sfârși prin a pierde doi electroni. Aceștia vor fi preluați de cupru pentru a deveni cupru elementar. Deoarece aceste două metale vor fi plasate în două recipiente separate și vor fi conectate printr-un fir conductor, se va forma un curent electric, care va transfera toți electronii de la un metal la altul.
În același timp, cele două metale vor fi scufundate într-o soluție de sare, să spunem, în acest caz, sulfat de zinc și sulfat de cupru. În acest caz, cele două soluții nu sunt amestecate direct, ci pot fi unite cu ajutorul unei punți sau al unui mediu. Acest mediu va fi responsabil pentru transferul de ioni, dar se va asigura, de asemenea, că cele două soluții nu ajung să se amestece între ele.
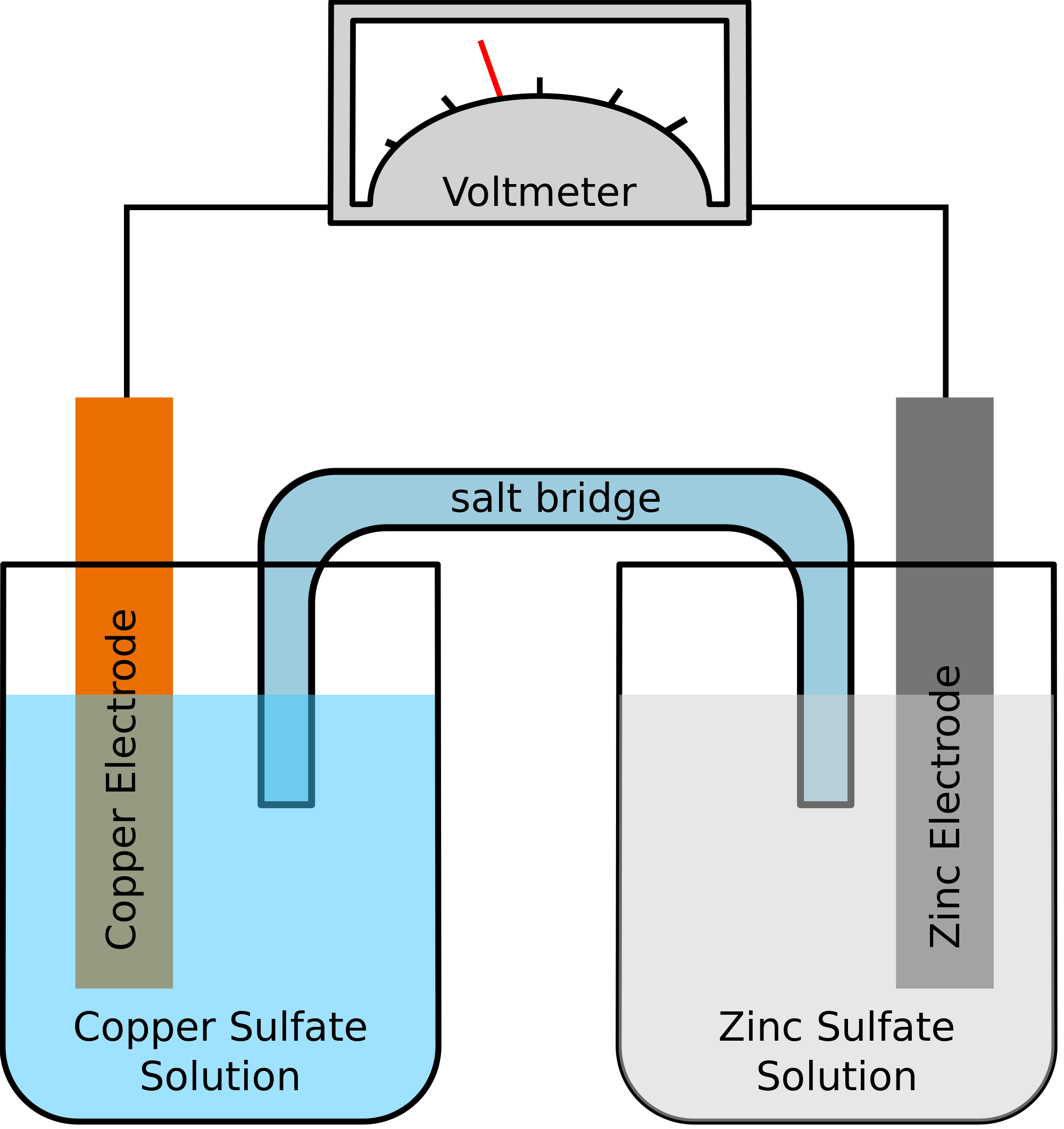
O astfel de punte ajută la completarea circuitului pentru transportul sarcinii electrice și, de asemenea, se asigură că soluțiile din recipientele cu metale rămân neutre și nu se amestecă între ele. Atâta timp cât puntea de sare nu interferează cu reacția redox, în cadrul căreia are loc oxidarea și reducerea, nu contează ce punte de sare este folosită în reacția chimică.
Câțiva termeni importanți
Câțiva dintre termenii importanți aduși în uz într-o celulă galvanică sunt enumerați mai jos:
- Limitele fazelor: Se referă la cele două metale care acționează ca catod și anod.
- Ponta de sare: Puntea de legătură sau mediul de legătură care permite ca o reacție redox să aibă loc.
- Oxidare și reducere: Procesele chimice care permit curentului electric să se formeze și să circule printr-o celulă galvanică.
Exemple rezolvate pentru tine
Întrebare: Într-o celulă galvanică, ce s-ar întâmpla dacă nu se folosește nici o punte de sare în timp ce are loc reacția redox?
Soluție: În absența unei punți de sare în interiorul fiecărui recipient care conține metalele, reacția redox ar începe cam în același mod. Dar, în absența punții de sare, aceeași reacție s-ar încheia destul de brusc. Soluțiile respective nu își vor putea menține neutralitatea electrică. În afară de aceasta, nu va exista nicio schimbare în reacția chimică sau vreo alterare de orice fel din cauza absenței punții saline sau a mediului.