CombustieEdit
Ca majoritatea celorlalte hidrocarburi, hidrocarburile nesaturate pot fi supuse unor reacții de combustie care produc dioxid de carbon și apă în arderea completă. Ecuația reacției este:
- CxHy + y+4x/4O2 → y/2H2O + xCO2
În absența oxigenului, combustia se va transforma în combustie incompletă și va produce monoxid de carbon și carbon.
Hidrocarburile nesaturate vor produce produse de combustie incompletă mai ușor decât cele saturate. Ca urmare, arderea hidrocarburilor nesaturate are de obicei flacără galbenă, diferită de flacăra albastră a celor saturate. Acest lucru indică faptul că arderea hidrocarburilor nesaturate va implica mecanisme în mai multe etape, iar arderea carbonului dă culoarea galbenă a flăcării.
Din moment ce hidrocarburile nesaturate au un conținut mai mic de hidrogen, vor produce mai puțină apă și vor scădea umiditatea flăcării, precum și consumul de oxigen. Acetilena(etilena), de exemplu, poate fi folosită ca și combustibil.

În comparație cu legăturile simple σ C-C din hidrocarburile saturate, cele nesaturate au densitatea de electroni în legăturile π, care nu au multă densitate de electroni care se suprapun ca și cele σ. Ca urmare, energia chimică stocată într-o legătură dublă este mai mică decât în două legături simple. Astfel, arderea hidrocarburilor nesaturate, care rupe legăturile carbon-carbon pentru a elibera energie, eliberează mai puțină energie decât arderea aceleiași molarități de hidrocarburi saturate cu același număr de atomi de carbon. Această tendință poate fi clar observată în lista entalpiei standard de ardere a hidrocarburilor.
| Numărul de carbon | Substanța | Tip | Formula | Formula | Hcø(kJ/mol) |
|---|---|---|---|---|---|
| 2 | etan | saturat | C2H6 | -1559.7 | |
| etena | nesaturată | C2H4 | -1410.8 | ||
| etina | nesaturată | C2H2 | -1300.8 | ||
| 3 | propan | saturat | CH3CH2CH3 | -2219,2 | |
| propenă | nesaturat | CH3CH=CH2 | -2058.1 | ||
| propenă | nesaturată | CH3C≡CH | -1938,7 | ||
| 4 | butan | saturat | CH3CH2CH2CH2CH3 | -2876.5 | |
| but-1-ene | nesaturat | CH2=CH-CH2CH3 | -2716.8 | ||
| but-1-yne | nesaturat | CH≡C-CH2CH3 | -2596.6 |
Adiție electrofilăEdit
Legăturile duble sau triple care trebuie să fie prezente în hidrocarburile nesaturate asigură o densitate mare de electroni care fac ca moleculele să devină puncte perfecte pentru reacții de adiție electrofilă. În acest tip de reacție, o legătură π între carboni se va rupe în 2 legături σ separate între fiecare carbon și grupul adăugat. Un carbocation intermediar este de obicei implicat în mecanism.
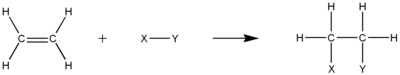
HidrogenareaEdit
Hidrogenarea este adiția electrofilă a hidrogenului gazos la o hidrocarbură nesaturată. Rezultatul va fi o hidrocarbură mai saturată, dar nu va deveni neapărat o hidrocarbură saturată. De exemplu, semihidrogenarea unei alchine poate forma o alchină. Cu toate acestea, numărul total de legături π trebuie să scadă în acest proces. Legătura π carbon-carbon este, de asemenea, necesară pentru acest proces.
Ecuația reacției de hidrogenare a etenei pentru a forma etan este:
- H2C=CH2 + H2→H3C-CH3
Reacția de hidrogenare necesită, de obicei, catalizatori pentru a-i crește viteza.
Numărul total de hidrogen care poate fi adăugat la o hidrocarbură nesaturată depinde de gradul de nesaturare al acesteia. Unei hidrocarburi nesaturate cu formula CXHY i se pot adăuga cel mult 2X+2-Y atomi de hidrogen. Acest lucru va face ca molecula să devină saturată.
HalogenareEdit
Asemănător hidrogenului, heteroliza halogenului(X2) va produce un ion electrofil X+, după care acesta va fi atacat de electronul de pe legătura π. Diferit de hidrogen, halogenarea va produce ca intermediar ioni de haloniu în loc de carbocationi în majoritatea celorlalte cazuri. Cationul de haloniu lasă un spațiu limitat pentru atacul ionului X- și se va transforma doar într-un produs trans. Rezultatul net al halogenării este o scădere a unei legături π și o creștere a două legături σ carbon-halogen pe cei 2 carboni.

Ecuația de reacție pentru adiția bromului la etenă, de exemplu, este: :
- H2C=CH2 + Br2→H2CBr-CH2Br (trans)
Testul bromului este folosit pentru a testa saturația hidrocarburilor. Testul presupune adăugarea de apă bromată la hidrocarbura necunoscută; dacă apa bromată este decolorata de către hidrocarbură, ceea ce se datorează reacției de halogenare, se poate concluziona că hidrocarbura este nesaturată. Dacă nu este decolorizată, atunci este saturată.
Testul cu brom poate fi folosit și ca o indicație a gradului de nesaturare pentru hidrocarburile nesaturate. Indicele de brom se definește ca gram de brom capabil să reacționeze cu 100 g de produs. Similar cu hidrogenarea, halogenarea bromului depinde și ea de numărul de legături π. Un număr mai mare de brom indică un grad mai mare de nesaturare.
HidratareEdit
Legătura π a hidrocarburilor nesaturate este, de asemenea, pregătită să accepte H+ și OH- din apă. Reacția implică, de obicei, un acid puternic ca și catalizator. Acest lucru se datorează faptului că prima etapă a mecanismului de hidratare implică deprotonarea legăturii π de către un H+ din acidul puternic pentru a forma un carbocation. Rezultatul net al reacției va fi un alcool.
Ecuația reacției de hidratare a etenei este:
- H2C=CH2 + H2O→H3C-CH2OH
Legăturile π din tripla legătură sunt, de asemenea, capabile să treacă prin hidratare în condiții acide și să formeze enoli. Cu toate acestea, enolul nu va fi un produs, ci un intermediar, iar produsul final va fi o cetonă. Intermediarul enol trece la tautomerizare și formează cetona mai stabilă.
Ecuația reacției de hidratare a etinei pentru a forma acetaldehida este:
- HC≡CH + H2O → H2C=CH-OH
- H2C=CH-OH ⇌ H3C-CHO
HidrohalogenareaEdit

Hidrohalogenarea presupune adiția de H-X la hidrocarburi nesaturate. Aceasta va diminua o legătură π C=C și va avea ca rezultat 2 legături C-H și C-X σ cu 2 atomi de carbon separați. Formarea carbocationului intermediar este selectivă și urmează regula lui Markovnikov. Hidrohalogenarea alchenei va avea ca rezultat un haloalcan, iar hidrohalogenarea alchenei va avea ca rezultat o halogenură de vinil. Hidrohalogenarea alchinei este mult mai lentă decât cea a alchenei.
Ecuația reacției de adiție a HBr la etenă este:
- H2C=CH2 + HBr→H3C-CH2Br
OxidareEdit

Oxidarea hidrocarburilor nesaturate depinde de puterea agentului oxidant. Un agent oxidant slab va conduce la dihidroxilare, eliminarea unei legături π pentru a forma două legături σ cu oxigenul. Dihidroxilarea alchenei produce diol, iar dihidroxilarea alchenei produce dicarbonil vicinal.
Un agent oxidant mai puternic, de exemplu KMnO4 sau ozon, va duce la scindare oxidativă. În acest caz, legătura π se rupe împreună cu legătura σ, împărțind molecula de hidrocarbură în două. Oxigenul se leagă cu cele două legături π rămase separat. Clivarea oxidativă a alchenelor produce cetone sau aldehide, în funcție de locul dublei legături, iar clivarea alchenelor produce acidul carboxilic.
Substituție alilicăEdit
Legătura π din hidrocarburile nesaturate va scădea energia de disociere a legăturilor C-H alilice, care sunt legături C-H ale carbonului care este adiacent la carbonații sp2. Ca urmare, reacția de substituție radicalară liberă va fi favorizată față de reacțiile de adiție.
Un exemplu în acest sens este reacția de bromurare NBS cu alchena. Legătura N-Br din NBS este slabă, astfel încât se va forma mult radical liber Br. Radicalul liber va ataca hidrogenii alilici slăbiți și îi va înlocui cu atomi de brom. Ecuația reacției este:
- RCH2CH=CH2 + (CH2CO)2NBr → RCHBrCH=CH2 + RCH=CHCHCH2Br + (CH2CO)2N
Reacția va produce doi izomeri cu bromul atașat la carboni diferiți. Reacția necesită o cantitate mare de radicali liberi Br în locul ionilor electrofili Br+, care vor intra în reacție de adiție. NBS este esențial pentru a realiza o astfel de condiție.
În cazul în care grupările hidrocarbonate sunt atașate la carbonul alilic, acest carbon va fi mai saturat. Conform regulii lui Zaitsev, acest carbon va forma un intermediar carbocationic mai stabil. Ca urmare, va avea loc rearanjarea alilică, iar legătura π se va muta pe acest carbon. Astfel, se va obține un produs majoritar de brom substituit la carbonul aflat la patru legături distanță de grupul hidrocarbonat.
CicloaddițieEdit

Pentru hidrocarburile nesaturate, atât structura inelară cât și legăturile π pot crește gradul de nesaturare, schimbul dintre structura inelară și legăturile π poate avea loc în condiții speciale. De exemplu, pentru o dienă conjugată și o alchenă substituită, va avea loc reacția Diels-Alder care formează o ciclohexenă. O astfel de reacție este foarte selectivă din punct de vedere stereochimic.
Alcinele, sub catalizatori metalici, de exemplu cobaltul, pot, de asemenea, să treacă prin reacția de cicloadiție numită trimerizare a alchenei. Trei alchene trec printr-o reacție de ciclizare „2+2+2” și se unesc rapid pentru a forma o benzen. trimerizarea diferitelor alchene nu este de obicei selectivă, dar catalizatorii special concepuți pot crește selectivitatea.
Reacționează ca ligandEdit

Legătura π delocalizată din hidrocarburile nesaturate oferă o densitate mare de electroni, ceea ce face ca molecula să poată deveni un ligand metalic. În ligandul de alchenă, structura legăturii poate fi descrisă prin modelul Dewar-Chatt-Duncanson. În acest caz, densitatea de electroni π sunt donați orbitalilor d ai metalului. Cu cât donația este mai puternică, cu atât mai puternică este legătura inversă de la orbitalul d al metalului la orbitalul de anti-legătură π* al alchenei. Acest efect reduce ordinea de legătură a alchenei și mărește lungimea legăturii C-C. Ca urmare, metalul formează o structură inelară mică cu cei doi carboni.
Modelul DCD poate descrie, de asemenea, structura ligandului alchenei. Complexul metalic poate fi, de asemenea, intermediar al trimerizării alchenelor, astfel încât metalele pot fi catalizatori ai reacției.
Sinteza complecșilor de liganzi ai alchenelor poate fi descrisă ca o reacție de adiție electrofilă.
Asemănător hidrocarburilor nesaturate liniare, arenele au, de asemenea, legături π delocalizate capabile să se doneze metalelor pentru a forma complexe. În cazuri precum benzenul, carbonații donează în mod egal densitatea electronică metalului, în timp ce în alte cazuri, carbonații donează diferit metalului, determinând curbarea sau dearomatizarea arenei.
.