Acetilarea se referă la o reacție care introduce o grupare funcțională acetil într-un compus chimic, în care atomul de hidrogen al unei grupe hidroxil este înlocuit cu o grupare acetil (CH3 CO) pentru a obține un ester specific, acetatul. Acetilarea proteinelor are în mod obișnuit două forme diferite. La om, aproape (80%-90%) proteinele devin acetilate co-translațional la terminațiile lor Nα-terminale ale lanțurilor polipeptidice născute. Un alt tip este de obicei acetilat pe reziduurile de lizină.
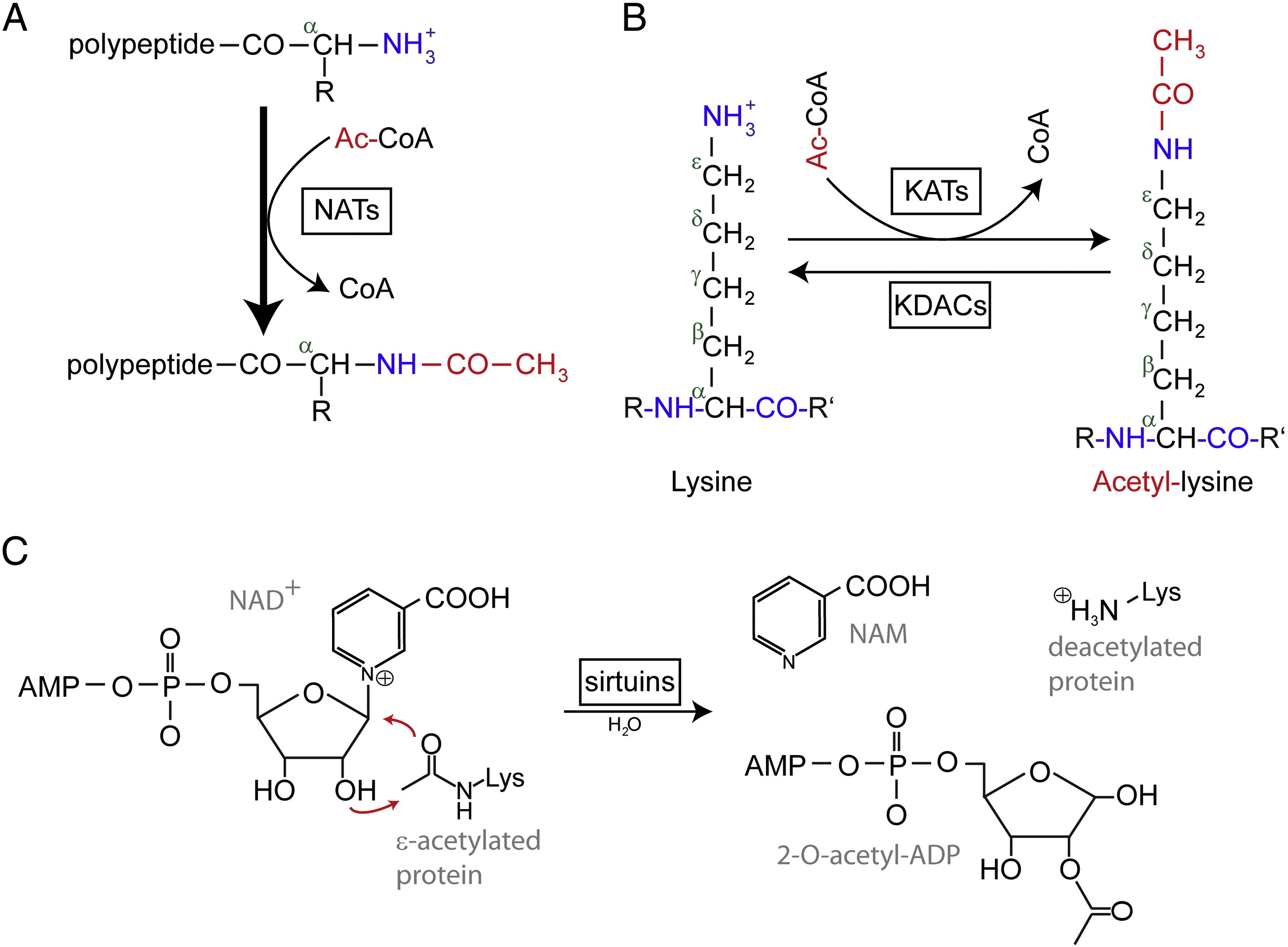
Acetilarea N-terminală
Acetilarea N-terminală (Nt) este catalizată de Nt-acetiltransferaze (NATs) și s-a constatat că este ireversibilă până în prezent. NATs, enzime mono- sau multisubunități formate dintr-o subunitate catalitică și până la două subunități auxiliare, pot transfera o grupare acetil de la acetil-coenzima A (Ac-CoA) la grupa α-amino a primului reziduu de aminoacid al proteinei. În cazul NAT-urilor, subunitatea auxiliară majoră modulează activitatea și specificitatea de substrat a subunității catalitice. Diferite NAT-uri sunt responsabile de acetilarea Nt. La om, au fost descoperite până în prezent șase NAT-uri, inclusiv NatA, NatB, NatC, NatD, NatE și NatF. În plus față de diferența de compoziție a subunităților, diferitele NAT variază în ceea ce privește specificitatea substratului.
Acetilarea Nt joacă roluri diferite în efectele moleculare. În primul rând, Nt-acetilarea determină localizarea subcelulară pentru anumite proteine. De exemplu, Arl3 și Grh1, două proteine asociate la Golgi, nu se pot asocia cu aparatul Golgi atunci când le lipsește grupul Nt-acetil. În al doilea rând, s-a raportat că Nt-acetilarea reține proteinele în citosol și inhibă o migrare post-translațională de translocare către reticulul endoplasmatic (ER) și calea secretorie. În plus, acetilarea Nt poate modifica proprietățile extremității N-terminale pentru a face ca interacțiunile proteină-proteină să fie modulate. S-a demonstrat pentru mai multe proteine că afinitatea față de partenerii lor de legare a crescut după ce au fost Nt-acetilate. De exemplu, enzima de conjugare a ubiquitinei E2 Ubc12 este supusă Nt-acetilării de către NatC, ceea ce permite o afinitate crescută față de partenerul său de interacțiune, ubiquitina ligază E3 Dcn1. În plus, Nt-acetilarea controlează calitatea și durata de viață a proteinelor și reglează stoichiometria proteinelor prin calea regulii N-end.
Acetilarea N-terminală are multe funcții în fiziologie. NAT-urile sunt esențiale pentru dezvoltarea normală, dezvoltarea oaselor și a vaselor de sânge. Acetilarea N-terminală poate regla tensiunea arterială, localizarea proteazomului, hormonul, precum și structura și funcția organitelor. În bolile umane, este legată de bolile neurodegenerative (cum ar fi boala Alzheimer, boala Parkinson și demența cu corpuri Lewy) și de cancer (cum ar fi cancerul pulmonar, cancerul de sân, cancerul colorectal).
Acetilarea lisinei
Reziduurile de lizină acetilată au fost descoperite pentru prima dată în histonele care reglează transcrierea genelor. Dar acetilarea lizinei nu se limitează la histone. Spre deosebire de acetilarea Nt, acetilarea lizinei este reversibilă. Acetilarea este catalizată de lizină acetiltransferaze (KATs), iar deacetilarea reziduurilor de lizină este catalizată de lizină deacetilaze (KDACs).
Se raportează că în genomul uman au fost identificate 17-22 de gene KATs (Numărul exact de KATs este controversat), care pot fi clasificate în trei familii diferite, inclusiv familia GCN5 (general control non-derepressible 5)-related acetyltransferase (GNAT), familia MYST și familia p300/CBP (CREB-binding protein). Substraturile cunoscute ale complexelor KAT nu includ doar proteine histonice, ci și unii factori de transcripție diferiți, co-regulatori transcripționali și unele proteine ale unor căi de semnalizare celulară specifice, cum ar fi p53, β-catenina, NF-κB, MyoD sau Rb. Și chiar și unele molecule de ARN pot fi acetilate. Există patru tipuri diferite de KDAC-uri, inclusiv clasa I, II, III și IV. Clasele I, II și IV sunt amidohidrolaze dependente de Zn2 +, în timp ce clasa III (numită și sirtuine) utilizează NAD+ ca și co-substrat pentru activitatea sa catalitică sunt amidohidrolaze dependente de Zn2 +.
Histonele sunt primele proteine acetilate descoperite. Moleculele de histone sunt modificate prin diferite PTM-uri, inclusiv fosforilarea, metilarea și acetilarea. acetilarea histonelor, determină asamblarea histonelor, precum și plierea și compactitatea interacțiunii ADN-histone și, prin urmare, prezintă un comutator între structura permisivă și cea represivă a cromatinei. În plus față de histone, KAT-urile pot cataliza proteinele din citoschelet. Există câteva noi situsuri de acetilare identificate în alte proteine, inclusiv în proteinele HMG, c-Myc, receptorii de estrogen și androgeni, E2F/Rb și așa mai departe.
Au fost raportate rolurile fiziologice ale acetilării lizinei. Proteinele histonice sunt asociate cu o reglare strânsă a, în esență, tuturor tipurilor de procese declanșate de ADN, cum ar fi transcripția, replicarea, recombinarea, repararea, precum și traducerea și formarea structurilor specializate de cromatină. Prin urmare, acetilarea lizinei proteice afectează o serie de căi de semnalizare celulară, precum și metabolismul, răspunsurile la stres, apoptoza și traficul membranar.
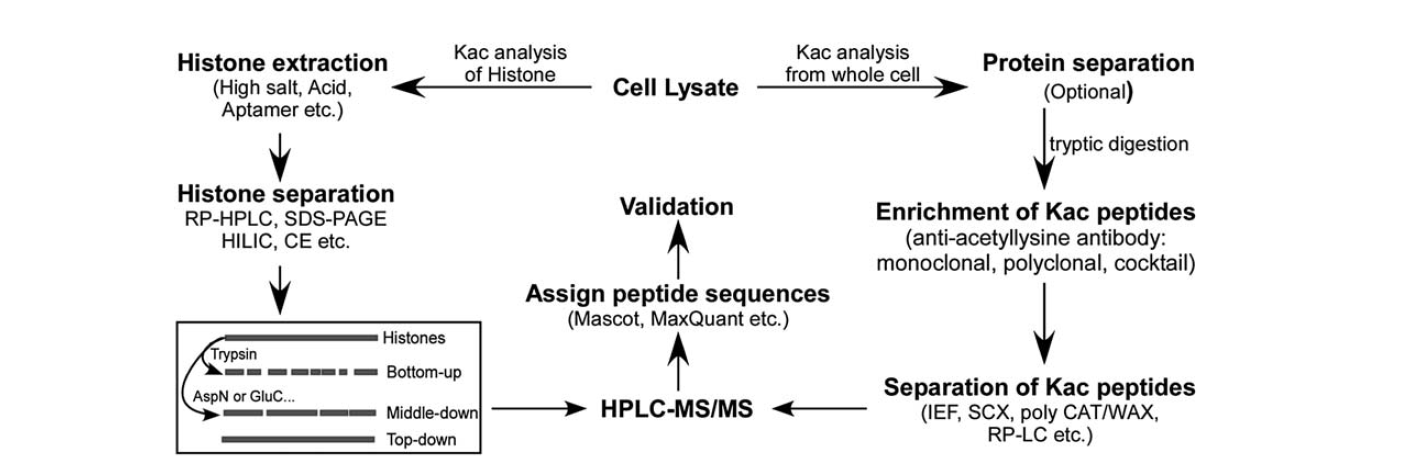
Există relativ puține instrumente disponibile pentru identificarea acetilării lizinei. Odată cu dezvoltarea spectrometriei de masă, aceasta a reprezentat un instrument important pentru identificarea și cuantificarea acetilării lizinei. Pentru a analiza acetilarea lizinei histonei, există mai multe etape, inclusiv lizatul celular, extracția histonei, separarea histonei, spectrometria de masă și analiza datelor. Etapele pentru analiza pentru acetilarea lizinei proteice din întreaga celulă includ lisat celular, separarea proteinelor, îmbogățirea peptidelor de acetilare a lizinei, separarea peptidelor de acetilare a lizinei, spectrometrie de masă și analiza datelor.
.