Tendința 2: Pentru oxoacizii cu un atom central dat, aciditatea crește odată cu starea de oxidare a elementului central sau, cu alte cuvinte, cu numărul de oxigeni legați de atomul central.
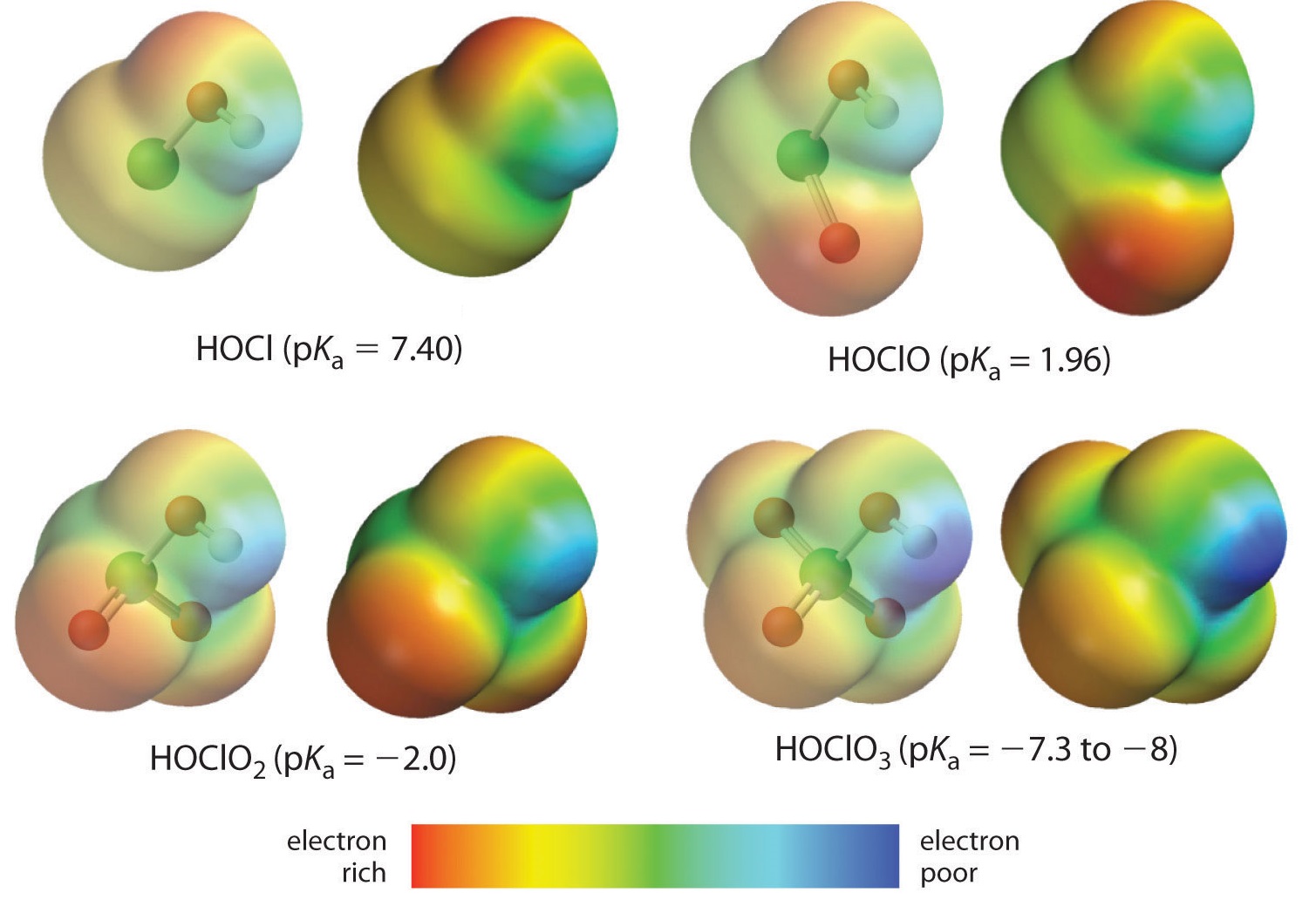
Aici analizăm tendința pentru acizii în care există un număr variabil de oxigen legați de un atom central dat. Un exemplu este seria de acizi perclorici (\(\ce{ClO_4^{-}}\)), clorici (\(\ce{ClO_3^{-}}\)), cloroși (\(\ce{ClO_2^{-}}\)) și hipocloși (\(\ce{ClO^{-}}\)). În astfel de serii, cu cât numărul de oxigeni este mai mare, cu atât acidul este mai puternic. Acest lucru poate fi explicat în mai multe moduri. Din punctul de vedere al acidului în sine, factorul cheie este din nou efectul inductiv, în acest caz implicând capacitatea oxigenilor atașați la atomul central de a atrage densitatea de electroni prin legătura OH. Acest lucru reiese din diagrama densității de sarcină pentru oxoacizii de clor prezentată în figura \(\PageIndex{1}\), în care sarcina pozitivă parțială pe hidrogenul acid crește odată cu numărul de oxigeni prezenți.
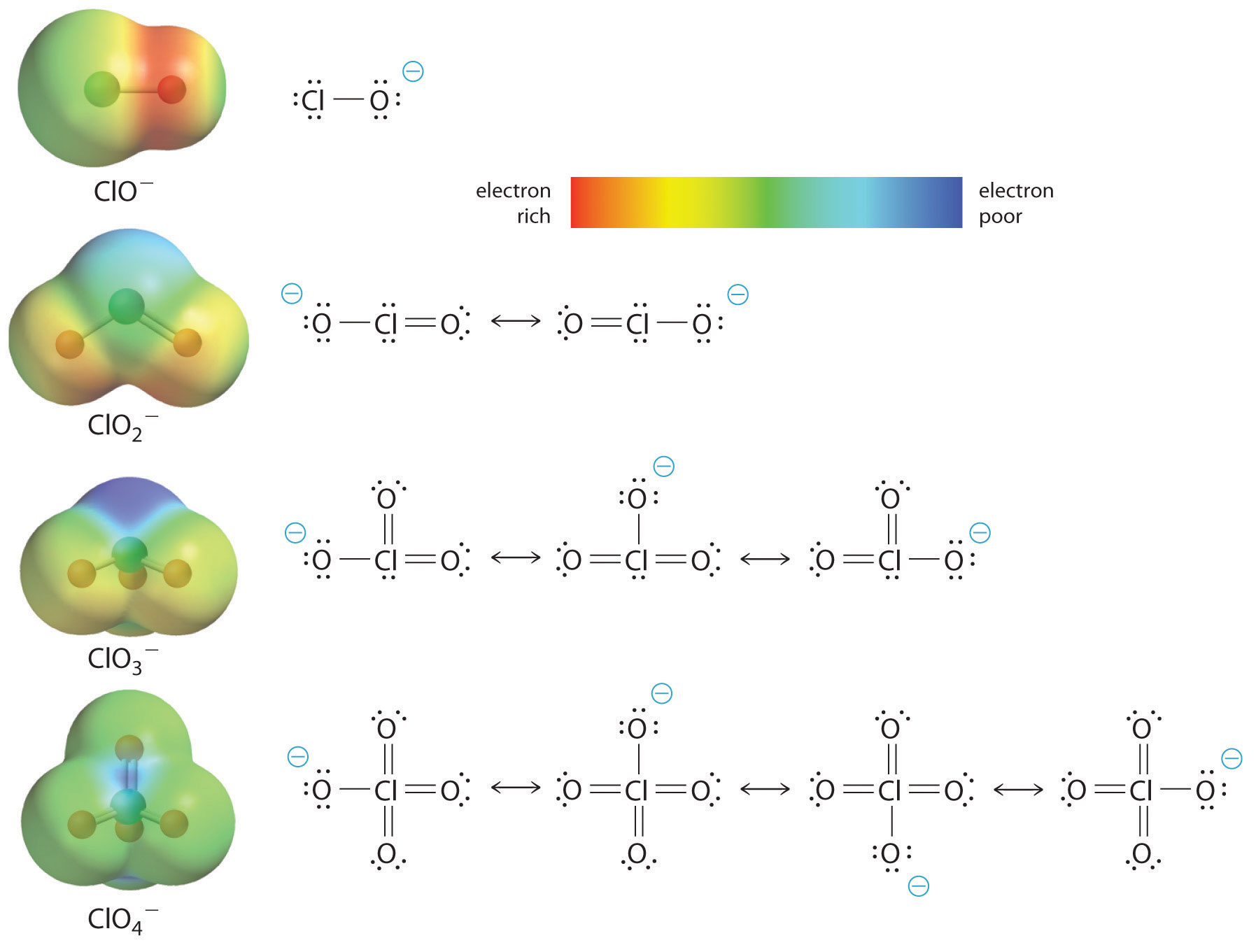
Creșterea acidității oxoacidului odată cu numărul de oxigeni legați de atomul central poate fi observată și prin luarea în considerare a stabilității oxianionului conjugat. Faptul că stabilitatea bazei conjugate crește odată cu numărul de oxiani poate fi observat din diagramele de distribuție a sarcinilor și modelele de legături Lewis pentru oxianionii de clor prezentate în figura \(\PageIndex{2}\). Pe măsură ce sarcina negativă este repartizată pe mai mulți atomi de oxigen, aceasta devine din ce în ce mai difuză.
Exercițiu \(\PageIndex{1}\)
Sulfura și seleniul formează amândoi oxoacizi de formula \(\ce{H_2EO_4}\) unde E este fie S, fie Se. Aceștia se numesc acid sulfuros și, respectiv, acid selenos. La ce oxoacid v-ați aștepta să fie mai acid: acid selenos sau acid sulfuros?
Răspuns
Acidul sulfuros ar trebui să fie mai acid. Deoarece sulful este mai electronegativ decât seleniul, sulful va polariza legăturile OH într-o măsură mai mare, făcându-le mai acide. Această predicție este confirmată de o comparație a valorilor \(pK_a\) pentru acizi:
| Acidul | \(pK_{a1}\) | \(pK_{a2}\) |
|---|---|---|
| acidul sulfuros, \(H_2SO_3\) | 1.85 | 7,2 |
| acid selenos, \(H_2SeO_3\) | 2,62 | 8,32 |
.