În reacții precum reacțiile de metilare exhaustivă – eliminare ale lui Hofmann, olefina cel mai puțin substituită se formează, în general, ca produs majoritar. Acest lucru se numește regula lui Hofmann. Toate aceste reacții poartă grupe de plecare încărcate precum -NR3+ sau -SR2+ și implică baze puternice. Regula lui Zaitsev (sau regula lui Saytzeff) ne atrage atenția asupra unei alte posibilități. La eliminarea lui HX, se obține o olefină mai stabilă (Fig. 2.3.1). Contradicția aparentă din acest set de reguli este ușor de rezolvat printr-o privire critică asupra mecanismelor implicate în aceste două seturi de condiții de reacție.
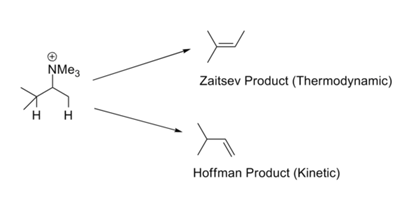
Pot exista două motive pentru astfel de preferințe. Ingold (1960) și Bunnett (1969) au sugerat că un grup de plecare încărcat pozitiv crește aciditatea protonilor β. Un substituent în poziția β ar putea scădea în mod hiperconjugativ aciditatea β-protonului. În consecință, o grupare metil terminală (aceasta nu are niciun substituent alchil) este mai acidă decât protonul intern al metilului (care poartă cel puțin un substituent alchil). În cazul în care grupul de plecare este un halogen, mecanismul se deplasează spre E1. În aceste condiții, stabilitatea dublei legături care se dezvoltă devine importantă, ceea ce duce la obținerea produsului mai stabil din punct de vedere termodinamic. Școala lui H.C. Brown a sugerat (1956) că factorii sterici guvernează astfel de reacții de eliminare. Grupurile de plecare încărcate sunt mari în comparație cu grupurile de plecare neutre.
Grupurile de plecare mai mari, cum ar fi -NR3+ și -SR2+, dau mai mult produs Hoffmann decât grupurile mai mici, cum ar fi halogenii. Voluminozitatea bazei crește, de asemenea, produsul Hoffmann în detrimentul produsului Zaitsav. Situația pare a fi mai complexă. Atunci când puterea bazei a fost crescută fără a crește volumul la locul de reacție (X-C6H4-O¯), produsul Hoffmann a crescut în detrimentul produsului Zaitsav (Froemsdorf (1966,67)). Acest lucru sugerează un mecanism E1cB, în care aciditatea protonului β este importantă. Astfel, mecanismul (și, prin urmare, compoziția produșilor) ar putea fi modificat de factori cum ar fi mărimea grupului de plecare, mărimea bazei, natura grupului de plecare și puterea bazei.
Contribuitori
- Prof. R Balaji Rao (Departamentul de Chimie, Universitatea Banaras Hindu, Varanasi) în cadrul Tehnologiei Informației și Comunicării
.