
Când clorul gazos este barbotat printr-un cilindru de suc de roșii, amestecul de clor și suc de roșii devine aproape complet alb în cinci minute. Această schimbare spectaculoasă este rezultatul acțiunii chimice a clorului, care acționează ca un agent de albire oxidant, asupra pigmenților din sucul de roșii. Atunci când decupajele de ziare vechi, decolorate prin îmbătrânire și expunere la lumină, sunt tratate cu o soluție apoasă de borohidridă de sodiu de 1%, hârtia se albește spectaculos în douăzeci de minute. În acest caz, hârtia a fost readusă la culoarea albă inițială prin acțiunea borohidridei de sodiu care acționează ca agent de albire reducător.
Un agent de albire este o substanță care poate să albească sau să decoloreze alte substanțe. Substanțele colorate conțin, în general, grupuri de atomi, numiți cromofori , care pot absorbi lumina vizibilă având lungimi de undă specifice, caracteristice, și pot reflecta sau transmite partea de lumină care nu este absorbită. De exemplu, dacă un cromofor absoarbe lumina albastră, acesta va reflecta lumina de culoare complementară, iar substanța care conține cromofori va apărea galbenă. Agenții de albire distrug în esență cromoforii (eliminând astfel culoarea), prin oxidarea sau reducerea acestor grupări absorbante. Astfel, înălbitorii pot fi clasificați fie ca agenți oxidanți, fie ca agenți reducători .
Unele dintre utilizările agenților de albire sunt:
- Înălbirea textilelor și țesăturilor
- Înălbirea pastei de lemn
- Îndepărtarea petelor
- Spălarea și curățarea comercială și casnică
- . Ca ingrediente în detergenții de curățare și produsele de spălat vase
- Albirea părului
Înălbitori oxidanți
Un număr mare de înălbitori oxidanți au fost analizați de Jules A. Szilard în Bleaching Agents and Techniques (1973). Înălbitorii oxidanți (și agenții de înălbire) utilizați în mod obișnuit în prezent sunt: clorul, dioxidul de clor, hipocloriții alcalini, peroxidul de hidrogen, compușii de peroxid de oxigen, precum și lumina soarelui și lumina artificială.
Clor (Cl 2 ). Descoperirea clorului de către chimistul suedez Carl Wilhelm Scheele în 1774 a marcat începutul erei moderne a înălbitorului. Potrivit lui Sidney M. Edelstein într-un articol de revistă din 1948 intitulat „The Role of Chemistry in the Development of Dyeing and Bleaching”, chimistul francez Claude-Louis Berthollet a fost primul care a folosit clorul pentru a albi țesăturile din bumbac și in.
Clorul a fost folosit pentru albirea pastei de lemn. Multe fabrici de celuloză care utilizează procesul de fabricare a celulozei Kraft prepară pe loc hidroxidul de sodiu (necesar pentru a digera așchiile de lemn) prin electroliza saramurii , o soluție apoasă concentrată de clorură de sodiu.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Clorul este un produs secundar. Prin înălbirea ulterioară cu clor a pastei brune se obține un produs care poate fi utilizat pentru fabricarea hârtiei de scris și de tipar. Din nefericire, compușii organici din pastă sunt atât oxidați, cât și clorurați, rezultând cantități mici de compuși organoclorurați, inclusiv
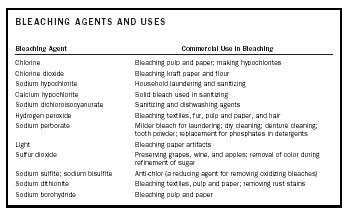
| AGENȚI DE ALBIERE ȘI UTILIZĂRI | |
| Agent de albire | Utilizare comercială în albire |
| Clor | Albirea celulozei și a hârtiei; fabricarea de hipocloriți |
| Dioxid de clor | Albirea hârtiei kraft și a făinii |
| Hipoclorit de sodiu | Spălarea și dezinfectarea gospodăriilor |
| Calciu hipoclorit | Înălbitor solid utilizat în igienizare |
| Dicloroizocianuratul de sodiu | Agenți de igienizare și spălare a vaselor |
| Peroxid de hidrogen | Înălbirea textilelor, blănuri, celuloză și hârtie și păr |
| Perborat de sodiu | Înălbitor mai blând pentru spălare; curățare uscată; curățarea protezelor dentare; pudră de dinți; înlocuitor pentru fosfați în detergenți |
| Lumină | Albirea artefactelor din hârtie |
| Dioxid de sulf | Conservarea strugurilor, vinului și merelor; îndepărtarea culorii în timpul rafinării zahărului |
| Sulfit de sodiu; bisulfit de sodiu | Anticlor (un agent reducător pentru îndepărtarea înălbitorilor oxidanți) |
| Ditionit de sodiu | Înălbirea textilelor, a celulozei și a hârtiei; îndepărtarea petelor de rugină |
| Borohidrură de sodiu | Albirea celulozei și hârtiei |
dioxine. De fapt, cea mai abundentă dioxină produsă de procesul de albire a celulozei și a hârtiei, 2,3,7,8-tetraclorodibenzo- p -dioxina (2,3,7,8-TCDD), s-a dovedit a fi atât o substanță cancerigenă, cât și o toxină mortală . Astfel, clorul ca agent de înălbire este înlocuit cu agenții de înălbire mai siguri, dioxidul de clor și peroxidul de hidrogen. De fapt, tendința în industria celulozei și a hârtiei este de a se ajunge la o albire fără clor (TCF). În prezent, clorul este utilizat în industria de înălbire în principal pentru a pregăti soluții de hipoclorit și înălbitori uscați, cum ar fi hipocloritul de calciu.
Dioxid de clor (ClO 2 ). Dioxidul de clor a fost utilizat ca agent de albire atât în faza gazoasă, cât și în soluție apoasă. Din cauza naturii sale explozive, dioxidul de clor în fază gazoasă este adesea diluat cu azot sau dioxid de carbon. În cazul în care este depozitat sau transportat, dioxidul de clor este trecut prin apă rece și păstrat la frigider.
Dioxidul de clor se prepară industrial prin reducerea cloratului de sodiu cu dioxid de sulf în soluție apoasă.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
O metodă relativ sigură de preparare a ClO 2 implică reacția dintre cloritul de sodiu (NaClO 2 ) și formaldehida (H 2 CO).
H 2 CO + H + + + ClO 2 – → HOCl + HCOOH (3)
Pe măsură ce are loc reacția 3, pH-ul soluției scade (datorită producerii de acid formic ). Aciditatea crescută a soluției favorizează formarea de ClO 2 , prezentată în ecuația 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
În soluție acidă, dioxidul de clor se comportă ca un agent oxidant. Reducerea completă a ClO 2 este prezentată în ecuația 5.
ClO 2 + 4H + + 5 e – → Cl – + 2H 2 O (5)
Etapele individuale ale acestei reacții globale de reducere produc HClO 2 , HOCl și Cl 2 , care se comportă toate ca agenți oxidanți. Este necesar un mediu acid, deoarece ClO 2 se disproporționează în soluție alcalină, așa cum se arată în ecuația 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Dioxidul de clor este utilizat în principal pentru albirea celulozei.
Hipocloriți (OCl – ). Soluțiile de înălbire cu hipocloriți sunt fabricate din NaOCl și, într-o măsură mai mică, din Ca(OCl) 2 . Hipocloriții sunt utilizați la spălare, ca dezinfectanți, la albirea celulozei și a textilelor și la îndepărtarea cernelii de pe hârtia reciclată. Soluțiile comerciale de înălbire se obțin prin trecerea clorului gazos prin hidroxid de sodiu apos, diluat și rece, așa cum se arată în ecuația 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternativ, ionul hipoclorit poate fi generat prin hidroliza compușilor organici de azot-clorură. Unii dintre cei mai importanți compuși azot-clorurați utilizați în acest mod sunt izocianurații clorurați. Aceștia sunt utilizați în produsele de curățare și de spălare a vaselor de spălat vase.
Pentru a fi un înălbitor eficient, soluția de hipoclorit trebuie să fie menținută alcalină (pH > 9,0), pentru a suprima hidroliza OCl – (a se vedea ecuația 8) și a preveni formarea de HOCl instabil.
OCl – + H 2 O → HOCl + OH – (8)
În soluțiile acide, HOCl se formează și se descompune.
3HOCl → HClO 3 + 2HCl (9)
HOCl va reacționa, de asemenea, cu HCl, unul dintre produsele de descompunere.
HOCl + HCl → H 2 O + Cl 2 (10)
Soluțiile de înălbire cu hipoclorit nu trebuie să conțină cationi de metale grele, deoarece acești cationi (ca și lumina sau căldura) favorizează descompunerea HOCl, așa cum se arată în ecuația 11.
2HOCl → 2HCl + O 2 (11)
Ingredientele active din înălbitorii cu hipoclorit variază în funcție de pH. La pH < 2, Cl 2 este principalul component în soluție; la pH 4 până la 6, HOCl este specia dominantă; la pH > 9, OCl – este singurul component prezent. Ionul hipoclorit din soluția bazică este cel care reprezintă ingredientul activ din înălbitorul de uz casnic, care este în mod obișnuit de aproximativ 5 până la 6 procente de NaOCl. Ionul OCl – oxidează cromoforii din materialele colorate și este el însuși redus la ioni clorură și hidroxid.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Procesul de albire efectuat de înălbitorul hipoclorit comercial este adesea îmbunătățit prin utilizarea de înălbitori optici, compuși care absorb lumina ultravioletă incidentă și emit lumină vizibilă, ceea ce face ca țesătura să pară mai strălucitoare și mai albă.
Peroxid de hidrogen (H 2 O 2 ) . Peroxidul de hidrogen poate fi preparat prin reacția dintre peroxidul de bariu și acidul sulfuric (a se vedea ecuația 13). Deoarece sulfatul de bariu precipită, peroxidul de hidrogen este ușor de separat.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Peroxidul de hidrogen, ca agent de albire utilizat în industria celulozei și hârtiei, are avantajul că nu poluează. Din cauza instabilității peroxidului de hidrogen pur, în procesul de albire se utilizează soluții apoase. La temperatura camerei, peroxidul de hidrogen se descompune foarte lent în apă și oxigen.
2H 2 O 2 → H 2 O + O 2 (14)
Cu toate acestea, prezența cationilor metalelor de tranziție (în special Fe 3+ , Mn 2+ , și Cu 2+ ) și a altor catalizatori accelerează dramatic această reacție. Ca urmare, peroxidul de hidrogen apos trebuie să fie stabilizat cu agenți de complexare care sechestrează cationii metalelor de tranziție.
Specia activă de albire din peroxidul de hidrogen este anionul perhidroxil , OOH – , format prin ionizarea H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + + OOH – (15)
Constanta de ionizare acidă a peroxidului de hidrogen este foarte mică ( K a = 2 × 10 -12 ) cu rezultatul că soluțiile de H 2 O 2 trebuie să fie alcalinizate pentru a

pentru a crește concentrația de OOH – . În absența unui mediu alcalin, peroxidul de hidrogen nu mai este eficient ca agent de înălbire. De exemplu, în etapa de decolorare a vopsirii părului se utilizează adesea peroxid de hidrogen (5-6%), dar și amoniac pentru a furniza un mediu alcalin.
În același timp, pH-ul nu trebuie să crească peste 11, deoarece în acest punct începe să aibă loc descompunerea OOH -ului.
2OOH – → O 2 + 2OH – (16)
Compuși peroxigeni. Există o serie de compuși peroxigenici solizi care eliberează peroxid de hidrogen atunci când sunt dizolvați în apă. Printre aceștia se numără perboratul de sodiu (NaBO 3 z 4H 2 O sau NaBO 2 z H 2 O 2 z 3H 2 O) și carbonatul de sodiu peroxihidrat (2Na 2 CO 3 z 3H 2 O 2 ). Structura perboratului de sodiu conține peroxoanionul B 2 (O 2 ) 2 (OH) 4 2- , care conține două legături O-O care unesc două grupări tetraedrice BO 2 (OH) 2- . Acești compuși peroxiogeni sunt utilizați în detergenți, detergenți pentru proteze dentare și pulberi pentru dinți.
Albirea cu lumină. Albirea care implică fie lumina naturală a soarelui, fie lumina artificială, a fost folosită pentru a îndepărta petele de pe artefactele din hârtie și pentru a trata textilele. Materialul care urmează să fie albit este mai întâi scufundat într-o soluție alcalină de bicarbonat de calciu sau de magneziu, iar apoi este protejat de radiațiile ultraviolete prin acoperirea lui cu plexiglas, Lexan sau Mylar. Expunerea la lumină se lasă apoi să aibă loc timp de două până la patru ore, în cazul luminii solare naturale, și de două până la douăsprezece ore, în cazul luminii artificiale.
Înălbitori reducători
Agenții reducători utilizați în înălbire includ sulfiți, bisulfiți, ditioniți și borohidrură de sodiu, toți aceștia fiind utilizați în înălbirea celulozei și a textilelor.
Sulfiți (SO 3 2- ) și bisulfiți (HSO 3 – ). Starea de oxidare a sulfului atât în SO 3 2- cât și în HSO 3 – este +4, iar oxidarea la +6 are loc cu ușurință, cu formarea de SO 4 2- și, respectiv, HSO 4 – , ceea ce face ca sulfiții și bisulfiții să fie buni agenți reducători.
Ditioniți (S 2 O 4 2- ) . Atât ditionitul de sodiu, cât și cel de zinc au găsit utilizare în albirea pastelor mecanice și a textilelor. Prepararea ionului ditionit se realizează prin reducerea ionului bisulfit și a dioxidului de sulf cu praf de Zn.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
Ionul ditionit, S 2 O 4 2- , care are sulful în starea de oxidare +3, se comportă ca un agent reducător puternic în soluție alcalină.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
Pe măsură ce pH-ul scade, puterea reducătoare a ionului ditionit scade, așa cum prevede principiul lui LeChatelier.
Ditioniții sunt utili în îndepărtarea petelor de rugină, iar soluțiile neutre de citrat de Na 2 S 2 O 4 au fost folosite pentru a îndepărta produsele de coroziune ale fierului de pe obiectele recuperate de pe Titanic.
Borohidrură de sodiu (NaBH 4 ). Borohidrida de sodiu a fost utilizată în principal în albirea industrială a pastelor mecanice. Ionul BH 4 – este un agent reducător puternic în soluție alcalină.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
O problemă legată de utilizarea borohidridei de sodiu este că ionul BH 4 – se descompune lent în soluție apoasă.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Ca o metodă alternativă, sărurile de BH 4 – pot fi dizolvate fie în CH 3 OH, fie în C 2 H 5 OH, mai puțin toxic. Descompunerea ionului BH 4 – în alcooli are loc într-un ritm mult mai lent:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Concluzie
Un agent de albire poate albi sau decolora o substanță prin reacția cu cromoforii care sunt responsabili de culoarea substanței respective. În funcție de natura cromoforilor, agentul de albire va fi fie un agent oxidant, fie un agent reducător. Altfel spus, cromoforul este fie oxidat, fie redus pentru a produce o substanță incoloră sau albită. Agenții de albire și utilizările lor comerciale sunt rezumate în tabelul 1.