Abstract
Powikłania takie jak nieszczelność zespolenia (anastomotic leakage, AL) po zabiegach na jelicie grubym wiążą się z istotną chorobowością. Subkliniczna AL może być myląca z powodu zachowania klinicznego i dlatego stanowi dylemat diagnostyczny. Czasami badania radiologiczne mają charakter pomocniczy, ale mogą stanowić przeszkodę w postępie diagnostycznym. W niniejszej pracy przedstawiono przypadek subklinicznej AL, w którym błąd diagnostyczny doprowadził do niekorzystnych następstw. U pacjentów podatnych na zachorowanie wyniki badań diagnostycznych muszą być interpretowane z ostrożnością w kontekście scenariusza klinicznego. Chirurdzy i radiolodzy muszą być dobrze zaznajomieni z różnymi postaciami powikłań pooperacyjnych po zabiegach chirurgicznych w obrębie dolnego odcinka przewodu pokarmowego i ich manifestacją w badaniach obrazowych.
Słowa kluczowe
przeciek zespolenia, podkliniczny przeciek, lewatywa kontrastowa
Wprowadzenie
Zabiegi kolorektalne stanowią istotną część chirurgii ogólnej. Pomimo postępu i precyzyjnej techniki chirurgicznej, powikłania, w tym nieszczelność zespolenia (AL), są przyczyną znacznej zachorowalności i śmiertelności. Miejscowy lub ograniczony przeciek występuje bez niepokojących objawów, stąd nazywany jest subklinicznym przeciekiem zespolenia. Tomografia komputerowa (CT) jamy brzusznej stała się metodą z wyboru w ocenie powikłań pooperacyjnych. Chociaż jej wyższość w tych przypadkach jest nie do udowodnienia, nierzadko zdarzają się błędy ludzkie w raportowaniu, które prowadzą do gorszych wyników. Poleganie na badaniach obrazowych jako narzędziu diagnostycznym zastępującym ocenę kliniczną (ze względu na skutki medyczno-prawne) stało się powodem do niepokoju.
Prezentacja przypadku
An 82-letni mężczyzna został przyjęty na oddział medyczny z powodu nietypowej senności. Sześć tygodni temu przeszedł laparoskopowo wspomaganą przednią resekcję z wyłonieniem ileostomii z powodu gruczolakoraka środkowej części odbytnicy. Zespolenie wykonano za pomocą staplera okrężnego 30 mm. Podczas obecnej prezentacji chory skarżył się na zwiększoną ilość wydzieliny stomijnej i nietypowe zmęczenie. Badanie przedmiotowe było bez zmian. Rutynowe badania hematologiczne wykazały wysoki stosunek mocznika do kreatyniny oraz nieprawidłowości elektrolitowe. Rozpoczęto leczenie zaburzeń objętości i elektrolitów.
Następnie wydzielanie ze stomii stopniowo zmniejszało się, a pacjent zaczął skarżyć się na ból brzucha i wymioty. W tym momencie do pomocy włączono zespół chirurgiczny. Radiogramy jamy brzusznej wykazały poszerzone pętle jelita cienkiego i liczne poziomy płynów powietrznych. Tomografia komputerowa jamy brzusznej wykazała poszerzone pętle jelita cienkiego. Zespolenie jelita grubego było nienaruszone, bez śladów przecieku. Diagnoza różnicowa obejmowała albo niedrożność jelita cienkiego albo niedrożność jelit wtórną do zaburzeń elektrolitowych. Rozpoczęto dekompresję nosowo-żołądkową i resuscytację płynami. Przewidując opóźniony powrót do zdrowia w związku z obecnością zrostów i przebytym zabiegiem operacyjnym, rozpoczęto żywienie pozajelitowe. Początkowo cechy obturacji poprawiły się po 48 godzinach z powrotem funkcji stomii.
Jednakże po ponownym wprowadzeniu czystych płynów doustnych u pacjenta wystąpiły nawracające bóle i wymioty żółciowe. Rozpuszczalny w wodzie kontrast został podany przez sondę nosowo-żołądkową (NGT) w celu uzyskania wyników diagnostycznych i terapeutycznych. W badaniu stwierdzono niedrożność jelita cienkiego w okolicy ileostomii i radiolog zalecił podanie kontrastu przez ileostomię w celu potwierdzenia. Przez stomię założono cewnik Foleya, a pacjentkę skierowano do pracowni diagnostyki obrazowej w celu powtórzenia badania. Nieoczekiwanie raport sugerował wynaczynienie kontrastu w jamie otrzewnowej i pneumoperitoneum. Jako możliwą przyczynę zasugerowano perforację w miejscu ileostomii, być może spowodowaną przez cewnik.
Rozważając perforację ileostomii, podjęto decyzję o pilnej laparotomii. Ponieważ minął szósty tydzień od pierwotnego zabiegu, wykonano lewatywę z kontrastem rozpuszczalnym w wodzie w celu sprawdzenia integralności zespolenia przed ewentualną resekcją ileostomii lub jej odwróceniem w razie potrzeby. Stwierdzono, że zespolenie jelita grubego jest nienaruszone, a odbytnica dobrze wyczuwalna. Pooling of free contrast in the pelvis was assumed as spillage from ileostomy perforation at previous instance (Figure 1 arrow).
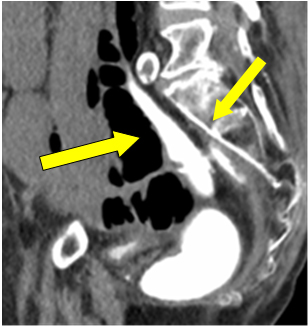
Figure 1: Contrast extravasation in pelvis.
A re-look midline laparotomy was performed. Zaskakująco nie uwidoczniono makroskopowej perforacji. Stwierdzono umiarkowaną ilość płynów hemosferycznych z nielicznymi zrostami włóknistymi bez żadnych pasm utrudniających. W miednicy zauważono przylegające do siebie pętle jelita cienkiego normalnego kalibru. Nie zostały one naruszone przez operującego chirurga (brak nieszczelności zespolenia w badaniach obrazowych). Wykonano adhesiolizę pozostałego jelita cienkiego i odwrócono ileostomię.
Pacjent został przeniesiony na oddział intensywnej terapii i był pod ścisłą obserwacją. Pacjent pozostawał stabilny do piątej doby pooperacyjnej, kiedy to zaczął majaczyć i rozwinęło się u niego szybkie migotanie przedsionków. Zauważono, że rana po laparotomii jest w stanie dehiscencji. Ze względu na złożony wywiad chirurgiczny konieczne było wykonanie powtórnej tomografii komputerowej. Wykazało ono rozległą odmę opłucnową i około 200 ml wzmacniającej się obwódki w lewej rynience przymacicznej. Pacjentkę ponownie przewieziono na salę operacyjną, gdzie wykonano reekshumację. Po otwarciu jamy brzusznej stwierdzono kałowe zapalenie otrzewnej z dużym ubytkiem w zespoleniu jelita grubego, ukrytym przez zrosty jelita cienkiego w tym miejscu. Wykonano zdjęcie zespolenia i wyłoniono stomię końcową esicy z zamknięciem kikuta odbytnicy.
Pacjent miał powolną rekonwalescencję i został przekazany do ośrodka rehabilitacyjnego. Ostatecznie został wypisany do domu po 14 dniach pobytu w ośrodku przejściowym.
Dyskusja
AL pozostaje główną przyczyną zachorowalności i śmiertelności w chirurgii kolorektalnej. Jeśli nie zostanie szybko zidentyfikowana i odpowiednio leczona, śmiertelność może wynosić do 50%. Niewydolna stomia nie gwarantuje integralności zespolenia dolnego odcinka przewodu pokarmowego .
W literaturze opisano różne określenia i stopnie zaawansowania zespolenia. Postępowanie kliniczne zależy od lokalizacji anatomicznej, stopnia nieszczelności i nasilenia objawów. Subliniczne cechy przecieków zamkniętych często prowadzą do pomyłek diagnostycznych. Wysoki indeks podejrzliwości i wczesne wykrycie jest kluczem do szybkiego postępowania klinicznego. Failure to do this will result in clinical deterioration and further burden on economy of health system.
CT scan is most readily available investigation for postoperative intestinal complications. Niektóre radiologiczne cechy nieszczelności, takie jak powietrze w okolicy zespolenia, płyn lub kombinacja obu tych czynników, mogą występować rzadko. Jednak jego skuteczność diagnostyczna w dolnym odcinku jelita AL nie jest dobrze ustalona. Obrazowanie może być mylące w interpretacji ze względu na zmiany pooperacyjne i inne czynniki zakłócające, takie jak resztkowa otrzewna, blizny lub zapalne sploty tkanek miękkich przedkrzyżowych. Wielkość i rozległość przecieku jest kolejnym ważnym czynnikiem, o którym należy pamiętać.
Wylewka kontrastowa nie tylko wykazuje szybkość i rozległość przecieku, ale również pomaga w diagnostyce zjawiska, jakim są kolekcje przedkrzyżowe. Jej rola jako rutynowego badania przed odwróceniem stomii jest nadal dyskusyjna, zwłaszcza u pacjentów, u których nie podejrzewa się tego klinicznie. Badania wykazały jednak wyższość lewatywy z kontrastem rozpuszczalnym w wodzie w wykrywaniu przecieku w zespoleniu dystalnym, w którym stosowane są obie metody.
W różnych badaniach odnotowano również wskaźniki fałszywie ujemne rzędu 35%-49% w przypadku obrazowania radiologicznego podejrzanych przecieków zespolenia.
W trudnych sytuacjach należy polegać raczej na ocenie klinicznej niż na samych badaniach obrazowych, ponieważ negatywny wynik badania nie jest ostateczną odpowiedzią, jeśli podejrzenie kliniczne nie jest odpowiednio potraktowane.
W tym scenariuszu niedrożność jelit była czerwonym śledziem (prawdopodobnie trwający ileus z powodu subklinicznej sepsy). Podczas pierwszej eksploracji nie stwierdzono makroskopowego przecieku w ileostomii. Badanie histopatologiczne wycinka nie wykazało uszkodzenia błony śluzowej. Jednak rozdarcie błony surowiczej sugerowało, że cewnik przed wprowadzeniem do otrzewnej przebył drogę podśluzówkową. Przeprowadzono retrospektywną analizę zdjęć z udziałem zakładu radiologii. Na jednym z filmów stwierdzono, że końcówka cewnika przechodzi przez płaszczyznę podskórną (ryc. 2). Tłumaczy to przedostanie się wolnego kontrastu do jamy otrzewnej, a nie rzeczywistą perforację światła ileostomii. Domniemanie dotyczące pochodzenia kontrastu przyczyniło się do powstania zagadki diagnostycznej.
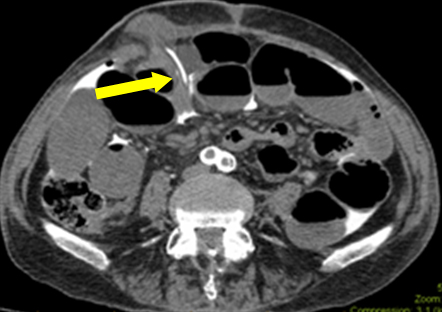
Rycina 2: Obraz osiowy przedstawiający końcówkę cewnika przechodzącą z płaszczyzny podskórnej do jamy otrzewnej
Choć trywialne, ale wyciek kontrastu i jego gromadzenie się w pobliżu miejsca zespolenia w lewatywie było istotnym znaleziskiem. Niestety przypisano to części wcześniejszych wynaczynień przez perforację stomii.
Pacjent miał niedawno operację z powodu nowotworu złośliwego i z powodu złego odżywiania oraz trwającej niedrożności jelit, gojenie zespolenia było już zagrożone. To zwiększa podatność na przeciek, co ponownie wzmacnia potrzebę wysokiego indeksu podejrzliwości w tej sytuacji klinicznej.
Ze względu na wcześniejszą niską resekcję przednią pętle jelita cienkiego przylegały do miednicy, ograniczając początkowo niewielkie AL, stąd brak było klasycznych cech klinicznych. Po odwróceniu ileostomii i zaprzestaniu odprowadzania kału w celu ochrony integralności zespolenia, wielkość przecieku postępowała i doprowadziła do pogorszenia stanu chorego z zapaleniem otrzewnej i rozejściem się powłok brzusznych.
Błędy diagnostyczne mogą wystąpić w każdej dziedzinie medycyny. Należy zachować ostrożność w interpretacji wyników badań na tle wiedzy klinicznej. Możemy zmniejszyć liczbę takich przypadków poprzez rutynowe sprawdzanie skanów przed zabiegami, a także stworzyć bank przyszłych przypadków poprzez regularne konstruktywne informacje zwrotne dotyczące badań obrazowych, które różnią się od wyników operacyjnych.
Pacjenci z chorobą nowotworową, związaną z innymi chorobami współistniejącymi i upośledzonym stanem odżywienia, są bardzo podatni na upośledzenie gojenia się zespolenia jelitowego. Powinny być one uważane za podatne na subkliniczną anastomozę, zwłaszcza gdy klasyczne objawy nieszczelności są nieobecne. Radiologia pooperacyjna powinna być w tym przypadku interpretowana ostrożnie, a interwencja chirurgiczna może być lepszym sposobem diagnostycznym, a więc i terapeutycznym.
Dodatkowo, nauka radiologii zabiegowej ma ogromne znaczenie dla chirurgów, a regularne informacje zwrotne od radiologów mogą pomóc w identyfikacji nowych prezentacji powikłań pooperacyjnych po operacjach jelita grubego.
- Trencheva K, Morrissey KP, Wells M, Mancuso CA, Lee SW, et al. (2013) Identifying important predictors for anastomotic leak after colon and rectal resection: prospective study on 616 patients. Ann Surg 257: 108-113.
- Lim M, Akhtar S, Sasapu K, Harris K, Burke D, et al. (2006) Clinical and subclinical leaks after low colorectal anastomosis: a clinical and radiologic study. Dis Colon Rectum 49: 1611-1619.
- Bruce J, Krukowski ZH, Al-Khairy G, Russell EM, Park KG (2001) Systematic review of the definition and measurement of anastomotic leak after gastrointestinal surgery. Br J surg 88: 1157-1168.
- Guillem JG, Cohen AM (1999) Current issues in colorectal cancer surgery. Semin Oncol 26: 505-513.
- Leester B, Asztalos I, Polnyib C (2002) Septic complications after low anterior rectal resection–is diverting stoma still justified? Acta Chir Iugosl 49: 67-71.
- Power N, Atri M, Ryan S, Haddad R, Smith A (2007) CT assessment of anastomotic bowel leak. Clin Radiol 62: 37-42.
- Nicksa GA, Dring RV, Johnson KH, Sardella WV, Vignati PV, et al. (2007) Anastomotic leaks: what is the best diagnostic imaging study? Dis Colon Rectum 50: 197-203.
- Kalady MF, Mantyh CR, Petrofski J, Ludwig KA (2008) Routine contrast imaging of low pelvic anastomosis prior to closure of defunctioning ileostomy: is it necessary? J Gastrointest Surg 12: 1227-1231.
- Khair G, Alhamarneh O, Avery J, Cast J, Gunn J, et al. (2007) Routine use of gastrograffin enema prior to the reversal of a loop ileostomy. Dig Surg 24: 338-341.
- Akyol AM, McGregor JR, Galloway DJ, George WD (1992) Early postoperative contrast radiology in the assessment of colorectal anastomotic integrity. Int J Colorectal Dis 7: 141-143.
- Goligher JC, Graham NG, De Dombal FT (1970) Anastomotic dehiscence after anterior resection of rectum and sigmoid. Br J Surg 57: 109-118.
- Haynes IG, Goldman M, Silverman SH, Alexander-Williams J, Keighley MR (1986) The Water-soluble contrast enema after colonic anastomosis. Br J Surg 69: 714-717.
- Khoury W, Ben-Yehuda A, Ben-Haim M, Klausner JM, Szold O (2009) Abdominal computed tomography for diagnosing postoperative lower gastrointestinal tract leaks. J Gastrointest Surg 13: 1454-1458.
- Doeksen A, Tanis PJ, Wüst AF, Vrouenraets BC, van Lanschot JJ, et al. (2008) Radiological evaluation of colorectal anastomoses. Int J Colorectal Dis 23: 863-868.