W tej serii Colin Baker z Bedford School przeprowadza spektakularne demonstracje, zaprojektowane tak, aby zawładnąć wyobraźnią uczniów. Demonstracje są łatwe do przygotowania, bezpieczne do usunięcia i działają.
Nic nie ma tendencji do odciskania faktów chemicznych w umyśle tak bardzo jak wystawa ciekawych eksperymentów – Samuel Parkes, 1816
We wrześniu 1931 roku amerykański chemik Wallace Carothers, pracujący w laboratoriach firmy DuPont, zgłosił badania nad „gigantycznymi” cząsteczkami zwanymi polimerami, opartymi na zrozumieniu struktury chemicznej wełny. Jego praca koncentrowała się na włóknie określanym po prostu jako „66”, liczba pochodząca od jego struktury molekularnej. W 1935 r. narodził się nylon, „cudowne włókno”, które odniosło ogromny sukces na swoim pierwszym rynku – wyrobów pończoszniczych dla kobiet. Kiedy Stany Zjednoczone przystąpiły do II wojny światowej w grudniu 1941 r., War Production Board przeznaczył całą produkcję nylonu do użytku wojskowego, w tym do produkcji spadochronów i opon do bombowców B29.

Źródło: Colin Baker
Reakcja między dichlorkiem dekanodioylu a 1,6-diaminoheksanem
Chlorek dikwasu w rozpuszczalniku organicznym tworzy w wodzie warstwę niemieszalną z alifatyczną diaminą. Na granicy faz, gdzie spotykają się te dwa bezbarwne roztwory, powstaje biały, długołańcuchowy polimer. Ten film polimerowy może być odciągnięty od interfejsu i jest natychmiast zastępowany w miarę jego usuwania. Jeśli przestaniemy ciągnąć, wydaje się, że nic się nie dzieje – reakcja zatrzymuje się, ale jest natychmiast wznawiana, gdy zaczniemy ciągnąć ponownie. Reakcja może zachodzić przez kilka godzin.

Źródło: Colin Baker
Kit
- Cykloheksan, 100cm3 (drażniący, wysoce łatwopalny);
- Dichlorek dekanodioilu, 5.0cm3;
- Woda destylowana, 100cm3;
- Węglan sodu bezwodny, 10g;
- 1,6-diaminoheksan, 5.0g;
- Dwie zlewki, 250cm3;
- Zlewka, 5cm3;
- Pęseta;
- Pręty szklane.
Bezpieczeństwo
Dichlorek dekanodioilu i 1,6-diaminoheksan są żrące. Są szkodliwe w przypadku połknięcia lub wdychania, a w kontakcie ze skórą powodują oparzenia. Są silnie drażniące. Cykloheksan jest wysoce łatwopalny i drażniący.
Procedura
Przygotować następujące dwa roztwory:
Roztwór A: dichlorek dekanodioilu w cykloheksanie. Do zlewki o pojemności 250 cm3 wlać 100 cm3 cykloheksanu, dodać 5,0 cm3 dichlorku dekanodioylu i mieszać do rozpuszczenia. Roztwór ten zachowuje trwałość przez około cztery tygodnie.
Roztwór B: 1,6-diaminoheksan w wodnym węglanie sodu. Do zlewki o pojemności 250cm3 wlać 100cm3 wody destylowanej, dodać 10g bezwodnego węglanu sodu i mieszać do rozpuszczenia. Dodać 5,0g stałego 1,6-diaminoheksanu i mieszać do rozpuszczenia.
Do zlewki o pojemności 5cm3 wlać 2cm3 roztworu A. Ostrożnie dodać taką samą objętość roztworu B. Roztwór A zawiera rozpuszczalnik organiczny, jest gęstszy od warstwy wodnej i dlatego jest warstwą spodnią. Chwyć pęsetą błonę poliamidową (białe ciało stałe), która zaczyna się tworzyć na granicy tych dwóch roztworów i powoli wyciągnij ją ze zlewki. Owiń włókno wokół szklanego pręcika i kontynuuj ciągnięcie. Zatrzymaj proces, gdy jeden z reagentów zostanie zużyty.
Wskazówki specjalne
Należy zachować ostrożność podczas dodawania drugiego roztworu, aby uniknąć mieszania. Zademonstruj, jak można wyciągnąć włókno w postaci jednej ciągłej nici, a następnie zorganizuj konkurs, aby zobaczyć, która para uczniów potrafi wyprodukować najdłuższe włókno. Powinni oni być w stanie wyprodukować do 5 m zanim włókno pęknie. Szybko zdadzą sobie sprawę, że potrzebują pomocy, aby utrzymać włókno – dzielę klasę na dwie duże grupy, każda uzbrojona w szklane pręty. Moi uczniowie wyprodukowali włókna przekraczające 30m, nawet próbując obejść zakręty. Należy ograniczyć maksymalną objętość każdego roztworu do 10cm3. Uczniowie muszą nosić rękawiczki i unikać kontaktu z włóknem. Jeśli włókno się zatnie, należy je zawinąć w papier chłonny. Wszelkie rozlane ciecze należy wytrzeć papierem chłonnym i wyrzucić do śmieci.
Cele dydaktyczne
Poliamidy są polimerami, w których powtarzające się jednostki są utrzymywane razem przez połączenia amidowe, -CO-NH-.
Nylon-6,10
Nylon-6,10 jest wytwarzany z dwóch monomerów, z których jeden zawiera sześć atomów węgla, a drugi 10 – stąd jego nazwa. Monomerem 10-węglowym jest dichlorek dekanodioilu (ClOC(CH2)8 COCl), chlorek kwasu z grupą -COCl na każdym końcu. Drugi monomer to sześciowęglowy łańcuch z grupą aminową, -NH2, na każdym końcu. Jest to 1,6-diaminoheksan (H2 N(CH2)6 NH2, znany również jako heksano-1,6-diamina).
Gdy te dwa związki polimeryzują, grupy aminowe i kwasowe łączą się, za każdym razem z utratą cząsteczki chlorowodoru:
n ClOC-(CH2)8-COCl + n H2N-(CH2)6-NH2 → -(CO-(CH2)8-CONH-(CH2)6-NH)n – + n HCl
Ten proces polimeryzacji polegający na utracie małej cząsteczki znany jest jako polimeryzacja kondensacyjna.
Nylon-6,6
Polimer ten jest wytwarzany przez kondensację dwóch sześciowęglowych cząsteczek, kwasu heksanodiowego i 1,6-diaminoheksanu. W przemyśle, cykloheksan jest używany do produkcji obu monomerów. Jeśli cykloheksan zostanie utleniony, pierścień otwiera się i na obu końcach łańcucha pojawia się grupa kwasowa – powstaje kwas heksanodiowy. Jeśli kwas ten zobojętni się amoniakiem, powstaje sól diamonowa (NH4 OOCCH2 CH2 CH2 CH2 COONH4), którą można odwodnić (przez ogrzewanie do 350°C) i zredukować (stosując H2/Ni) do 1,6-diaminoheksanu. Następuje polimeryzacja kondensacyjna diacydu i diaminy z utratą wody:
n HOOC-(CH2)4 -COOH + n H2 N-(CH2)6 -NH2 → -(CO-(CH2)4 -CONH-(CH2)6 -NH)n – + n H2 O
Nylon-6
Możliwe jest otrzymanie nylonu z pojedynczego monomeru kaprolaktamu (heksahydro-2H-azepin-2-on, 1).
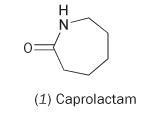
Kaprolaktam zawiera wewnętrzne połączenie amidowe. Polimeryzacja tej cząsteczki powoduje otwarcie pierścienia i łączenie się w ciągły łańcuch:
-(NH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CO)n –
Nylon zrewolucjonizował przemysł włókienniczy i był prekursorem wielu współczesnych, syntetycznych włókien. Pozostaje on ważnym i szeroko stosowanym materiałem w produkcji.