Here’s the thing about the coverage of „amines” in Org 2: there’s no narrative.
W przeciwieństwie do większości rozdziałów, nie zaczyna się od zbioru pojęć, a następnie buduje się serię przykładów, do których można zastosować te pojęcia.
Nie. Typowy rozdział o aminach w podręczniku wprowadzającym jest w zasadzie tylko zlepkiem pozornie przypadkowych tematów wrzuconych razem, które nie pasowały nigdzie indziej. Jedynym łączącym wątkiem jest to, że zawierają one azot w jakiś sposób.
Przypadek w punkcie: dzisiejszy przypadkowy post o aminach jest o rearanżacji Hofmanna i Curtiusa.
Co do tego skłania, możesz zapytać? Nie ma dobrej odpowiedzi. Większość kursów obejmuje je w pewnym momencie, a one muszą się gdzieś zmieścić. Więc co do diabła. Dlaczego nie teraz?
Spis treści
- Układy Hofmanna i Curtiusa
- Mechanizm układów Hofmanna i Curtiusa, część pierwsza – tworzenie układu
- Część druga: Kluczowy etap układu w układach Hofmanna i Curtiusa
- Część trzecia: Formation of the Isocyanate
- Putting The Steps Together
- The Fate of the Isocyanate: Formation of Carbamates, Amines, And Ureas
- Podsumowanie: The Hofmann and Curtius Rearrangements
- Notes
- (Advanced) References and Further Reading
- The Hofmann and Curtius Rearrangements
- Mechanizm Rearanżacji Hofmanna i Curtiusa, Część 1: Ustawianie Rearanżacji
- Część 1: Preludium
- 3. Kluczowy etap rearanżacji w reakcji Hofmanna i Curtiusa
- Powstawanie izocyjanianu
- Putting The Steps Together
- The Fate Of The Isocyanate
- Podsumowanie: The Hofmann and Curtius Rearrangements
- Notatki
- (Advanced) References and Further Reading
The Hofmann and Curtius Rearrangements
Przestawienia Hofmanna i Curtiusa są dwoma przykładami całej rodziny reakcji przestawiania, które mają wspólny etap mechanistyczny.
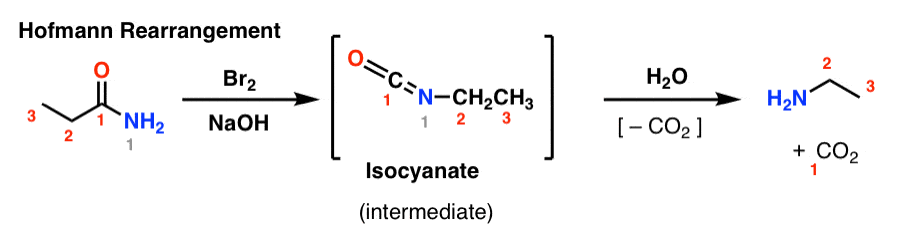
W rearanżacji Hofmanna, amid jest traktowany bromem i zasadą (zwykle NaOH lub KOH). Po podgrzaniu powstaje pośredni izocyjanian, który nie jest izolowany. W obecności wody, izocyjanian traci dwutlenek węgla („dekarboksyluje”), dając aminę.
Kluczowym wiązaniem, które tworzy się w Hofmannie jest wiązanie C2-N. Zauważ jak grupa karbonylowa (C1) jest tracona, tworząc dwutlenek węgla (CO2). (uwaga: to nie jest numeracja IUPAC, tylko numeracja ułatwiająca dyskusję)
W rearanżacji Curtiusa, azydek acylowy jest ogrzewany i powstaje izocyjanian. W Curtius, izocyjanian może być izolowany, ale zwykle jest dalej przekształcany w inne gatunki, takie jak karbaminian, mocznik, lub (poprzez dekarboksylację, jak w Hofmann) do aminy (więcej o tych poniżej).
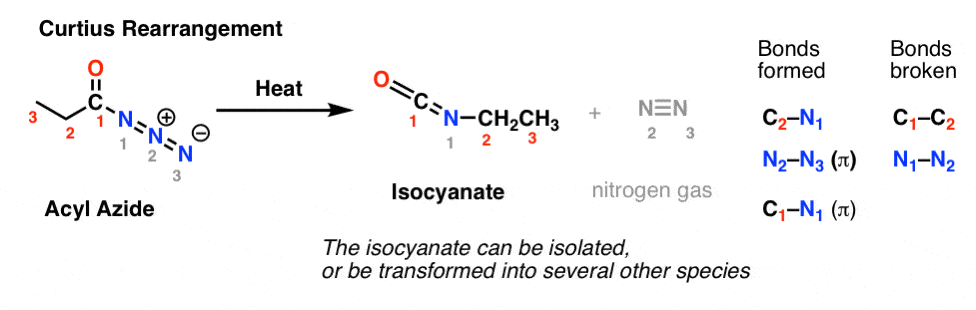
Kluczowym spostrzeżeniem w obu przypadkach jest to, że wiązanie C1-C2 zostało przerwane i utworzyło się nowe wiązanie C2-N.
Pytanie brzmi JAK?
Mechanizm Rearanżacji Hofmanna i Curtiusa, Część 1: Ustawianie Rearanżacji
Istnieją cztery ważne części mechanizmu rearanżacji Curtiusa i Hofmanna, i przejdziemy przez nie wszystkie.
- Preludium (proste)
- Kluczowy krok migracji (podchwytliwy, ale mniej podchwytliwy, jeśli zdasz sobie sprawę, że widziałeś jego wariant w Org 1!)
- Utworzenie izocyjanianu (proste)
4. Epilog: Przemiany izocyjanianu
Część 1: Preludium
- Przeprowadzenie Hofmanna zachodzi z amidem.
- Rozkład Curtiusa zachodzi z azydkiem acylowym.
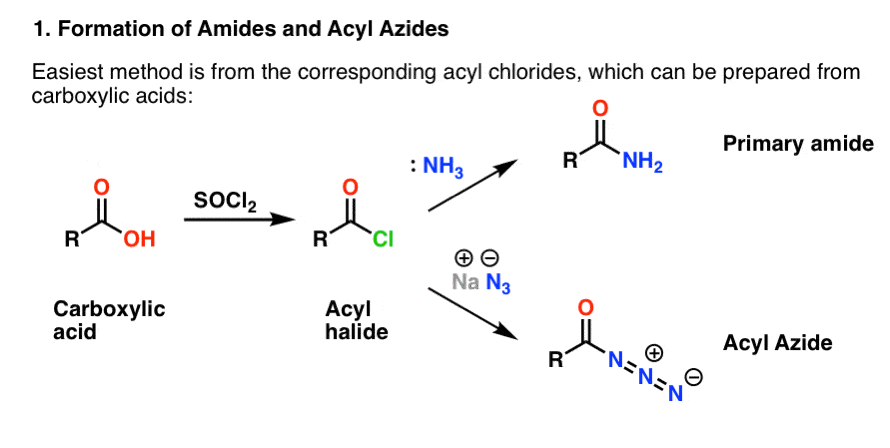
Oba są wygodnie przygotowane z halogenków acylowych poprzez reakcję addycji-eliminacji. Jeśli teraz zajmujesz się aminami, to reakcje karbonylowe są prawdopodobnie dobrze znane. Halogenki acylowe mogą być przygotowane z kwasów karboksylowych poprzez użycie odczynnika takiego jak chlorek tionylu (SOCl2) lub pięciochlorek fosforu (PCl5).
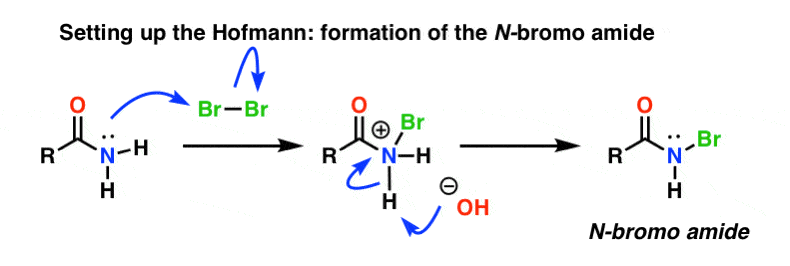
Ustawianie Hofmanna
W rearanżacji Hofmanna, amid jest traktowany bromem (Br2) i zasadą taką jak NaOH. Powoduje to rozerwanie N-H i utworzenie N-Br, w wyniku czego na azocie powstaje dobra grupa opuszczająca. Nazywamy to „N-bromo amidem”.
Curtius nie wymaga „ustawiania”, ponieważ azydek acylowy ma już wbudowaną wspaniałą grupę opuszczającą: N2. Dlatego właśnie organiczne azydki powinny być traktowane ostrożnie, ponieważ szorstka obróbka może prowadzić do eksplozji.
3. Kluczowy etap rearanżacji w reakcji Hofmanna i Curtiusa
Teraz przechodzimy do rzeczy.
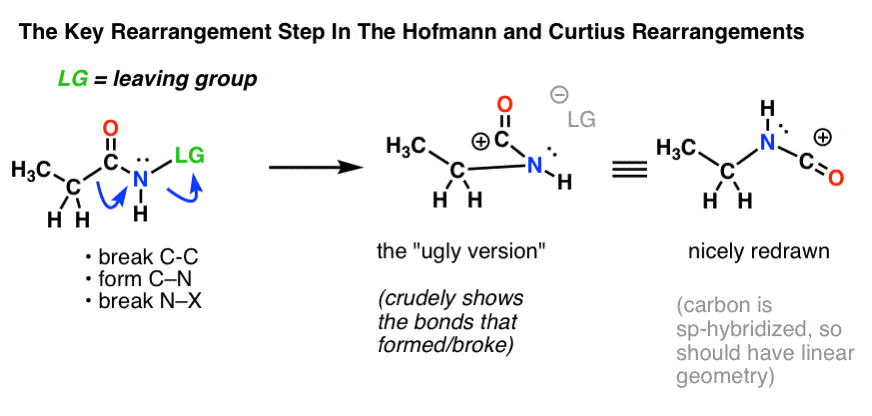
Kluczowym krokiem w rearanżacji Hofmanna i Curtiusa jest migracja atomu węgla w celu przemieszczenia grupy opuszczającej na sąsiednim azocie.
Wymaga to narysowania dwóch zakrzywionych strzałek, które są pokazane w strukturze po lewej stronie (poniżej).
- W pierwszej zakrzywionej strzałce, wiązanie C-C pęka i tworzy się nowe wiązanie C-N.
- W drugiej zakrzywionej strzałce, pęka wiązanie N-LG (grupa opuszczająca).
Jednakże, nie zawsze jest łatwo przejść bezpośrednio od struktury po lewej do struktury po prawej (która jest narysowana ładnie i schludnie! ).
Niezliczone punkty są niepotrzebnie tracone na egzaminach każdego roku przez studentów, którzy dostają zakrzywione strzałki w prawo, ale kończą rysując złą strukturę! Dlatego zachęcam studentów do narysowania najpierw „brzydkiej wersji”, która wygląda jak gówno, ale przynajmniej ma wszystkie wiązania we właściwym miejscu. Zawsze jest czas na przerysowanie jej i nadanie jej ładnego wyglądu później.
Na początku ta rearanżacja prawdopodobnie wygląda… dziwnie. Ale w rzeczywistości jest to reakcja, którą widziałeś już wcześniej! (ale w ukrytej formie).
Ktoś pamięta mechanizm etapu „utleniania” w reakcji hydroboracja-utlenianie?
To w zasadzie to samo!
Tutaj jest odświeżenie:
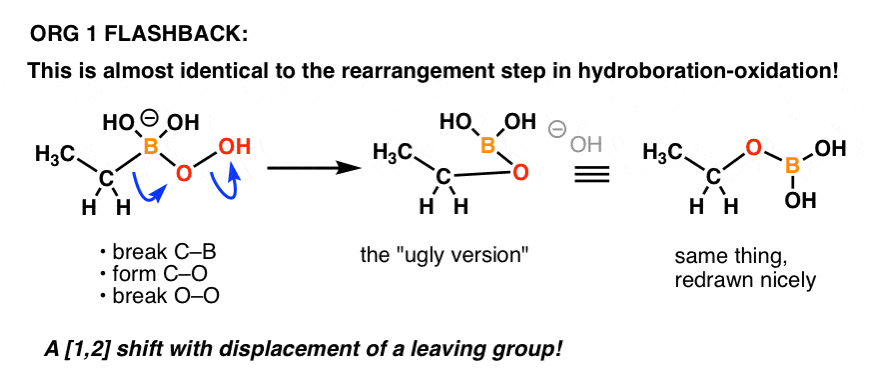
Just another example of how things you learn in an earlier part of organic chemistry can come back in a later part of the course!
Odwiedźmy konkretny etap rearanżacji w rearanżacjach Hofmanna i Curtiusa na konkretnych przykładach.
Oto kluczowy etap w rearanżacji Hofmanna, gdzie ogrzewanie powoduje rozerwanie C-C, utworzenie C-N i rozerwanie N-Br.
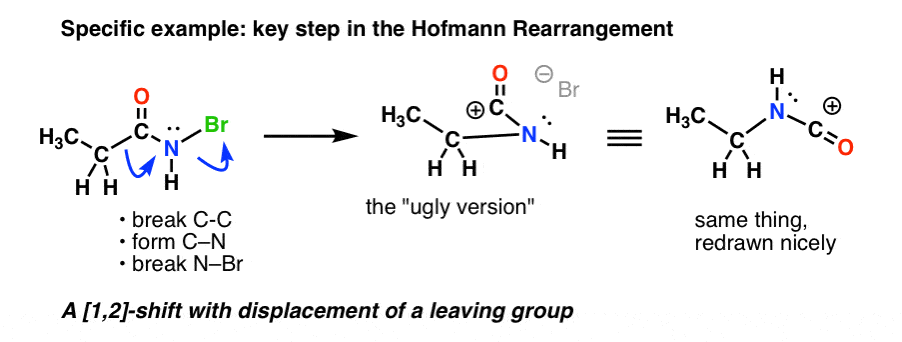
Jeśli podążasz za wszystkimi strzałkami, powinieneś skończyć z dziwnie wyglądającym karbokationem (powyżej po prawej), którym zajmiemy się za chwilę.
W reakcji Curtiusa, ogrzewanie azydku acylu powoduje rearanżację. Grupą opuszczającą jest azot (N2).
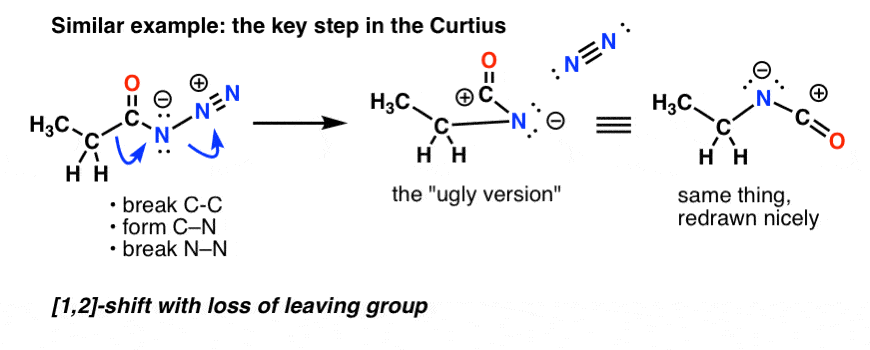
(Subtelną różnicą pomiędzy Curtiusem a Hofmannem jest to, że w Curtiusie nie ma wodoru przyłączonego do N, więc w końcu mamy ujemny ładunek na azocie w przereagowanych gatunkach.)
Powstawanie izocyjanianu
Kolejnym krokiem jest przejście od naszych przereagowanych gatunków do izocyjanianu. Dla kogoś przyzwyczajonego do rysowania form rezonansowych, nie powinno to być zbyt trudne.
(Jak omówimy poniżej, badania wykazały, że tworzenie izocyjanianu zachodzi w tym samym czasie co migracja. Ale dla naszych celów dydaktycznych, myślę, że pomaga traktowanie tego etapu w oderwaniu od innych. Możemy to wszystko połączyć za chwilę).
Jak być może pamiętacie z poprzedniej części Org 1, forma rezonansowa z pełnymi oktetami jest lepsza od tej bez nich (szybki przegląd). Nasz dziwnie wyglądający produkt z rearanżacji ma karbokację przylegającą do azotu zawierającego samotną parę. Tak więc pierwszym krokiem jest narysowanie tworzenia się nowego wiązania C-N pi. Jest to w zasadzie tylko forma rezonansowa.
Rozkład Hofmanna zachodzi w obecności zasady. Tak więc po narysowaniu formy rezonansowej, następnym krokiem jest deprotonacja wiązania N-H dająca neutralny izocyjanian.
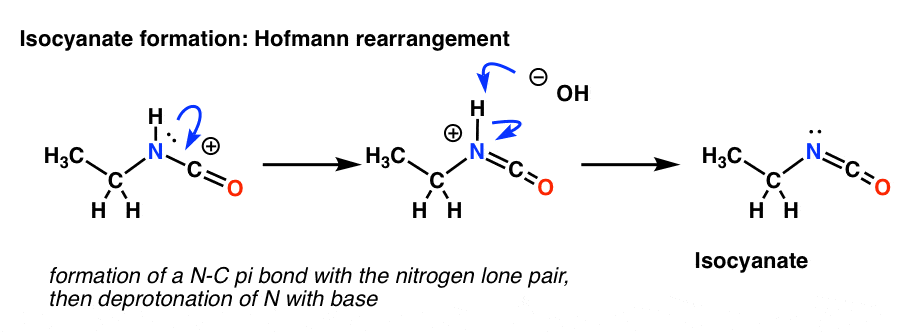
Na azocie w Curtiusie nie ma wodoru. Tak więc tworzenie izocyjanianu odbywa się jedynie poprzez oddanie samotnej pary z azotu do karbokationu. Możesz po prostu spojrzeć na to jak na rysunek formy rezonansowej.
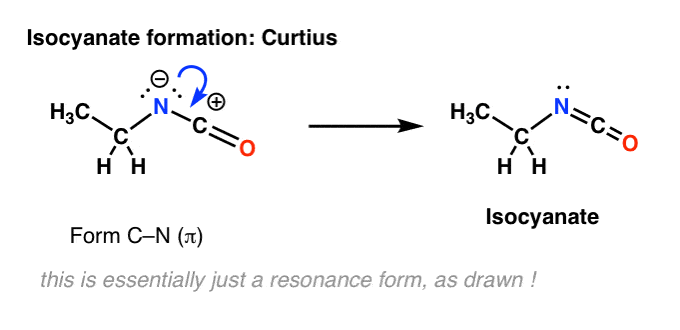
Putting The Steps Together
Badania nad mechanizmem rearanżacji Hofmanna i Curtiusa pozwoliły ustalić, że te dwa etapy nie zachodzą sekwencyjnie; one faktycznie zachodzą w tym samym czasie! (skąd to wiemy? patrz uwaga 1 )
To znaczy, migracja zachodzi w tym samym czasie, co tworzenie izocyjanianu.
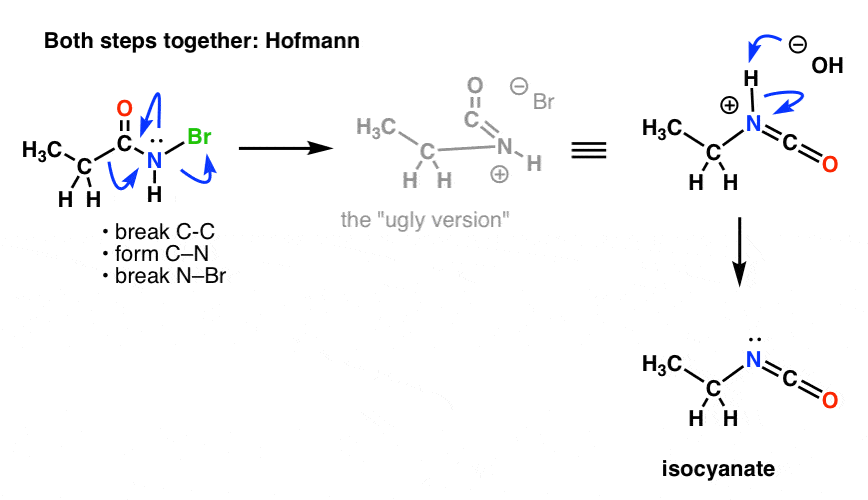
Musimy przerysować mechanizmy Hofmanna i Curtiusa, aby to odzwierciedlić, włączając oba kroki.
Tutaj Hofmann (zauważ, że zdarzenie deprotonacji jest w rzeczywistości oddzielne).
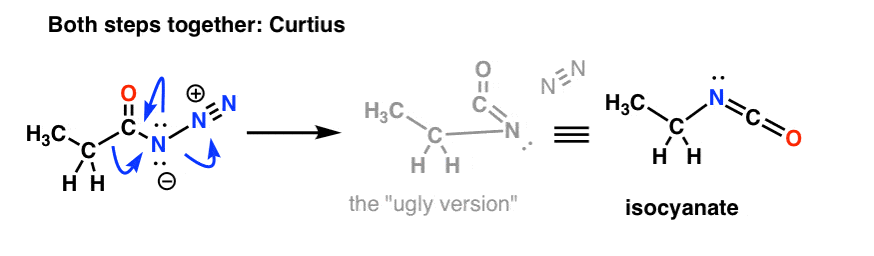
I Curtius:
The Fate Of The Isocyanate
Obaj metody Hofmanna i Curtiusa prowadzą do powstania izocyjanianu. Prawdopodobnie nie zetknąłeś się wcześniej z izocyjanianami. Na pierwszy rzut oka, są to dość dziwnie wyglądające gatunki, ale ich chemia nie różni się aż tak bardzo od chemii innych gatunków karbonylowych, takich jak estry, amidy i halogenki acylowe.
Struktura izocyjanianu bardzo przypomina strukturę dwutlenku węgla, CO2. Węgiel jest pi-bonded do dwóch silnie elektronegatywnych atomów. Dzięki temu węgiel jest doskonałym elektropolem.
Dodając różne nukleofile, izocyjaniany mogą być przekształcane w inne użyteczne gatunki.
– Dodanie alkoholu powoduje powstanie karbaminianu
– Dodanie aminy powoduje powstanie mocznika
– Dodanie wody powoduje powstanie kwasu karbaminowego, który jest niestabilny. Kwasy karbaminowe szybko tracą dwutlenek węgla, dając aminę.
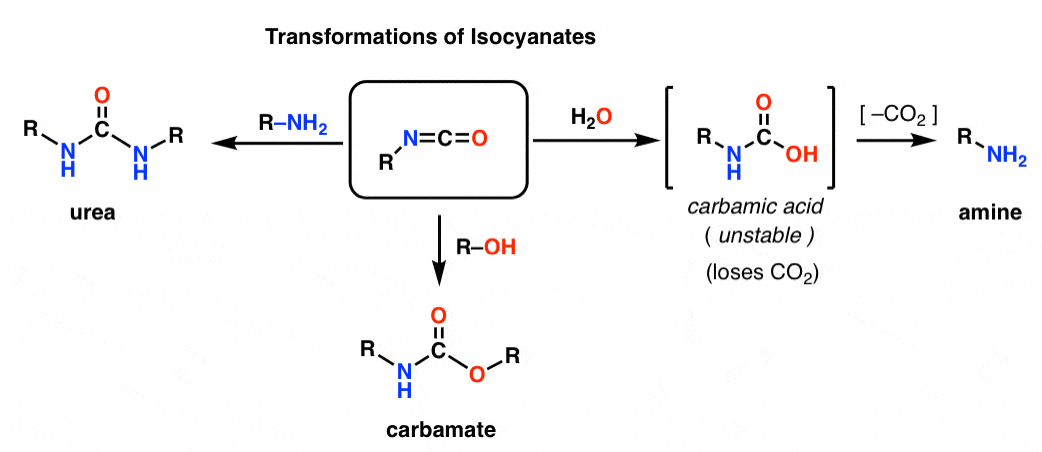
W szczególności, ścieżka dekarboksylacji prezentuje sprytny sposób wytwarzania amin. Poznaliśmy mnóstwo sposobów wytwarzania kwasów karboksylowych, ale nie zbyt wiele sposobów wytwarzania amin (poza substytucją nukleofilową i aminowaniem redukcyjnym). Hofmann jest dobrą sztuczką, którą można mieć w tylnej kieszeni w sytuacjach, gdy żadna z tych sytuacji nie ma zastosowania – jak na przykład tworzenie podstawionych anilin.
Mechanizmy? OK, w porządku. Zobacz temat bonusowy 1.
Podsumowanie: The Hofmann and Curtius Rearrangements
Mechanizm tych rearanżacji jest podstępny na pierwszy rzut oka, ale staje się znacznie łatwiejszy, gdy zdasz sobie sprawę, że widziałeś już wcześniej wariant reakcji migracji (tj.Gorąco polecam narysowanie najpierw brzydkiej wersji, ponieważ pomoże Ci to skupić się na zobaczeniu wiązań, które się tworzą i rozpadają, zanim spróbujesz przerysować ją do bardziej estetycznej struktury. Dotyczy to również rearanżacji Beckmanna i Wolffa, które mają podobny krok.(patrz poniżej)
Notatki
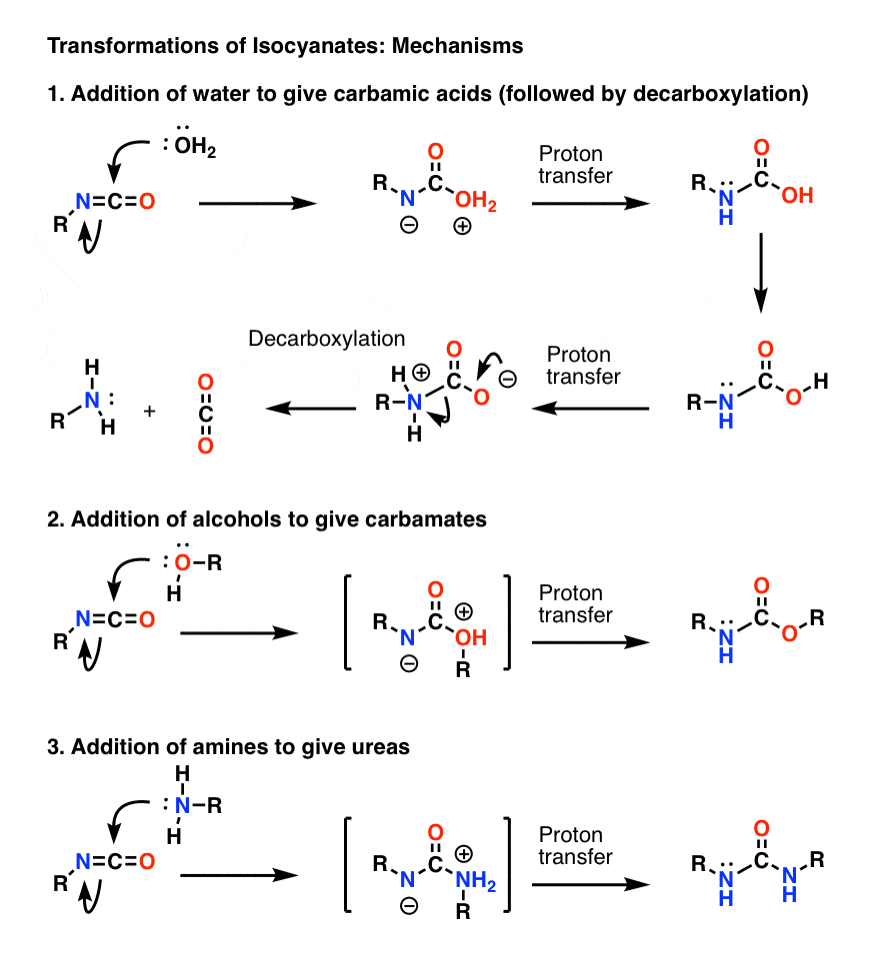
Temat dodatkowy 1: Izocyjaniany
Najważniejszym mechanizmem izocyjanianów jest addycja elektrofilowa (tj. dodanie nukleofila do centralnego, elektrofilowego węgla). W poniższym mechanizmie pokazałem nukleofil dodający się do węgla tak, aby utworzyć anion na azocie, chociaż prawdopodobnie nie jest to najlepsza forma rezonansowa (tlen jest lepszy w stabilizacji ładunku ujemnego niż azot). W wyniku przeniesienia protonu z tlenu na azot powstaje gatunek obojętny. (Użyłem tutaj Magic Wand of Proton Transfer, ponieważ jest szybszy).
Zauważ, że krok dekarboksylacji w 1) nie musi być poprzedzony deportacją tlenu, chociaż zdecydowanie musi zachodzić w taki sposób, że azot jest protonowany podczas tego kroku (nie chcesz tworzyć silnie zasadowego jonu amidowego, na przykład).
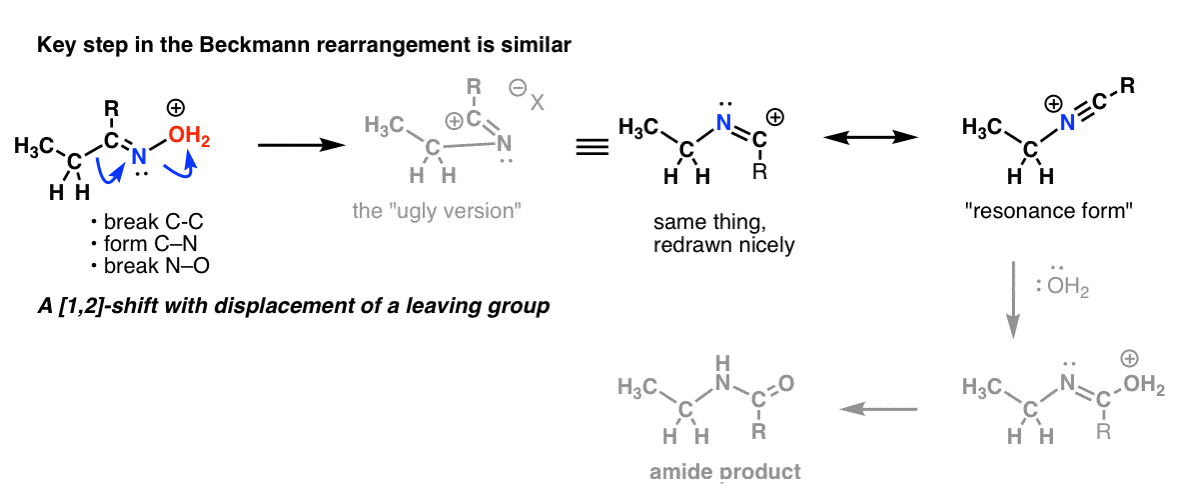
Przedmiot dodatkowy 2: rearanżacje Beckmanna, Wolffa i inne mają podobny krok
Ale czekaj, to nie wszystko!
W rearanżacji Beckmanna występuje przesunięcie 1,2 z utratą grupy opuszczającej. Kluczowy krok jest zasadniczo taki sam, jaki widzieliśmy w reakcji Hofmanna i Curtiusa.
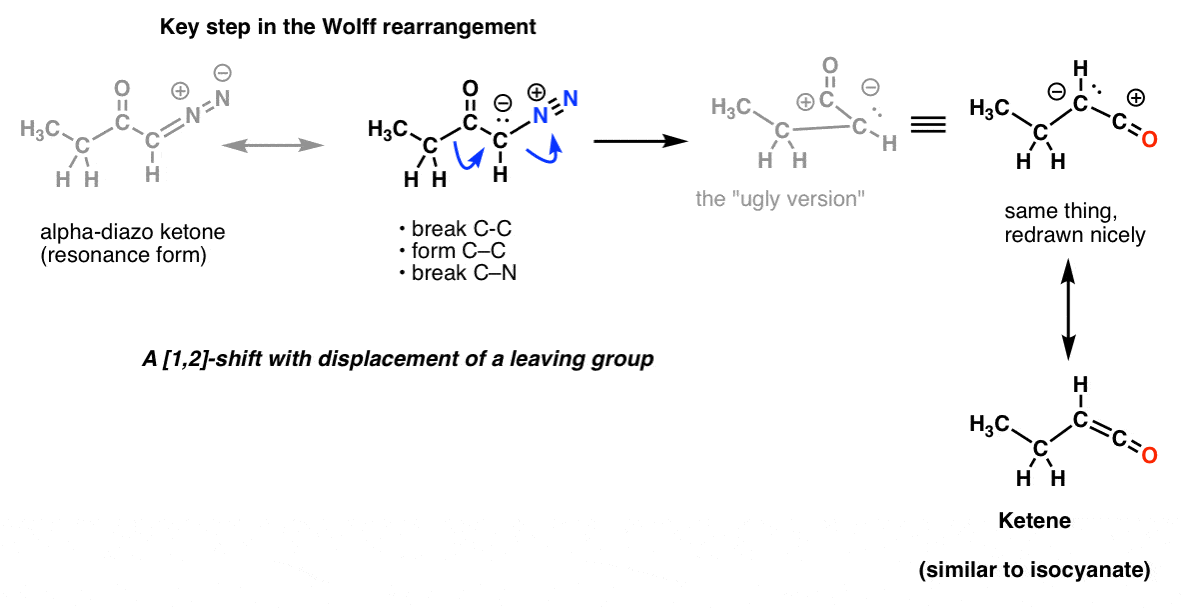
A w rearanżacji Wolffa, która również jest powszechnie omawiana, możesz rozpoznać ten sam kluczowy krok.
A to nie wszystko! Istnieje reakcja zwana rearanżacją Schmidta, która jest podobna do reakcji Curtiusa, ale zachodzi po dodaniu HN3 do chlorku acylu (lub kwasu karboksylowego). Jest też inna reakcja, zwana rearanżacją Lossena, która zachodzi z kwasami hydroksyamowymi. Nie ma nagród za odgadnięcie kluczowego kroku w tych dwóch procesach. Nie wspomnieliśmy nawet o reakcji Baeyera-Villigera, w której nie występuje azot, ale jest to proces tego samego typu.
Kiedy wiele księżyców temu uczyłem się etapu utleniania hydroboracji w Org 1, z pewnością nie spodziewałem się, że zobaczę ten sam schemat reakcji powtarzający się w tak wielu różnych postaciach.
Podsumowując, istnieje wiele reakcji, które noszą różne nazwy, a które przebiegają w tym samym mechanistycznym procesie. To podkreśla znaczenie nauki kluczowych wzorców w chemii organicznej, ponieważ one na pewno często się powtarzają.
Endnote. Concerted, not separate?
Gdyby Curtius był stopniowy, utrata azotu prowadziłaby do nitrenu. Nitreny ulegają wielu interesującym reakcjom, takim jak wprowadzanie do wiązań C-H (!). Można więc zaprojektować eksperyment, aby to sprawdzić: gdyby spróbować następującej rearanżacji Curtiusa, można by szukać dowodów na tworzenie się pięcioczłonowego pierścienia.
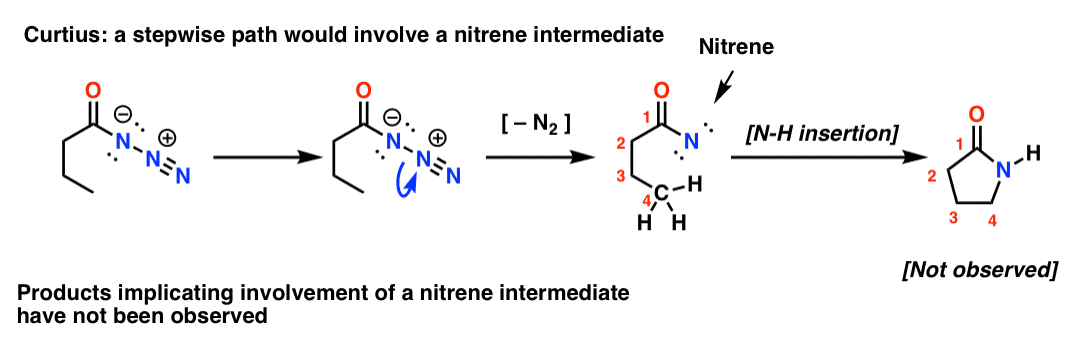
Brak takich produktów, wraz z innymi dowodami, wskazuje na uzgodniony mechanizm.
(Advanced) References and Further Reading
- Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide
W. Hofmann
Chem. Ber. 1881, 14, 2725-2736
DOI: 10.1002/cber.188101402242
Oryginalna praca A. W. Hofmanna (który był bardzo produktywnym chemikiem i jego nazwisko przypisuje się wielu innym transformacjom) o degradacji amidów do amin pierwszorzędowych. - A Mild and Efficient Modified Hofmann Rearrangement
Xicai Huang, Mehran Seid, and Jeffrey W. Keillor
The Journal of Organic Chemistry 1997, 62 (21), 7495-7496
DOI:10.1021/jo9708553
Jest to zmodyfikowana rearanżacja Hofmanna przeprowadzona w metanolu – w tym przypadku pośredni kwas karbaminowy może reagować z rozpuszczalnikiem metanolowym dając karbaminiany metylu z dobrą wydajnością. - FORMOWANIE KARBAMATÓW METYLU POPRZEZ ZMODYFIKOWANĄ REAKCJĘ HOFMANNA: METHYL N-(p-METHOXYPHENYL)CARBAMATE
Jeffrey W. Keillor and Xicai Huang
Org. Synth. 2002, 78, 234
DOI: 10.15227/orgsyn.078.0234
Bezpieczna i niezależnie przetestowana procedura dla zmodyfikowanej rearanżacji Hofmanna w ref #2. - Reakcja Hofmanna
Wallis, Everett L.; Lane, John F.
Org. React. 1946, 3, 267-306
DOI: 10.1002/0471264180.or003.07
Stary, ale wyczerpujący (jak na swoje czasy) przegląd reakcji Hofmanna (reakcja amidu z aminą, nie mylić z innymi jego reakcjami). - Notes – A Re-examination of the Limitations of the Hofmann Reaction
Ernest Magnien and Richard Baltzly
The Journal of Organic Chemistry 1958, 23 (12), 2029-2032
DOI:10.1021/jo01106a630
Jest to interesująca praca, w której autorzy podjęli próbę rozszerzenia zakresu rearanżacji Hofmanna poza to, co zostało opisane w oryginalnej pracy, poprzez staranne dostosowanie warunków reakcji. - 20. Hydrazide und Azide organischer Säuren
Curtius, T. I. Abhandlung.
Journal Für Praktische Chemie, 50(1), 275-294. (1894).
DOI:1002/prac.18940500125 - Ueber Stickstoffwasserstoffsäure (Azoimid) N3H.
Curtius, T.
Berichte Der Deutschen Chemischen Gesellschaft, 23(2), 3023-3033.(1890).
DOI:1002/cber.189002302232
Pierwsze prace Theodore’a Curtiusa opisujące reaktywność acylowych hierazydów i azydków. - The Curtius Reaction
Smith, P. A. S.
Org. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Stary, ale wyczerpujący przegląd reakcji Curtiusa, który obejmuje historię odkrycia tej rearanżacji, zakres substratów, ograniczenia, porównanie z innymi podobnymi reakcjami oraz procedury eksperymentalne. - IZOOCJANAT UNDECYLA
F. H. Allen and Alan Bell
Org. Synth. 1944, 24, 94
DOI: 10.15227/orgsyn.024.0094
Stara, ale powtarzalna i sprawdzona procedura syntezy izocyjanianów poprzez Curtius Rearrangement. - An Expedient Protecting-Group-Free Total Synthesis of (±)-Dievodiamine
William P. Unsworth, Christiana Kitsiou, and Richard J. K. Taylor
Organic Letters 2013 15 (13), 3302-3305
DOI:1021/ol4013469
Pierwszy krok w tej całkowitej syntezie wykorzystuje rearanżację Curtiusa do przeprowadzenia wewnątrzcząsteczkowej cyklizacji kwasu karboksylowego o podstawieniu indolowym. - Metody i reakcje syntetyczne. 121. Katalizowane jodkiem cynku otrzymywanie azydków aroilowych z chlorków aroilowych i azydku trimethylsilylowego
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, and George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051
Wygodna procedura otrzymywania aromatycznych aryloazydów od laureata Nagrody Nobla prof. Mogą one być następnie wykorzystane do rearanżacji Curtiusa.
.