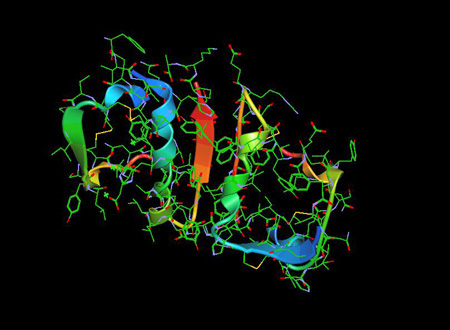
Molekuła Insuliny 1ZNI PDB jest hormonem trzustki, który odgrywa istotną rolę w regulacji stężenia glukozy we krwi, jak również metabolizmu lipidów i węglowodanów….
For 3-D Structure of the Insulin Molecule using Jsmol Click
Overview
Insulina jest hormonem polipeptydowym produkowanym przez komórki β wysepek trzustkowych, który jest przede wszystkim odpowiedzialny za regulację stężenia glukozy we krwi oraz magazynowanie węglowodanów i lipidów. Cukrzyca typu 1 jest spowodowana niedostatecznym wytwarzaniem insuliny w wyniku zniszczenia i utraty komórek β wysepek trzustkowych produkujących insulinę. Cukrzyca typu 2 jest spowodowana względną insulinoopornością. Jest ona uważana za główny hormon anaboliczny organizmu. (1)
Struktura białka
Insulina została uznana za polipeptyd w 1928 roku, a jej sekwencja aminokwasowa została zidentyfikowana w 1952 roku. Jest to w rzeczywistości dwupeptyd, zawierający odpowiednio łańcuchy A i B, połączone mostkami dwusiarczkowymi, zawierający 51 aminokwasów, o masie cząsteczkowej 5802. Jego punkt izoelektryczny wynosi pH 5,5,5. Łańcuch A składa się z 21 aminokwasów, a łańcuch B z 30 aminokwasów. Łańcuch A ma N-końcową helisę połączoną z antyrównoległą C-końcową helisą; łańcuch B ma centralny segment helikalny. Oba łańcuchy są połączone 2 wiązaniami disiarczkowymi, które łączą N- i C-końcowe helisy łańcucha A z centralną helisą łańcucha B. W pro-insulinie, peptyd łączący łączy N-końcówkę łańcucha A z C-końcówką łańcucha B.
W obrębie kręgowców sekwencja aminokwasowa insuliny jest silnie konserwowana. Insulina bydlęca różni się od ludzkiej tylko trzema resztami aminokwasowymi, a insulina świńska jedną. Nawet insulina pochodząca z niektórych gatunków ryb jest na tyle podobna do ludzkiej, że jest u ludzi skuteczna klinicznie. Insulina u niektórych bezkręgowców jest dość podobna w sekwencji do insuliny ludzkiej i ma podobne działanie fizjologiczne. Silna homologia obserwowana w sekwencji insuliny różnych gatunków sugeruje, że była ona konserwowana przez znaczną część historii ewolucji zwierząt. Peptyd C proinsuliny różni się jednak znacznie bardziej między gatunkami; jest to również hormon, ale drugorzędowy.
Insulina jest produkowana i przechowywana w organizmie jako heksamer (jednostka sześciu cząsteczek insuliny), podczas gdy formą aktywną jest monomer. Heksamer jest nieaktywną formą o długoterminowej stabilności, która służy jako sposób na utrzymanie wysoce reaktywnej insuliny chronionej, a jednocześnie łatwo dostępnej. Konwersja heksamer-monomer jest jednym z centralnych aspektów preparatów insuliny do wstrzykiwań. Heksamer jest znacznie bardziej stabilny niż monomer, co jest pożądane ze względów praktycznych; jednak monomer jest lekiem reagującym znacznie szybciej, ponieważ szybkość dyfuzji jest odwrotnie proporcjonalna do wielkości cząsteczki.
Mechanizmy wydzielania insuliny
Insulina jest wytwarzana w trzustce i ciele Brockmanna (u niektórych ryb) i uwalniana po wykryciu któregokolwiek z kilku bodźców. Bodźce te obejmują spożyte białko i glukozę we krwi produkowaną z trawionego pokarmu. Węglowodany mogą być polimerami cukrów prostych lub samymi cukrami prostymi. Jeśli węglowodany zawierają glukozę, to zostanie ona wchłonięta do krwiobiegu i poziom glukozy we krwi zacznie się podnosić. W komórkach docelowych insulina inicjuje transdukcję sygnału, którego efektem jest zwiększenie wychwytu i magazynowania glukozy. W końcu insulina ulega degradacji, kończąc odpowiedź.
U ssaków insulina jest syntetyzowana w trzustce w obrębie komórek beta. Milion do trzech milionów wysepek trzustkowych tworzy część endokrynną trzustki, która jest przede wszystkim gruczołem egzokrynnym. Część endokrynna stanowi jedynie 2% całkowitej masy trzustki. W obrębie wysepek trzustkowych komórki beta stanowią 65-80% wszystkich komórek.
Uwalnianie insuliny
Regulacja stężenia glukozy we krwi Komórki beta w wysepkach Langerhansa uwalniają insulinę w dwóch fazach. Pierwsza faza uwalniania jest gwałtownie uruchamiana w odpowiedzi na zwiększone stężenie glukozy we krwi i trwa około 10 minut. Druga faza polega na trwałym, powolnym uwalnianiu insuliny z nowo powstałych pęcherzyków, które jest wyzwalane niezależnie od poziomu cukru i osiąga szczyt po 2 do 3 godzinach. Zmniejszone uwalnianie insuliny w pierwszej fazie może być najwcześniej wykrywanym defektem komórek beta zapowiadającym wystąpienie cukrzycy typu 2. Uwalnianie pierwszej fazy i wrażliwość na insulinę są niezależnymi czynnikami predykcyjnymi cukrzycy.
Poziom insuliny we krwi
Poziom insuliny we krwi można mierzyć w jednostkach międzynarodowych, takich jak µIU/mL lub w stężeniu molowym, takim jak pmol/L, gdzie 1 µIU/mL równa się 6,945 pmol/L. Typowy poziom we krwi pomiędzy posiłkami wynosi 8-11 μIU/mL (57-79 pmol/L).
Mechanizm działania -Przekazywanie sygnałów przez insulinę
Przekazywanie sygnałów Działanie insuliny jest inicjowane przez jej wiązanie się z receptorem obecnym w błonie komórkowej. Cząsteczka receptora zawiera podjednostki α- i β. Dwie cząsteczki łączą się, tworząc tzw. homodimer. Insulina wiąże się z podjednostkami α homodimeru, które skierowane są w stronę zewnątrzkomórkową komórki. Podjednostki β mają aktywność enzymatyczną kinazy tyrozynowej, która jest wyzwalana przez wiązanie insuliny. Aktywność ta prowokuje autofosforylację podjednostek β, a następnie fosforylację białek wewnątrz komórki zwanych substratami receptora insulinowego (IRS). Fosforylacja IRS uruchamia kaskadę transdukcji sygnału, która prowadzi do aktywacji innych kinaz, a także czynników transkrypcyjnych pośredniczących w wewnątrzkomórkowym działaniu insuliny.
Działanie insuliny o działaniu fizjologicznym
Działanie insuliny na poziomie globalnego metabolizmu człowieka obejmuje: Zwiększenie komórkowego poboru niektórych substancji, przede wszystkim glukozy w mięśniach i tkance tłuszczowej (około dwie trzecie komórek ciała) Zwiększenie replikacji DNA i syntezy białek poprzez kontrolę poboru aminokwasów Modyfikacja aktywności licznych enzymów.
Regulator metabolizmu endokannabinoidów. Insulina jest głównym regulatorem metabolizmu endokannabinoidów (EC), a leczenie insuliną wykazało zmniejszenie wewnątrzkomórkowych EC, 2-arachidonylglycerolu (2-AG) i anandamidu (AEA), co odpowiada wrażliwym na insulinę zmianom ekspresji enzymów metabolizmu EC. W adipocytach insulinoopornych ekspresja enzymów indukowanych insuliną jest zaburzona w sposób zgodny z podwyższoną syntezą EC i obniżoną degradacją EC. Wyniki sugerują, że insulinooporne adipocyty nie regulują metabolizmu EC i zmniejszają wewnątrzkomórkowy poziom EC w odpowiedzi na stymulację insuliną, przez co otyłe osoby insulinooporne wykazują zwiększone stężenie EC. Ta dysregulacja przyczynia się do nadmiernego gromadzenia trzewnej tkanki tłuszczowej i zmniejszonego uwalniania adiponektyny z brzusznej tkanki tłuszczowej, a następnie do wystąpienia kilku czynników ryzyka kardiometabolicznego, które są związane z otyłością i cukrzycą typu 2.
1- Voet D, Voet JG (2011). Biochemia (4th ed.). New York: Wiley.
2-Gisela Wilcox (2005) Insulin and Insulin Resistance, Clin Biochem Rev. 2005 May; 26(2): 19-39.
3- Rhoades RA, Bell DR (2009). Fizjologia medyczna: zasady dla medycyny klinicznej (3rd ed.). Philadelphia: Lippincott Williams & Wilkins. pp. 644-47.
4-Gerich JE (February 2002). „Is reduced first-phase insulin release the earliest detectable abnormality in individuals destined to develop type 2 diabetes?”. Diabetes. 51 (Suppl 1): S117–21. doi:10.2337/diabetes.51.2007.s117. PMID 11815469.
5- Lorenzo C, Wagenknecht LE, Rewers MJ, Karter AJ, Bergman RN, Hanley AJ, Haffner SM (wrzesień 2010). „Wskaźnik dyspozycyjności, skuteczność glukozy i konwersja do cukrzycy typu 2: badanie Insulin Resistance Atherosclerosis Study (IRAS)”. Diabetes
6- A Dictionary of Units of Measurement Archived 2013-10-28 at the Wayback Machine. Przez Russ Rowlett, University of North Carolina w Chapel Hill. June 13, 2001
7- Iwase H, Kobayashi M, Nakajima M, Takatori T (styczeń 2001). „Stosunek insuliny do C-peptydu może być wykorzystany do postawienia sądowej diagnozy przedawkowania egzogennej insuliny”. Forensic Science International. 115 (1-2): 123-27. doi:10.1016/S0379-0738(00)00298-X. PMID 11056282.
8- Xiang Z (czerwiec 2006). „Advances in homology protein structure modeling” (Postępy w modelowaniu struktury białek homologicznych). Current Protein & Peptide Science. 7 (3): 217-27. doi:10.2174/138920306777452312. PMC 1839925. PMID 16787261.
9- Zagrovic B, Snow CD, Shirts MR, Pande VS (listopad 2002). „Simulation of folding of a small alpha-helical protein in atomistic detail using worldwide-distributed computing”. Journal of Molecular Biology. 323 (5): 927-37.
10-D’Eon TM, Pierce KA, Roix JJ, Tyler A, Chen H, Teixeira SR (maj 2008). „The role of adipocyte insulin resistance in the pathogenesis of obesity-related elevations in endocannabinoids”. Diabetes. 57 (5): 1262-68.
11- Di Marzo V (sierpień 2008). „Układ endokannabinoidowy w otyłości i cukrzycy typu 2”. Diabetologia. 51 (8): 1356-67. doi:10.1007/s00125-008-1048-2. PMID 18563385.