Nazwa ogólna: fluocinonide
Postać dawkowania: Żel
Medycznie przejrzane przez Drugs.com. Ostatnio aktualizowany 22 czerwca 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Interactions
- More
Rx Only
Marka Lidex została wycofana z obrotu w U.S. Jeżeli wersje generyczne tego produktu zostały zatwierdzone przez FDA, mogą być dostępne ich odpowiedniki generyczne.
- Lidex Opis
- Lidex – Farmakologia kliniczna
- Farmakokinetyka
- Wskazania i stosowanie leku Lidex
- Przeciwwskazania
- Środki ostrożności
- Ogólne
- Informacje dla pacjenta
- Badania laboratoryjne
- Carcinogenesis, Mutagenesis, and Impairment of Fertility
- Kategoria Ciąża C
- Matki karmiące
- Stosowanie u dzieci
- Działania niepożądane
- Przedawkowanie
- Lidex dawkowanie i podawanie
- Jak jest dostarczany lek Lidex
- Często zadawane pytania
- Więcej o Lidex (fluocinonide topical)
- Zasoby dla konsumentów
- Zasoby profesjonalne
- Przewodniki dotyczące leczenia
Lidex Opis
Lidex® (fluocinonide) żel 0,05% jest przeznaczony do podawania miejscowego. Składnikiem czynnym jest kortykosteroid fluocinonid, który jest 21-octanowym estrem acetonidu fluocinolonu i ma nazwę chemiczną pregna-1,4-dien-3,20-dion,21-(acetyloksy)-6,9-difluoro-11-hydroksy-16,17–,(6α,11β,16α)-. Ma następującą strukturę chemiczną:
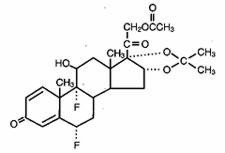
Lidex Gel zawiera fluocinonid 0,5 mg/g w specjalnie opracowanej bazie żelowej składającej się z karbomeru 940, disodu edetynianu, popylu galusanu, glikolu propylenowego, sodu wodorotlenku i (lub) kwasu solnego (w celu dostosowania pH) oraz wody (oczyszczonej). Ten przejrzysty, bezbarwny, tiksotropowy nośnik jest beztłuszczowy, nieplamiący i całkowicie mieszalny z wodą.
W tej formulacji składnik aktywny jest całkowicie w roztworze.
Lidex – Farmakologia kliniczna
Topowe kortykosteroidy wykazują wspólne działanie przeciwzapalne, przeciwświądowe i zwężające naczynia krwionośne.
Mechanizm działania przeciwzapalnego miejscowych kortykosteroidów jest niejasny. Do porównywania i przewidywania siły działania i (lub) skuteczności klinicznej miejscowo stosowanych kortykosteroidów stosuje się różne metody laboratoryjne, w tym oznaczenia działania obkurczającego naczynia krwionośne. Istnieją pewne dowody sugerujące, że istnieje rozpoznawalna korelacja pomiędzy siłą działania wazokonstrykcyjnego a skutecznością terapeutyczną u ludzi.
Farmakokinetyka
Zakres przezskórnego wchłaniania miejscowo stosowanych kortykosteroidów zależy od wielu czynników, w tym nośnika, integralności bariery naskórkowej i stosowania opatrunków okluzyjnych.
Kortykosteroidy miejscowe mogą być wchłaniane z normalnej, nieuszkodzonej skóry. Stan zapalny i (lub) inne procesy chorobowe w skórze zwiększają wchłanianie przezskórne. Opatrunki okluzyjne znacznie zwiększają przezskórne wchłanianie miejscowo stosowanych kortykosteroidów. W związku z tym opatrunki okluzyjne mogą stanowić cenny dodatek terapeutyczny w leczeniu opornych dermatoz (patrz: DAWKOWANIE I DAWKOWANIE).
Po wchłonięciu przez skórę, miejscowo stosowane kortykosteroidy są przetwarzane poprzez szlaki farmakokinetyczne podobne do kortykosteroidów podawanych ogólnoustrojowo. Kortykosteroidy są w różnym stopniu związane z białkami osocza. Kortykosteroidy są metabolizowane głównie w wątrobie, a następnie wydalane przez nerki. Niektóre z miejscowo stosowanych kortykosteroidów i ich metabolity są również wydalane do żółci.
Wskazania i stosowanie leku Lidex
Lidex żel jest wskazany do łagodzenia objawów zapalnych i świądu w dermatozach reagujących na kortykosteroidy.
Przeciwwskazania
Kortykosteroidy miejscowe są przeciwwskazane u tych pacjentów, u których w wywiadzie stwierdzono nadwrażliwość na którykolwiek składnik preparatu.
Środki ostrożności
Ogólne
Systemowe wchłanianie miejscowo stosowanych kortykosteroidów powodowało u niektórych pacjentów odwracalne zahamowanie czynności osi podwzgórze-przysadka-nadnercza (HPA), objawy zespołu Cushinga, hiperglikemię i glukozurię.
Warunki, które zwiększają wchłanianie ogólnoustrojowe obejmują stosowanie silniejszych steroidów, stosowanie na dużych powierzchniach, długotrwałe stosowanie oraz dodanie opatrunków okluzyjnych.
Z tego względu pacjenci otrzymujący duże dawki silnych steroidów miejscowych stosowanych na dużych powierzchniach lub pod opatrunkiem okluzyjnym powinni być okresowo oceniani pod kątem dowodów supresji osi HPA za pomocą testów stymulacji wolnego kortyzolu w moczu i ACTH. Jeśli zostanie stwierdzona supresja osi HPA, należy podjąć próbę wycofania leku, zmniejszenia częstości stosowania lub zastąpienia steroidem o mniejszej mocy.
Odzyskiwanie czynności osi HPA jest na ogół szybkie i całkowite po odstawieniu leku. Rzadko mogą wystąpić oznaki i objawy odstawienia steroidów, wymagające uzupełnienia kortykosteroidów podawanych ogólnoustrojowo.
Dzieci mogą wchłaniać proporcjonalnie większe ilości miejscowo stosowanych kortykosteroidów i w związku z tym mogą być bardziej podatne na toksyczność ogólnoustrojową (patrz punkt PRECAUTIONS – Stosowanie u dzieci). Jeśli wystąpi podrażnienie, należy przerwać stosowanie miejscowych kortykosteroidów i rozpocząć odpowiednie leczenie.
Tak jak w przypadku każdego miejscowego produktu kortykosteroidowego, długotrwałe stosowanie może powodować zanik skóry i tkanki podskórnej. W przypadku stosowania na obszarach międzygoleniowych, zgięciowych lub na twarzy, może to wystąpić nawet przy krótkotrwałym stosowaniu.
W przypadku wystąpienia zakażeń dermatologicznych, należy rozpocząć stosowanie odpowiedniego leku przeciwgrzybiczego lub przeciwbakteryjnego. Jeśli korzystna odpowiedź nie wystąpi natychmiast, należy przerwać stosowanie kortykosteroidu do czasu odpowiedniego opanowania zakażenia.
Informacje dla pacjenta
Pacjenci stosujący miejscowo kortykosteroidy powinni otrzymać następujące informacje i instrukcje:
- Ten lek należy stosować zgodnie z zaleceniami lekarza. Jest on przeznaczony wyłącznie do użytku zewnętrznego. Należy unikać kontaktu z oczami.
- Pacjentów należy poinformować, aby nie stosowali tego leku w innych zaburzeniach niż te, dla których został przepisany.
- Leczonego obszaru skóry nie należy bandażować ani w inny sposób przykrywać lub owijać w sposób powodujący okluzję, chyba że lekarz zaleci inaczej.
- Pacjenci powinni zgłaszać wszelkie objawy miejscowych działań niepożądanych, zwłaszcza pod opatrunkiem okluzyjnym.
- Rodziców pacjentów pediatrycznych należy poinformować, aby nie stosowali ciasno dopasowanych pieluch lub plastikowych majtek u dziecka leczonego w okolicy pieluszkowej, ponieważ te elementy odzieży mogą stanowić opatrunki okluzyjne.
Badania laboratoryjne
W ocenie supresji osi HPA pomocne mogą być następujące badania:
Badanie wolnego kortyzolu w moczu
Test stymulacji ACTH
Carcinogenesis, Mutagenesis, and Impairment of Fertility
Nie przeprowadzono długotrwałych badań na zwierzętach w celu oceny potencjału rakotwórczego lub wpływu na płodność miejscowo stosowanych kortykosteroidów.
Badania mające na celu określenie mutagenności prednizolonu i hydrokortyzonu wykazały wyniki negatywne.
Kategoria Ciąża C
Kortykosteroidy są ogólnie teratogenne u zwierząt laboratoryjnych, gdy są podawane ogólnoustrojowo w stosunkowo małych dawkach. Wykazano, że kortykosteroidy o silniejszym działaniu są teratogenne po zastosowaniu skórnym u zwierząt laboratoryjnych. Nie ma odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży dotyczących teratogennego działania kortykosteroidów stosowanych miejscowo. Dlatego kortykosteroidy stosowane miejscowo powinny być stosowane w okresie ciąży tylko wtedy, gdy potencjalne korzyści uzasadniają potencjalne ryzyko dla płodu. Leki tej klasy nie powinny być stosowane u pacjentek w ciąży, w dużych ilościach lub przez dłuższy czas.
Matki karmiące
Nie wiadomo, czy miejscowe podawanie kortykosteroidów może powodować wystarczające wchłanianie ogólnoustrojowe do wytworzenia wykrywalnych ilości w mleku matki. Kortykosteroidy podawane ogólnoustrojowo są wydzielane do mleka kobiecego w ilościach, które prawdopodobnie nie wywierają szkodliwego wpływu na niemowlę. Niemniej jednak, należy zachować ostrożność w przypadku podawania miejscowych kortykosteroidów kobietom karmiącym piersią.
Stosowanie u dzieci
Pacjenci pediatryczni mogą wykazywać większą podatność na indukowaną miejscowymi kortykosteroidami supresję osi HPA i zespół Cushinga niż pacjenci dojrzali, ze względu na większy stosunek powierzchni skóry do masy ciała.
Zgłaszano supresję osi podwzgórze-przysadka-nadnercza (HPA), zespół Cushinga i nadciśnienie wewnątrzczaszkowe u dzieci otrzymujących miejscowo kortykosteroidy. Objawy supresji nadnerczy u dzieci obejmują liniowe opóźnienie wzrostu, opóźniony przyrost masy ciała, małe stężenie kortyzolu w osoczu i brak odpowiedzi na stymulację ACTH. Objawy nadciśnienia wewnątrzczaszkowego obejmują wybrzuszenie ciemiączek, bóle głowy i obustronny obrzęk brodawek.
Podawanie dzieciom miejscowo stosowanych kortykosteroidów powinno być ograniczone do najmniejszej ilości zgodnej ze skutecznym schematem terapeutycznym. Przewlekła terapia kortykosteroidami może zaburzać wzrost i rozwój dzieci.
Działania niepożądane
Następujące miejscowe działania niepożądane są zgłaszane rzadko podczas stosowania miejscowych kortykosteroidów, ale mogą występować częściej podczas stosowania opatrunków okluzyjnych. Reakcje te są wymienione w przybliżonej, malejącej kolejności występowania:
| Pieczenie | Przednie zapalenie skóry |
| Śwędzenie | Allergiczne kontaktowe zapalenie skóry |
| Podrażnienie | Maceracja skóry |
| Suchość | Powtórne zakażenie |
| Zapalenie mieszków włosowych | Zanik skóry |
| Hypertrichosis | Striae |
| Acneiform eruptions | Miliaria |
| Hypopigmentation |
Przedawkowanie
Topowo stosowane kortykosteroidy mogą być wchłaniane w ilościach wystarczających do wywołania działania ogólnoustrojowego (patrz PRECAUTIONS).
Lidex dawkowanie i podawanie
Lidex żel stosuje się na ogół na zmienione chorobowo miejsca w postaci cienkiej warstwy od dwóch do czterech razy na dobę, w zależności od nasilenia dolegliwości.
Opatrunki okluzyjne mogą być stosowane w leczeniu łuszczycy lub stanów nawracających.
Jeśli rozwinie się zakażenie, należy przerwać stosowanie opatrunków okluzyjnych i rozpocząć odpowiednie leczenie przeciwbakteryjne.
Jak jest dostarczany lek Lidex
Lidex® (fluocinonid) żel 0.05% jest dostarczany w
15 g tubach – NDC 99207-507-13
30 g tubach – NDC 99207-507-14
60 g tubach – NDC 99207-507-17
Przechowywać w temperaturze pokojowej 15°-30°C (59°-86°F).
Produkowany dla:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
Kwiecień 2001
IN-5071/S
| Lidex fluocinonide gel |
|||||||||||||||||
|
|||||||||||||||||
|
|||||||||||||||||
|
|||||||||||||||||
|
|||||||||||||||||
Etykieciarz -. MEDICIS
Często zadawane pytania
- Czy stosuje się go przy wypadaniu włosów?
- Jaki jest zamiennik dla fluocinonidu w kremie?
- Czy fluocinonid jest kremem przeciwgrzybiczym?
- Jak długo należy stosować fluocinonid?
- Dlaczego fluocinonid w kremie jest dobry?
- Czy fluocinonid może być stosowany w leczeniu wysypki wywołanej trującym bluszczem?
- Czy jest to steryd?
- Czy jest to antybiotyk?
Więcej o Lidex (fluocinonide topical)
- Skutki uboczne
- W czasie ciąży lub karmienia piersią
- Informacje o dawkowaniu
- Interakcje lekowe
- 8 reviews
- Dostępność generyczna
- Klasa leków: steroidy miejscowe
Zasoby dla konsumentów
- Zaawansowana lektura
- Lidex Mild (Zaawansowana lektura)
- Lidex Regular (Zaawansowana lektura)
- Lidex Regular (Zaawansowana lektura)
.
Zasoby profesjonalne
- Informacja dotycząca stosowania
- Lidex roztwór do stosowania miejscowego (FDA)
- Lidex maść (FDA)
Inne marki Vanos, Lidex-E
Przewodniki dotyczące leczenia
- Atopikalne zapalenie skóry
- Wyprysk
- Zapalenie skóry
- Łuszczyca
Zrzeczenie się odpowiedzialności medycznej
.