Te zmiany konformacyjne również zbliżają reszty katalityczne w miejscu aktywnym do wiązań chemicznych w substracie, które zostaną zmienione w reakcji. Po związaniu substratu, jeden lub więcej mechanizmów katalizy obniża energię stanu przejściowego reakcji poprzez zapewnienie alternatywnej drogi chemicznej dla reakcji. Istnieje sześć możliwych mechanizmów katalizy „ponad barierą” oraz mechanizm „przez barierę”:
Bliskość i orientacjaEdit
Interakcje enzym-substrat wyrównują reaktywne grupy chemiczne i utrzymują je blisko siebie w optymalnej geometrii, co zwiększa szybkość reakcji. To zmniejsza entropię reagentów i w ten sposób sprawia, że reakcje addycji lub przeniesienia są mniej niekorzystne, ponieważ zmniejszenie ogólnej entropii, gdy dwa reagenty stają się jednym produktem. Jest to jednak efekt ogólny i można go zaobserwować w reakcjach bez addycji lub przeniesienia, gdzie występuje on z powodu wzrostu „efektywnego stężenia” reagentów. Można to zrozumieć, rozważając, w jaki sposób wzrost stężenia prowadzi do wzrostu szybkości reakcji: zasadniczo, gdy reagenty są bardziej stężone, częściej się zderzają, a więc częściej reagują. W katalizie enzymatycznej, wiązanie reagentów z enzymem ogranicza przestrzeń konformacyjną reagentów, utrzymując je we „właściwej orientacji” i blisko siebie, tak że zderzają się one częściej i z właściwą geometrią, aby ułatwić pożądaną reakcję. Stężenie efektywne” to stężenie, jakie musiałby mieć reagent w stanie wolnym w roztworze, aby doświadczyć tej samej częstotliwości zderzeń. Często takie teoretyczne efektywne stężenia są niefizyczne i niemożliwe do zrealizowania w rzeczywistości – co świadczy o wielkiej mocy katalitycznej wielu enzymów, z ogromnym wzrostem szybkości w stosunku do stanu nieskatalizowanego.
Na przykład:
Podobne reakcje zachodzą znacznie szybciej, jeśli reakcja jest wewnątrzcząsteczkowa.

Efektywne stężenie octanu w reakcji wewnątrzcząsteczkowej można oszacować jako k2/k1 = 2 x 105 Molar.
Sytuacja może być jednak bardziej złożona, ponieważ współczesne badania obliczeniowe wykazały, że tradycyjne przykłady efektów bliskości nie mogą być bezpośrednio związane z efektami entropowymi enzymów. Stwierdzono również, że pierwotna propozycja entropowa w dużym stopniu przecenia wkład entropii orientacyjnej do katalizy.
Donory lub akceptory protonówEdit
Dawcy i akceptorzy protonów, czyli kwasy i zasady mogą oddawać i przyjmować protony w celu stabilizacji rozwijających się ładunków w stanie przejściowym. Jest to związane z ogólną zasadą katalizy, która polega na zmniejszaniu barier energetycznych, ponieważ stany przejściowe są stanami o wysokiej energii, a poprzez ich stabilizację ta wysoka energia jest zmniejszana, co obniża barierę. Kluczową cechą katalizy enzymatycznej, w porównaniu z wieloma katalizami niebiologicznymi, jest to, że w tej samej reakcji można połączyć katalizę kwasową i zasadową. W wielu systemach abiotycznych, kwasy (duże) lub zasady (duże stężenie H+ lub gatunki z parami elektronowymi) mogą zwiększyć szybkość reakcji; ale oczywiście środowisko może mieć tylko jedno ogólne pH (miara kwasowości lub zasadowości (alkaliczności)). Jednak ponieważ enzymy są dużymi cząsteczkami, mogą one umieszczać zarówno grupy kwasowe, jak i zasadowe w swoim miejscu aktywnym, aby oddziaływać z substratami, i wykorzystywać oba tryby niezależnie od ogólnego pH.
Często ogólna kataliza kwasowa lub zasadowa jest stosowana do aktywacji grup nukleofilowych i/lub elektrofilowych, lub do stabilizacji grup odchodzących. Wiele aminokwasów z grupami kwaśnymi lub zasadowymi jest stosowanych w miejscu aktywnym, takich jak kwas glutaminowy i asparaginowy, histydyna, cystyna, tyrozyna, lizyna i arginina, jak również seryna i treonina. Ponadto często stosowany jest szkielet peptydowy z grupami karbonylowymi i amidowymi N. Cystyna i histydyna są bardzo często zaangażowane, ponieważ oba mają pKa zbliżone do neutralnego pH i dlatego mogą zarówno przyjmować, jak i oddawać protony.
Wiele mechanizmów reakcji obejmujących katalizę kwasowo-zasadową zakłada znacznie zmienione pKa. Ta zmiana pKa jest możliwa dzięki lokalnemu środowisku reszty.
| Warunki | Kwasy | Zasady |
|---|---|---|
| Środowisko hydrofobowe | Zwiększenie pKa | Zmniejszenie pKa |
| Sąsiadujące reszty o podobnym ładunku | Zwiększenie pKa | Decrease pKa |
| Tworzenie mostków solnych (i wiązań wodorowych) | Decrease pKa | Increase pKa |
pKa może być również znacząco zależne od otaczającego środowiska, do tego stopnia, że reszty, które są zasadowe w roztworze, mogą działać jako donory protonów i odwrotnie.
Na przykład:
Katalityczna triada proteazy serynowej
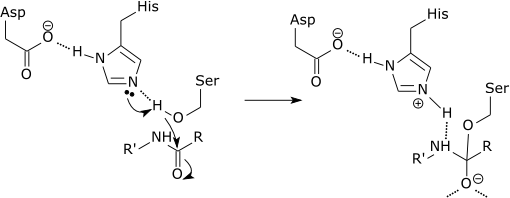
W początkowym etapie mechanizmu katalitycznego proteazy serynowej histydyna w miejscu aktywnym przyjmuje proton od reszty serynowej. Przygotowuje to serynę jako nukleofil do ataku na wiązanie amidowe substratu. Mechanizm ten obejmuje donację protonu z seryny (zasada, pKa 14) do histydyny (kwas, pKa 6), co jest możliwe dzięki lokalnemu otoczeniu zasad.
Należy wyjaśnić, że modyfikacja pKa jest czystą częścią mechanizmu elektrostatycznego. Ponadto efekt katalityczny w powyższym przykładzie związany jest głównie z obniżeniem pKa oksyanionu i podwyższeniem pKa histydyny, natomiast przeniesienie protonu z seryny na histydynę nie jest katalizowane w sposób istotny, gdyż nie jest to bariera determinująca tempo.
Kataliza elektrostatycznaEdit
Stabilizacja naładowanych stanów przejściowych może również odbywać się poprzez reszty w miejscu aktywnym tworzące wiązania jonowe (lub częściowe interakcje ładunku jonowego) z intermediatem. Wiązania te mogą pochodzić albo z kwaśnych lub zasadowych łańcuchów bocznych znajdujących się na aminokwasach takich jak lizyna, arginina, kwas asparaginowy lub kwas glutaminowy, albo pochodzić z kofaktorów metalicznych takich jak cynk. Jony metali są szczególnie skuteczne i mogą zmniejszyć pKa wody wystarczająco, aby uczynić z niej skutecznego nukleofila.
Systematyczne badania symulacji komputerowych ustaliły, że efekty elektrostatyczne dają, zdecydowanie, największy wkład w katalizę. Mogą one zwiększyć szybkość reakcji nawet o 107 razy. W szczególności stwierdzono, że enzym zapewnia środowisko, które jest bardziej polarne niż woda, a jonowe stany przejściowe są stabilizowane przez stałe dipole. Różni się to znacznie od stabilizacji stanów przejściowych w wodzie, gdzie cząsteczki wody muszą płacić „energią reorganizacji”. W celu ustabilizowania stanów jonowych i naładowanych. Tak więc kataliza jest związana z faktem, że grupy polarne enzymu są wstępnie zorganizowane
Wielkość pola elektrostatycznego wywieranego przez miejsce aktywne enzymu okazała się być wysoce skorelowana ze zwiększeniem szybkości katalitycznej enzymu
Wiązanie substratu zwykle wyklucza wodę z miejsca aktywnego, obniżając w ten sposób lokalną stałą dielektryczną do stałej dielektrycznej rozpuszczalnika organicznego. Wzmacnia to oddziaływania elektrostatyczne pomiędzy naładowanymi/polarnymi substratami a miejscami aktywnymi. Ponadto badania wykazały, że rozkłady ładunków wokół miejsc aktywnych s± tak rozmieszczone, aby stabilizować stany przejściowe katalizowanych reakcji. W kilku enzymach, te rozkłady ładunków najwyraźniej służą do kierowania polarnych substratów w kierunku ich miejsc wiązania, tak że szybkość tych reakcji enzymatycznych jest większa niż ich pozorne limity kontrolowane dyfuzją.
Na przykład:
Mechanizm katalityczny karboksypeptydazy

Tetraedryczny intermediat jest stabilizowany przez częściowe wiązanie jonowe pomiędzy jonem Zn2+ i ujemnym ładunkiem na tlenie.
Kataliza kowalencyjnaEdit
Kataliza kowalencyjna polega na tym, że substrat tworzy przejściowe wiązanie kowalencyjne z resztami w miejscu aktywnym enzymu lub z kofaktorem. Dzięki temu do reakcji dodawane jest dodatkowe pośrednie wiązanie kowalencyjne, które pomaga zmniejszyć energię późniejszych stanów przejściowych reakcji. Na późniejszym etapie reakcji wiązanie kowalencyjne musi zostać przerwane, aby zregenerować enzym. Mechanizm ten jest wykorzystywany przez triadę katalityczną enzymów, takich jak proteazy, np. chymotrypsyna i trypsyna, gdzie powstaje pośredni związek acylo-enzymatyczny. Alternatywnym mechanizmem jest tworzenie zasady schiffa przy użyciu wolnej aminy z reszt lizyny, jak widać w enzymie aldolazy podczas glikolizy.
Niektóre enzymy wykorzystują kofaktory nieaminokwasowe, takie jak fosforan pirydoksalu (PLP) lub pirofosforan tiaminy (TPP) do tworzenia kowalencyjnych produktów pośrednich z cząsteczkami reagentów. Takie kowalencyjne intermediaty funkcjonują w celu zmniejszenia energii późniejszych stanów przejściowych, podobnie jak kowalencyjne intermediaty tworzone z resztami aminokwasowymi w miejscu aktywnym umożliwiają stabilizację, ale możliwości kofaktorów pozwalają enzymom na przeprowadzanie reakcji, których nie mogłyby przeprowadzić same reszty aminokwasowe. Enzymy wykorzystujące takie kofaktory obejmują PLP-zależny enzym transaminazę asparaginianową i TPP-zależny enzym dehydrogenazę pirogronianową.
Zamiast obniżać energię aktywacji dla ścieżki reakcji, kataliza kowalencyjna zapewnia alternatywną ścieżkę dla reakcji (poprzez do kowalencyjnego intermediatu) i dlatego różni się od prawdziwej katalizy. Na przykład, energetyka wiązania kowalencyjnego z cząsteczką seryny w chymotrypsynie powinna być porównywana z dobrze rozumianym wiązaniem kowalencyjnym z nukleofilem w niekatalizowanej reakcji w roztworze. Prawdziwa propozycja kowalencyjnej katalizy (gdzie bariera jest niższa niż odpowiednia bariera w roztworze) wymagałaby, na przykład, częściowego wiązania kowalencyjnego ze stanem przejściowym przez grupę enzymatyczną (np. bardzo silne wiązanie wodorowe), a takie efekty nie przyczyniają się znacząco do katalizy.
Kataliza jonów metaliEdit
Jon metalu w miejscu aktywnym uczestniczy w katalizie poprzez koordynację stabilizacji ładunku i ekranowania. Ze względu na dodatni ładunek metalu, tylko ładunki ujemne mogą być stabilizowane przez jony metalu. Jednakże, jony metali są korzystne w katalizie biologicznej, ponieważ nie wpływają na nie zmiany pH. Jony metali mogą również jonizować wodę, działając jako kwas Lewisa. Jony metali mogą być również agentami utleniania i redukcji.
Bond strainEdit
Jest to główny efekt indukowanego wiązania dopasowania, gdzie powinowactwo enzymu do stanu przejściowego jest większe niż do samego substratu. Wywołuje to rearanżacje strukturalne, które rozciągają wiązania substratu do pozycji bliższej konformacji stanu przejściowego, obniżając w ten sposób różnicę energii między substratem a stanem przejściowym i pomagając w katalizowaniu reakcji.
Jednakże efekt rozciągania jest w rzeczywistości efektem destabilizacji stanu podstawowego, a nie efektem stabilizacji stanu przejściowego. Ponadto, enzymy są bardzo elastyczne i nie mogą zastosować dużego efektu odkształcenia.
Oprócz odkształcenia wiązań w substracie, odkształcenie wiązań może być również wywołane w samym enzymie w celu aktywacji reszt w miejscu aktywnym.
Na przykład:
Konformacje substratu, związanego substratu i stanu przejściowego lizozymu.
Substrat, po związaniu, ulega zniekształceniu z konformacji półkrzesła pierścienia heksozy (ze względu na przeszkodę steryczną z aminokwasami białka wymuszającą, aby równikowe c6 znajdowało się w pozycji osiowej) do konformacji krzesła
Tunelowanie kwantoweEdit
Te tradycyjne mechanizmy „ponad barierą” zostały w niektórych przypadkach zakwestionowane przez modele i obserwacje mechanizmów „przez barierę” (tunelowanie kwantowe). Niektóre enzymy działają z kinetyką, która jest szybsza niż to, co byłoby przewidywane przez klasyczne ΔG‡. W modelach „przez barierę”, proton lub elektron może tunelować przez bariery aktywacji. Tunelowanie kwantowe dla protonów zostało zaobserwowane w utlenianiu tryptaminy przez dehydrogenazę amin aromatycznych.
Tunelowanie kwantowe nie wydaje się zapewniać dużej przewagi katalitycznej, ponieważ wkład tunelowania jest podobny w reakcjach katalizowanych i niekatalizowanych w roztworze. Jednak wkład tunelowania (typowo zwiększający stałą szybkości o czynnik ~1000 w porównaniu do szybkości reakcji dla klasycznej drogi „przez barierę”) jest prawdopodobnie kluczowy dla żywotności organizmów biologicznych. Podkreśla to ogólne znaczenie reakcji tunelowych w biologii.
W latach 1971-1972 sformułowano pierwszy kwantowo-mechaniczny model katalizy enzymatycznej.
Aktywny enzymEdit
Energia wiązania kompleksu enzym-substrat nie może być traktowana jako energia zewnętrzna, która jest niezbędna do aktywacji substratu. Enzym o wysokiej zawartości energii może najpierw przenieść pewną specyficzną grupę energetyczną X1 z miejsca katalitycznego enzymu do miejsca końcowego pierwszego związanego reagentu, a następnie inna grupa X2 z drugiego związanego reagentu (lub z drugiej grupy pojedynczego reagentu) musi zostać przeniesiona do miejsca aktywnego, aby zakończyć przekształcanie substratu w produkt i regenerację enzymu.
Całą reakcję enzymatyczną możemy przedstawić jako dwie reakcje sprzęgania:
|
S 1 + EX 1 ⟶ S 1 EX 1 ⟶ P 1 + EP 2 {{S1}+ EX1 -> S1EX1 -> {P1}+ EP2}}}
 |
|
(1) |
|
S 2 + EP 2 ⟶ S 2 EP 2 ⟶ P 2 + EX 2 {{S2}+ EP2 -.> S2EP2 -> {P2}+ EX2}}
 |
|
(2) |
Z reakcji (1) wynika, że grupa X1 aktywnego enzymu pojawia się w produkcie ze względu na możliwość reakcji wymiany wewnątrz enzymu w celu uniknięcia zarówno elektrostatycznego hamowania, jak i odpychania atomów. Aktywny enzym jest więc silnym reagentem reakcji enzymatycznej. Reakcja (2) wykazuje niekompletną konwersję substratu, ponieważ jego grupa X2 pozostaje wewnątrz enzymu. Podejście to, podobnie jak pomysł, zostało wcześniej zaproponowane w oparciu o hipotetyczne ekstremalnie wysokie konwersje enzymatyczne (katalitycznie doskonały enzym).
Kluczowym punktem dla weryfikacji obecnego podejścia jest to, że katalizator musi być kompleksem enzymu z grupą transferową reakcji. Ten chemiczny aspekt jest wspierany przez dobrze zbadane mechanizmy kilku reakcji enzymatycznych. Rozważmy reakcję hydrolizy wiązania peptydowego katalizowaną przez czyste białko α-chymotrypsynę (enzym działający bez kofaktora), która jest dobrze zbadanym członkiem rodziny proteaz serynowych, patrz.
Przedstawiamy wyniki eksperymentalne dla tej reakcji jako dwóch etapów chemicznych:
|
S 1 + EH ⟶ P 1 + EP 2 {{S1}+ EH -> {P1}+ EP2}}}
 |
|
(3) |
|
EP 2 + H – O – H ⟶ EH + P 2 {{EP2}+ {H-.O-H}-> {EH}+ P2}}
 |
|
(4) |
gdzie S1 jest polipeptydem, P1 i P2 są produktami. Pierwszy etap chemiczny (3) obejmuje tworzenie kowalencyjnego pośredniego acylo-enzymu. Drugi etap (4) jest etapem deacylacji. Należy zauważyć, że grupa H+, występująca początkowo na enzymie, ale nie w wodzie, pojawia się w produkcie przed etapem hydrolizy, dlatego można ją uznać za dodatkową grupę reakcji enzymatycznej.
Tak więc reakcja (3) pokazuje, że enzym pełni rolę silnego reagenta reakcji. Zgodnie z zaproponowaną koncepcją, transport H z enzymu promuje pierwszą konwersję reaktanta, rozpad pierwszego początkowego wiązania chemicznego (pomiędzy grupami P1 i P2). Etap hydrolizy prowadzi do rozpadu drugiego wiązania chemicznego i regeneracji enzymu.
Proponowany mechanizm chemiczny nie zależy od stężenia substratów lub produktów w medium. Jednak zmiana ich stężenia powoduje głównie zmiany energii swobodnej w pierwszym i końcowym etapie reakcji (1) i (2) ze względu na zmiany zawartości energii swobodnej każdej cząsteczki, czy to S czy P, w roztworze wodnym.Takie podejście jest zgodne z następującym mechanizmem skurczu mięśnia. Końcowym etapem hydrolizy ATP w mięśniach szkieletowych jest uwolnienie produktu spowodowane asocjacją główek miozyny z aktyną. Zamknięcie szczeliny wiążącej aktynę podczas reakcji asocjacji jest strukturalnie sprzężone z otwarciem kieszeni wiążącej nukleotydy na miejscu aktywnym miozyny.
W szczególności końcowe etapy hydrolizy ATP obejmują szybkie uwalnianie fosforanu i powolne uwalnianie ADP.Uwolnienie anionu fosforanowego od związanego anionu ADP do roztworu wodnego może być uważane za reakcję egzergiczną, ponieważ anion fosforanowy ma niską masę cząsteczkową.
W ten sposób dochodzimy do wniosku, że pierwotne uwolnienie nieorganicznego fosforanu H2PO4- prowadzi do przekształcenia znacznej części energii swobodnej hydrolizy ATP w energię kinetyczną rozpuszczonego fosforanu, wytwarzając aktywny strumień. To założenie lokalnej mechano-chemicznej transdukcji jest zgodne z mechanizmem skurczu mięśni Tirosha, gdzie siła mięśniowa pochodzi ze zintegrowanego działania aktywnego strumienia utworzonego przez hydrolizę ATP.
.