Najpierw zajmijmy się podstawami cytometrii przepływowej
Co to jest cytometria przepływowa?
Cytometria przepływowa jest techniką używaną do wykrywania i pomiaru fizycznych i chemicznych cech populacji komórek lub cząstek. W tym procesie, próbka zawierająca komórki lub cząstki jest zawieszona w płynie i wstrzykiwana do urządzenia cytometru przepływowego.
Jaki jest cel cytometrii przepływowej?
Cytometria przepływowa zapewnia dobrze ugruntowaną metodę identyfikacji komórek w roztworze i jest najczęściej stosowana do oceny krwi obwodowej, szpiku kostnego i innych płynów ustrojowych. Badania cytometrii przepływowej są wykorzystywane do identyfikacji i ilościowego określania komórek odpornościowych oraz charakteryzowania hematologicznych nowotworów złośliwych.1 Mogą one mierzyć:
- rozmiar komórek
- ziarnistość komórek
- całkowite DNA
- nowe syntetyzowane
- ekspresję genów DNA
- receptory powierzchniowe
- wewnątrzkomórkowe białek
- sygnał przejściowy
Możliwość wykonania tych pomiarów w bardzo krótkim czasie jest jedną z kluczowych zalet procesu cytometrii przepływowej. Mogą one kwantyfikować do trzech do sześciu właściwości lub składniki są kwantyfikowane w pojedynczej próbce, komórka po komórce, dla około 10 000 komórek, w czasie krótszym niż jedna minuta.
Oprzyrządowanie i metodologia cytometrii przepływowej
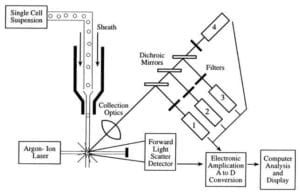 Cytometry przepływowe pobierają zawiesinę monodyspersyjnych, pojedynczych, niezgrupowanych komórek i przeprowadzają je pojedynczo (pojedynczy plik) przez wiązkę laserową, gdzie każda komórka przechodzi przez wiązkę laserową, rozproszone i fluorescencyjne światło, a następnie są liczone i sortowane lub dalej charakteryzowane.
Cytometry przepływowe pobierają zawiesinę monodyspersyjnych, pojedynczych, niezgrupowanych komórek i przeprowadzają je pojedynczo (pojedynczy plik) przez wiązkę laserową, gdzie każda komórka przechodzi przez wiązkę laserową, rozproszone i fluorescencyjne światło, a następnie są liczone i sortowane lub dalej charakteryzowane.
Trzy główne składniki cytometru przepływowego to układy płynów, optyka i elektronika.
- System płynów cytometru przepływowego jest odpowiedzialny za transport próbek z próbówki do komórki przepływowej, przez laser, sortowane i/lub odrzucane.
- Składniki układu optycznego obejmują źródła światła wzbudzającego, soczewki i filtry optyczne używane do zbierania i przenoszenia długości fal światła wokół przyrządu oraz układ detekcji, który generuje fotoprąd. Różnica odpowiedzi długości fali w danych pomaga analizować typ komórki.
- Elektronika lub oprzyrządowanie cytometru przepływowego.
Jedną z głównych zasad stosowania cytometrii przepływowej jest zdolność do analizowania pełnego cyklu komórkowego i analizowania zawartości DNA w różnych fazach. Monitorowanie naturalnych zdarzeń cyklu komórkowego może dostarczyć informacji do diagnostyki chorób i prognozowania terapii. Poszczególne fazy cyklu komórkowego mogą ujawnić zmienioną zawartość DNA i inne anomalie wskazujące na obecność guza lub oznaki zaawansowanej śmierci komórki. Wyrażenia danych są przechowywane w komputerze poprzez specjalistyczne oprogramowanie cytometrii przepływowej związane z wybranym instrumentem używanym w czasie analizy. Dane cytometrii przepływowej są zwykle raportowane na dwa różne sposoby: histogram i/lub wykres kropkowy2.
| Faza G1: | RNA, rybosomy i białka są syntetyzowane |
| Faza S: | DNA jest replikowane |
| Faza G2: | Przedstawia fazę pomiędzy syntezą DNA a mitozą |
| Faza M: | komórki dzielą się na dwie komórki córki |
FACS
Fluorescencyjnie aktywowane sortowanie komórek (FACS) jest wyspecjalizowanym typem cytometrii przepływowej. Zapewnia metodę sortowania heterogenicznej mieszaniny komórek biologicznych do dwóch lub więcej pojemników, po jednej komórce na raz, w oparciu o specyficzne właściwości rozpraszania światła i fluorescencji każdej komórki. Od cytometrii przepływowej różni się tym, że zapewnia unikalną charakterystykę, a nie tylko zlicza i sortuje komórki. Powszechne jest, że te dwie zasady działają w procesie typu co-characterization, aby zaoferować kompletne jakościowe i ilościowe podejście do analizy cytometrycznej przepływu.
Proces cytometrii przepływowej:
Zawiesina komórek jest porywana w centrum wąskiego, szybko przepływającego strumienia cieczy. Przepływ jest tak zorganizowany, że istnieje duża separacja między komórkami w stosunku do ich średnicy. Mechanizm wibracyjny zmusza strumień komórek do rozbicia się na pojedyncze kropelki. System jest tak ustawiony, aby istniało małe prawdopodobieństwo, że na jedną kroplę przypadnie więcej niż jedna komórka. Tuż przed rozbiciem strumienia na kropelki, strumień przechodzi przez stację pomiaru fluorescencji, gdzie mierzony jest interesujący charakter fluorescencji każdej komórki.
Pierścień do ładowania elektrycznego umieszcza się tuż przy punkcie, w którym strumień rozpada się na krople. Ładunek jest umieszczany na pierścieniu w oparciu o bezpośrednio poprzedzający pomiar intensywności fluorescencji, a przeciwny ładunek jest zatrzymywany na kropli, gdy odrywa się ona od strumienia. Naładowane kropelki spadają następnie przez elektrostatyczny system odchylający, który kieruje kropelki do pojemników na podstawie ich ładunku. W niektórych systemach ładunek jest przykładany bezpośrednio do strumienia, a odrywająca się kropla zachowuje ładunek o tym samym znaku co strumień. Strumień jest następnie przywracany do stanu neutralnego po oderwaniu się kropli.
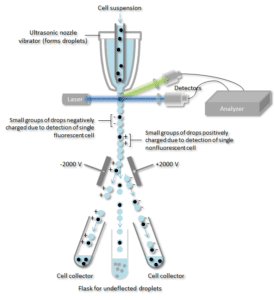
Przeciwciało specyficzne dla określonego białka powierzchni komórki jest kojarzone z cząsteczką fluorescencyjną, a następnie dodawane do mieszaniny komórek. Kolejnym etapem jest proces fluorescencji, natomiast specyficzne komórki przechodzą przez wiązkę lasera, przez którą są monitorowane. Kropelki zawierające pojedynczą komórkę otrzymują ładunek dodatni lub ujemny, w zależności od tego, czy komórka posiada przeciwciało znakowane fluorescencyjnie. Kropelki zawierające pojedynczą komórkę są następnie wykrywane przez pole elektryczne i kierowane do oddzielnych rurek zbierających zgodnie z ich ładunkiem, co pozwala na łatwe oddzielenie komórek oznaczonych przeciwciałem fluorescencyjnym.
Multicolorowa cytometria przepływowa
Multicolorowa cytometria przepływowa jest użyteczną techniką podczas badania mieszanych populacji komórek, takich jak komórki krwi i tkanek w próbkach ludzkich i zwierzęcych. Generalnie, określony typ komórek jest oznaczany barwnikiem fluorescencyjnym (markerami), takim jak fluorofor lub jodek propidium. Możliwość jednoczesnego użycia wielu markerów fluorescencyjnych pozwala na identyfikację wielu typów komórek, jak również markerów funkcjonalnych, które dodatkowo charakteryzują każdą próbkę. Istnieją specjalistyczne instrumenty zdolne do pomiaru 12-plus kolorów 3,4 . Te fluorescencyjne barwniki i markery są mierzone przez różne długości fali światła emitowanego z lasera w celu sortowania według indywidualnego typu komórki. Każdy marker jest wzbudzany przy określonej długości fali świetlnej w celu ich rozróżnienia przy użyciu wielu markerów.
Adaptacja typowego panelu barwienia z 4 do 6 kolorów do więcej niż 12 kolorów nie jest po prostu kwestią „podłącz i graj”, musi być traktowana w sposób systematyczny w celu osiągnięcia udanych parametrów w panelu barwienia. Podstawowe zasady projektowania paneli działają najlepiej w oparciu o badania przed użyciem. Innymi słowy, przygotowanie jest kluczowe nawet od początku procesu odnoszenia się do indeksu barwienia w odniesieniu do efektywnego dopasowania fluorochromów według jasności5.
Porada dotycząca cytometrii przepływowej:
Poświęć trochę czasu na zrozumienie subtelnych niuansów swojego cytometru przepływowego przed zaprojektowaniem swojego panelu przeciwciał pierwotnych. Skoncentruj się na tym, gdzie w systemie można wykonać najczulsze pomiary. Jest to coś więcej niż tylko intensywność fluorescencji.
Rozważ zastąpienie mniej jasnego fluorochromu, aby uniknąć błędów kanału.
Wspólne zastosowania metodologii cytometrii przepływowej
Cytometria przepływowa jest integralnym elementem w kilku obszarach klinicznych, w tym w diagnostyce, planach leczenia i chorobach układowych, zarówno statycznych, jak i postępujących. W miarę jak dowiadujemy się więcej o praktycznych zastosowaniach cytometrii przepływowej, baza wiedzy ulega dalszemu poszerzeniu. Obecnie, bardziej niż kiedykolwiek wcześniej, badacze są bardzo podekscytowani możliwością dowiedzenia się więcej o złożoności pewnych chorób i stanów. Doprowadziło to do szybkiej zmiany w diagnozowaniu wzorców i drastycznie zmieniło podejście medyczne do leczenia chorób takich jak rak6.
Metodyka cytometrii przepływowej jest często związana z innymi kompleksowymi wzorcami badań, takimi jak badanie morfologiczne. W wielu przypadkach, nowotwory hematologiczne przedstawiają specyficzne zmiany morfologiczne, a cytometria przepływowa zapewnia większą specyficzność i pomaga patologom rozwinąć anomalie tkankowe lub inne zaawansowane choroby. Cytometria przepływowa, w niektórych przypadkach, może wstępnie określić nawrót raka, zanim zostaną wykryte zmiany morfologiczne7.
Kilka z głównych zastosowań wykorzystywanych w zakresie nowoczesnych ustawień klinicznych zarówno terapeutycznych, jak i badawczych obejmuje:
- Ekspresja białek-przez całą komórkę, nawet jądro
- Modyfikacje białek po translacji-w tym białka rozszczepione i ufosforylowane
- RNA-w tym zarówno miRNA, i transkryptów mRNA
- Stan zdrowia komórek-detekcja komórek apoptotycznych lub śmierci komórkowej
- Stan cyklu komórkowego-dostarcza potężne narzędzie do oceny komórek w fazie G0/G1 w porównaniu z fazą S, G2 lub poliploidalnością, w tym analiza proliferacji i aktywacji komórek
- Identyfikacja i charakterystyka odrębnych podzbiorów komórek w niejednorodnej próbce – w tym rozróżnianie centralnych efektorowych komórek pamięci od wyczerpanych komórek T lub regulatorowych komórek T
Podsumowanie
Podstawowe zasady cytometrii przepływowej niewiele się zmieniły w ciągu ostatniej dekady, ale zastosowania tej technologii bardzo się rozwinęły. Podstawy cytometrii przepływowej były spójne z jej podstawową funkcją, którą jest przesłuchiwanie poszczególnych komórek lub cząstek w strumieniu za pomocą lasera, gdy komórki przemieszczają się obok zestawu stacjonarnych detektorów. Coraz więcej kolorów fluorescencji jest wykrywanych przez cytometry, wraz z szybkim sortowaniem i funkcjami analitycznymi8.
Cytometria przepływowa odgrywa integralną rolę w badaniach nauk molekularnych i nadal ewoluuje w szybkim tempie. Na rynku dostępnych jest kilka komercyjnych cytometrów przepływowych. Mają one tendencję do działania na tej samej podstawowej zasadzie, ale istnieją istotne różnice w ich konstrukcji, oraz koncepcjach wyrównania i integracji innych komponentów.
Niedługo na horyzoncie pojawi się instrumentarium 3D, które zostanie włączone do hybrydowego instrumentu produkowanego przez NanoCellect Biomedical, WOLF Cell Sorter. Możemy również oczekiwać rozwoju sond fluorescencyjnych o wąskim spektrum, integracji technik biologii molekularnej z cytometrią przepływową oraz oceny markerów bezkomórkowych, takich jak cytokiny, które będą kluczowymi elementami w ciągłej ewolucji analizy cytometrii przepływowej i technologii oznaczania komórek.
Źródła:
1 http://clinchem.aaccjnls.org/content/46/8/1221
2 https://pubmed.ncbi.nlm.nih.gov/18615596-flow-cytometry-histograms-transformations-resolution-and-display/
3 https://onlinelibrary.wiley.com/doi/full/10.1002/cyto.a.20959
4 https://currentprotocols.onlinelibrary.wiley.com/doi/abs/10.1002/cpim.26
5 https://www.nature.com/articles/nprot.2006.250
6 https://pubmed.ncbi.nlm.nih.gov/19967915-immunophenotypic-analysis-of-bone-marrow-b-lymphocyte-precursors-hematogones-by-flow-cytometry/
7 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4803461/
8 https://link.springer.com/protocol/10.1385/0-89603-150-0:543