US Pharm. 2018;43(9):21-26.
ABSTRACT: Hormonalna terapia zastępcza (HRT) jest najskuteczniejszą metodą leczenia objawów naczynioruchowych i moczowo-płciowych związanych z menopauzą. Działania niepożądane związane z HRT zależą od różnych czynników, w tym od dawki, drogi podania, czasu stosowania, momentu rozpoczęcia oraz wyboru środka. Decyzja o rozpoczęciu HRT powinna uwzględniać ocenę ryzyka, a HRT powinna być indywidualnie dobrana do pacjentki. Wiele istniejących opcji HRT ma szeroki wachlarz dawek i postaci. Farmaceuci powinni być w stanie doradzać pacjentkom w zakresie HRT i jej działań niepożądanych.
Przeciętna kobieta przeżyje jedną trzecią swojego życia w okresie menopauzy lub po jej zakończeniu.1 Leczenie objawów menopauzalnych zyskuje coraz większe znaczenie ze względu na choroby związane ze starzeniem się kobiet.2 Hormonalna terapia zastępcza (HRT), określana jako terapia estrogenowa, terapia skojarzona estrogenowo-progesteronowa, terapia z udziałem agonistów lub antagonistów receptorów estrogenowych, nadal odgrywa główną rolę w łagodzeniu objawów okresu okołomenopauzalnego i pomenopauzalnego.3 Chociaż doświadczenia każdej kobiety są inne, objawy naczynioruchowe (vasomotor symptoms – VMS) i objawy ze strony sromu i pochwy to dwie najczęstsze dolegliwości związane ze zmianami hormonalnymi zachodzącymi w okresie menopauzy.4
Objawy menopauzalne
VMS to jedne z najczęstszych i najbardziej dokuczliwych objawów menopauzalnych. Uderzenia gorąca, charakteryzujące się nagłym uczuciem gorąca w górnej części klatki piersiowej i na twarzy, trwającym od 2 do 4 minut, występują u około 75% kobiet w okresie menopauzy.1 Inne możliwe objawy VMS to pocenie się, kołatanie serca i niepokój.1 VMS wiążą się z gorszą jakością snu, drażliwością, trudnościami w koncentracji i obniżoną jakością życia.3 Ponadto objawy te powiązano z ryzykiem sercowo-naczyniowym, kostnym i poznawczym.5-9 HRT od dawna uznawana jest za najskuteczniejszą metodę leczenia VMS.4,10
Oprócz uciążliwych VMS, wiele kobiet doświadcza objawów ze strony sromu i pochwy. Szacuje się, że 10% do 40% kobiet doświadcza atrofii pochwy.3 Atrofia pochwy może powodować ból, pieczenie i swędzenie sromu; suchość pochwy; upławy; dyspareunię (trudne lub bolesne współżycie); plamienie lub krwawienie po stosunku.1 Objawy te występują zwykle w późnym okresie pomenopauzalnym i mogą prowadzić do dyskomfortu przy noszeniu ciasno dopasowanych ubrań, podczas siedzenia, ćwiczeń fizycznych lub aktywności seksualnej.1 Miejscowa HRT jest zwykle zalecana w leczeniu objawów ze strony sromu i pochwy.1
Oprócz łagodzenia wymienionych wcześniej objawów istnieją dowody na to, że standardowa HRT w małych dawkach może również zapobiegać pomenopauzalnym złamaniom bioder, kręgosłupa i innych części ciała.10 Korzyści ze stosowania HRT w przypadku VMS i objawów ze strony układu moczowo-płciowego obejmują poprawę w zakresie pęcherza nadreaktywnego, zmniejszenie zaburzeń snu, zmniejszenie ryzyka wystąpienia cukrzycy typu 2, potencjalną ochronę przed chorobą wieńcową (CAD) i zawałem serca, zmniejszenie ryzyka osteoporozy lub złamań oraz potencjalne zmniejszenie śmiertelności z wszystkich przyczyn.1,10 Korzyści wynikające z zastosowania HRT w zakresie gęstości kości szybko jednak maleją po zaprzestaniu stosowania leku. Ponadto, chociaż niektóre produkty zostały zatwierdzone przez FDA do zapobiegania osteoporozie, żaden z nich nie jest obecnie zatwierdzony do leczenia osteoporozy. Główne zagrożenia związane ze stosowaniem tych środków obejmują żylną chorobę zakrzepowo-zatorową (VTE), udar niedokrwienny mózgu, zwiększoną częstość występowania raka endometrium (w przypadku stosowania nieopartych estrogenów u kobiet z macicą) oraz zwiększone ryzyko raka piersi, gdy HRT jest stosowana dłużej niż 3 do 5 lat.4,10
Dostępne produkty HRT
Dostępna jest szeroka gama produktów HRT w różnych formach dawkowania.4 Wśród preparatów doustnych dostępne są: skoniugowane estrogeny końskie (CEE), mikronizowany 17-beta estradiol (mikronizowany w celu poprawy wchłaniania), estrogeny estryfikowane, etynyloestradiol (silnie działający preparat estrogenowy, który jest stosowany w znacznie mniejszych dawkach w HRT niż w doustnej antykoncepcji), tabletki zawierające połączenie estrogenu i progestyny oraz tabletki zawierające połączenie CEE i azedoksyfenu.4
Tabletki CEE/bazedoksifen, połączenie estrogenu i selektywnego modulatora receptora estrogenowego, są dostępne w Stanach Zjednoczonych w leczeniu menopauzalnego VMS i zapobieganiu osteoporozie. W tym połączeniu bazedoksifen zapobiega wywołanej estrogenami hiperplazji endometrium, co sprawia, że podawanie progestyny nie jest konieczne. Bazedoksifen wiąże się jednak ze zwiększonym ryzykiem wystąpienia VTE.4 Stosowanie bazedoksifenu w leczeniu osteoporozy uznano za bezpieczne w badaniach trwających do 7 lat, ale kombinację tę badano tylko przez krótszy czas.11,12 W badaniach VMS trwających do 2 lat nie wykazano zwiększenia częstości występowania tkliwości piersi ani ryzyka raka piersi.3 Aktualne wytyczne zalecają stosowanie CEE/bazedoksyfenu u kobiet po menopauzie z macicą i bez przeciwwskazań w celu leczenia VMS i zapobiegania utracie masy kostnej, ale nie określają czasu trwania terapii.1 Na podstawie dostępnych dowodów leczenie VMS za pomocą CEE/bazedoksyfenu przez okres do 2 lat wydaje się bezpieczne; bezpieczeństwo stosowania przez okres dłuższy niż 2 lata pozostaje niejasne.
HRT jest również dostępny w postaci różnych preparatów do stosowania miejscowego. Dostępne są transdermalne preparaty plastrów zawierające 17-beta estradiol lub kombinacje estrogenowo-progestynowe. Inne preparaty do stosowania miejscowego obejmują opakowania żelowe lub pompy dozujące, aerozole i emulsje.4 Można również rozważyć wstrzyknięcia dożylne, ale produkty te są rzadko stosowane w HRT.4 Podsumowanie dostępnych ogólnoustrojowych preparatów HRT przedstawiono w TABELI 1.13-15
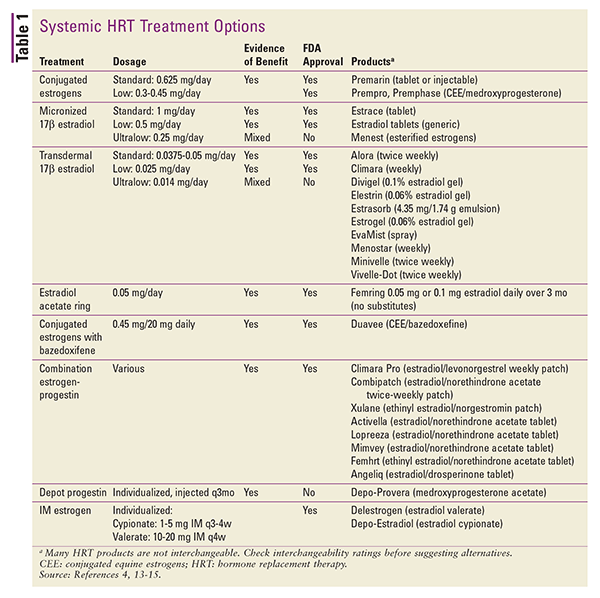
Przy zamianie jednej postaci dawkowania na inną, różnice w drodze podania i sile działania produktu można uwzględnić, stosując szacunkowe równoważniki dawek.4 Równoważniki dawek dla preparatów doustnych są następujące: 1 mg mikronizowanego 17-beta estradiolu równa się 1,25 mg piperazyny siarczanu estronu. W przeliczeniach między doustnymi i transdermalnymi preparatami estrogenów, 0,05 mg/24 godziny transdermalnie jest równe około 0,625 mg doustnie na dobę.4
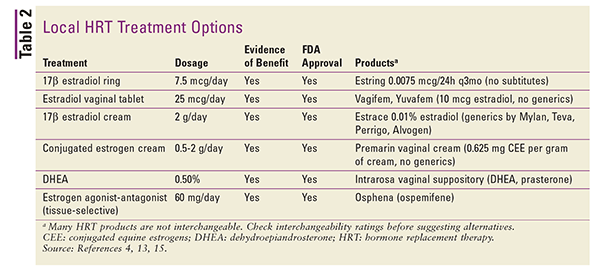
Preparaty miejscowe są zazwyczaj stosowane w małych dawkach i są używane specjalnie do leczenia objawów atrofii sromu i pochwy.4 Większe dawki mogą być stosowane w leczeniu ogólnoustrojowego VMS, ale generalnie nie jest to zalecane.4 Preparaty miejscowe obejmują pierścienie dopochwowe, tabletki i kremy. Podsumowanie dostępnych preparatów miejscowych HRT przedstawiono w TABELI 2.4,13,15
Obecne zalecenia
Trzy organizacje – American College of Obstetricians and Gynecologists, North American Menopause Society (NAMS) i Endocrine Society – opracowały wytyczne dotyczące stosowania HRT w menopauzie. Jak podano w tych wytycznych, wskazania do stosowania HRT obejmują leczenie VMS związanego z menopauzą oraz leczenie objawów ze strony sromu i pochwy przy braku uciążliwych objawów ogólnoustrojowych.1,3,4 Stwierdzono, że estrogeny same lub w połączeniu z progestyną zmniejszają tygodniowe VMS o 75% i istotnie zmniejszają nasilenie objawów w porównaniu z placebo.4
U kobiet w wieku poniżej 60 lat, które są mniej niż 10 lat po menopauzie, mają uciążliwe VMS i nie mają przeciwwskazań do HRT lub nadmiernego ryzyka sercowo-naczyniowego lub raka piersi, zaleca się stosowanie terapii wyłącznie estrogenowej u kobiet bez macicy. U pacjentek z macicą zaleca się dodanie progestyny w celu zapobiegania hiperplazji endometrium i potencjalnemu rakowi endometrium.1,3,4 Obecnie wymagana ekspozycja na progestyny jest niejasna, ale wielu świadczeniodawców podaje progestyny w 14-dniowym cyklu miesięcznym.4 U kobiet w wieku powyżej 60 lat lub będących ponad 10 lat po menopauzie zaleca się rozważenie innych (niehormonalnych) metod leczenia zamiast HRT.3
U kobiet z podwyższonym ryzykiem chorób układu sercowo-naczyniowego (CVD; zdefiniowanym jako >10% 10-letniego ryzyka CVD według narzędzia szacowania ryzyka sercowo-naczyniowego American College of Cardiology/American Heart Association) preferowane są terapie niehormonalne.3 U kobiet z umiarkowanym ryzykiem CVD preferowane jest stosowanie estrogenów transdermalnych z progestyną lub bez progestyny zamiast terapii doustnej, ponieważ preparaty te w mniejszym stopniu wpływają na ciśnienie tętnicze, lipidy i gospodarkę węglowodanową.1 U chorych z podwyższonym ryzykiem VTE preferowane jest stosowanie terapii niehormonalnej w najmniejszej skutecznej dawce. Wreszcie, u chorych z wysokim lub pośrednim ryzykiem raka piersi preferowane są terapie niehormonalne.4
Jeśli wybrano HRT, wszystkie wytyczne zalecają stosowanie najmniejszej skutecznej dawki.1,4,10 Jedną z korzyści stosowania mniejszych dawek HRT jest lepszy profil działań niepożądanych w porównaniu ze schematami opartymi na dużych dawkach.4 Nie ma obecnie preferowanej drogi terapii w leczeniu VMS, dlatego droga podania powinna być uzależniona od preferencji chorej. Należy zauważyć, że produkty transdermalne mogą wiązać się z mniejszą częstością występowania działań niepożądanych, takich jak VTE, ale badania w tym zakresie są nadal prowadzone.10
W leczeniu objawów ze strony układu moczowo-płciowego u kobiet bez wywiadu w kierunku nowotworów hormonozależnych można stosować estrogeny dopochwowe w małych dawkach.1 W przypadku wyłącznie objawów ze strony pochwy wytyczne zalecają rezygnację z dodawania progestyny niezależnie od obecności macicy. Ta terapia może być również odpowiednia u pacjentek z nowotworami hormonozależnymi w wywiadzie, ale w tych przypadkach wybór terapii powinien być oparty na wspólnym procesie podejmowania decyzji, obejmującym omówienie ryzyka i korzyści. Potencjalne korzyści ze stosowania estrogenów dopochwowych obejmują szybką poprawę objawów ze strony pochwy i układu moczowego oraz możliwe zapobieganie nawracającym zakażeniom układu moczowego. Do terapii nieestrogenowych, zatwierdzonych przez FDA i zgodnych z wytycznymi, stosowanych w celu złagodzenia dyspareunii należą ospemifen i dopochwowy dehydropiandrosteron.16,17
Terapia wyłącznie progestynowa, testosteron, alternatywne terapie niehormonalne na bazie roślin oraz złożone hormony bioidentyczne nie mają danych i generalnie nie są zalecane.1,4 NAMS stwierdza, że lekarze przepisujący leki mogą rozważyć złożone HRT w sytuacjach, gdy pacjentka nie jest w stanie tolerować terapii zatwierdzonych przez FDA.3 Niehormonalne metody leczenia objawów naczynioruchowych obejmują selektywne inhibitory wychwytu zwrotnego serotoniny i selektywne inhibitory wychwytu zwrotnego serotoniny i noradrenaliny, klonidynę i gabapentynę, a niehormonalne metody leczenia objawów pochwowych obejmują lubrykanty, agonistów-antagonistów estrogenów i leki ziołowe.4 Dowody przemawiające za stosowaniem terapii niehormonalnych są różne, a nie wszystkie opcje mają potwierdzone dowody lub wskazania zatwierdzone przez FDA.4
Monitorowanie HRT powinno obejmować regularne badania przesiewowe w kierunku raka piersi w trakcie i po zakończeniu terapii. Nawracające nieplanowane krwawienia powinny być szybko oceniane.1 Czas trwania terapii powinien być weryfikowany co najmniej raz w roku, przy czym preferowany jest jak najkrótszy okres leczenia.1 Kiedy pacjentki i świadczeniodawcy decydują się na przerwanie stosowania HRT, można zastosować strategię stopniowego lub nagłego odstawienia leku. Brak jest dowodów dotyczących metod odstawiania leków, dlatego też zaleca się wspólne podejmowanie decyzji dotyczących procesu odstawiania leków.1,4
Interakcje lek-lek
Większość dostępnych na rynku produktów HRT (TABELA 1) podlega metabolizmowi wątrobowemu, w którym pośredniczy układ CYP450.15 W szczególności, produkty estrogenowe są częściowo metabolizowane przez CYP3A4; dlatego silne induktory CYP3A4 mogą zmniejszać skuteczność estrogenowej HRT, a silne inhibitory mogą zwiększać stężenie estrogenów w surowicy. Dodatkowo, inne leki będące substratami dla tych enzymów mogą zaburzać metabolizm HRT.15
Szerokie i częste działania niepożądane
Główne działania niepożądane związane z HRT obejmują CVD, raka piersi, raka endometrium lub jajnika, udar mózgu i VTE.1 Niestosowane estrogeny zwiększają ryzyko hiperplazji endometrium i raka, stąd zalecenie dodawania progestyny u kobiet z macicą. Jeśli chodzi o ryzyko raka piersi, wydaje się, że ryzyko rozwoju raka piersi jest niewielkie, gdy kobieta przyjmuje estrogeny przez 5 lat.3 Aktualne piśmiennictwo jest niespójne w zakresie określania ryzyka rozwoju raka jajnika w wyniku stosowania HRT.3 Potrzeba więcej randomizowanych, kontrolowanych badań, aby ustalić rzeczywiste ryzyko rozwoju raka jajnika przy stosowaniu HRT.1 Wpływ HRT na chorobę wieńcową (CAD), udar mózgu i VTE różni się w zależności od wieku kobiety w momencie rozpoczęcia stosowania HRT lub czasu, jaki upłynął od menopauzy. Wydaje się, że kobiety przyjmujące HRT dłużej niż 10 lat od początku menopauzy są w grupie zwiększonego ryzyka rozwoju CAD.3 Ogólnie rzecz biorąc, badania sugerują, że doustne i transdermalne preparaty o mniejszej dawce zmniejszają ryzyko udaru mózgu i VTE w porównaniu z HRT o standardowej dawce.3 Pacjentki, które są starsze niż 60 lat w momencie rozpoczynania HRT lub u których upłynęło więcej niż 10 lat od początku menopauzy, są w grupie zwiększonego ryzyka wystąpienia tych działań niepożądanych. Ponadto, kobiety przyjmujące HRT z estrogenami, same lub w połączeniu, są narażone na zwiększone ryzyko wystąpienia kamicy żółciowej, zapalenia pęcherzyka żółciowego i cholecystektomii.3 Ryzyko wystąpienia choroby pęcherzyka żółciowego jest związane ze stosowaniem doustnej HRT i może nie występować w przypadku preparatów stosowanych miejscowo lub transdermalnie.1,3
Przeciwwskazania
Wytyczne towarzystw naukowych nie określiły listy bezwzględnych lub względnych przeciwwskazań do stosowania HRT.2 Dlatego, podobnie jak w przypadku większości decyzji klinicznych, ważna jest indywidualna ocena stosunku korzyści do ryzyka. Ogólnie rzecz biorąc, HRT należy unikać u pacjentek z niewyjaśnionym krwawieniem z pochwy, udarem mózgu lub przemijającym atakiem niedokrwiennym w wywiadzie, zawałem serca, zatorowością płucną lub VTE, rakiem piersi lub endometrium, czynną chorobą wątroby, znanym niedoborem białka C, białka S, antytrombiny lub innymi zaburzeniami zakrzepowo-zatorowymi oraz znaną lub podejrzewaną ciążą.1 Ponadto należy zachować ostrożność u pacjentów z cukrzycą, chorobą pęcherzyka żółciowego, hipertriglicerydemią (>400 mg/dobę), niedoczynnością przytarczyc, łagodnym oponiakiem, pośrednim lub wysokim ryzykiem raka piersi, wysokim ryzykiem chorób serca lub migreną z aurą.2
Punkty doradztwa
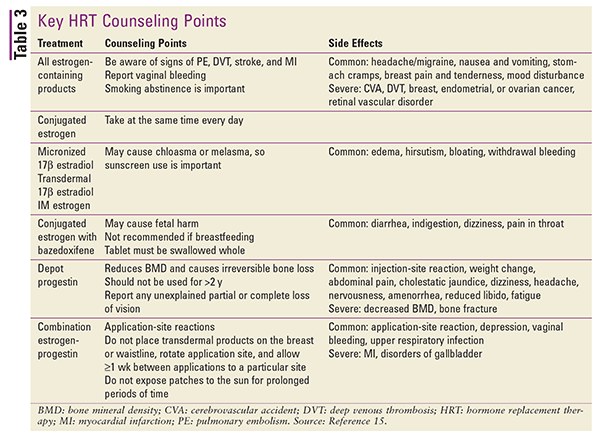
Podsumowanie kluczowych punktów doradztwa i działań niepożądanych dla różnych rodzajów HRT przedstawiono w TABELI 3.15
Wnioski
HRT, dostępna w szerokiej gamie preparatów, jest najskuteczniejszą metodą leczenia zarówno VMS, jak i objawów ze strony układu moczowo-płciowego. Ponieważ ryzyko związane z HRT jest różne u każdej kobiety, leczenie powinno być zindywidualizowane i ukierunkowane na maksymalizację skuteczności, minimalizację czasu trwania terapii oraz zmniejszenie ryzyka wystąpienia działań niepożądanych. W sytuacjach, w których HRT nie wchodzi w grę, dostępne są niehormonalne metody leczenia zarówno VMS, jak i objawów ze strony układu moczowo-płciowego, ale skuteczność i zatwierdzenie tych produktów przez FDA różnią się, dlatego należy zapoznać się z danymi dotyczącymi skuteczności tych produktów.
1. Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015;100(11):3975-4011.
2. Shifren JL, Schiff I. Role of hormone therapy in the management of menopause. Obstet Gynecol. 2010;115(4):839-855.
3. The NAMS 2017 Hormone Therapy Position Statement Advisory Panel. The 2017 hormone therapy position statement of the Północnoamerykańskie Towarzystwo Menopauzy. Menopause. 2017;24(7):728-753.
4. ACOG Practice Bulletin No. 141: management of menopausal symptoms. Obstet Gynecol. 2014;123(1):202-216.
5. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Hot flashes and subclinical cardiovascular disease: findings from the Study of Women’s Health Across the Nation Heart Study. Circulation. 2008;118(12):1234-1240.
6. Thurston RC, Kuller LH, Edmundowicz D, Matthews KA. History of hot flashes and aortic calcification among postmenopausal women. Menopause. 2010;17(2):256-261.
7. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Hot flashes and carotid intima media thickness among midlife women. Menopause. 2011;18(4):352-358.
8. Crandall CJ, Aragaki A, Cauley JA, et al. Associations of menopausal vasomotor symptoms with fracture incidence. J Clin Endocrinol Metab. 2015;100(2):524-534.
9. Maki PM. Pamięć werbalna a menopauza. Maturitas. 2015;82(3):288-290.
10. North American Menopause Society. The 2012 hormone therapy position statement of: The North American Menopause Society. Menopause. 2012;19(3):257-271.
11. Palacios S, Silverman SL, de Villiers TJ, et al. A 7-year randomized, placebo-controlled trial assessing the long-term efficacy and safety of bazedoxifene in postmenopausal women with osteoporosis: effects on bone density and fracture. Menopause. 2015;22(8):806-813.
12. Archer DF, Freeman EW, Komm BS, et al. Pooled analysis of the effects of conjugated estrogens/bazedoxifene on vasomotor symptoms in the selective estrogens, menopause, and response to therapy trials. J Womens Health (Larchmt). 2016;25(11):1102-1111.
13. FDA. Pomarańczowa księga: zatwierdzone produkty lecznicze z ocenami równoważności terapeutycznej. Product details for ANDA 204726. www.accessdata.fda.gov/scripts/cder/ob/results_product.cfm?Appl_Type=A&Appl_No=204726. Dostęp 18 marca 2018 r.
14. FDA. Drugs@FDA: Produkty lecznicze zatwierdzone przez FDA. www.accessdata.fda.gov/scripts/cder/daf/index.cfm. Dostęp 17 czerwca 2018 r.
15. DrugDex . Greenwood Village, CO: Truven Health Analytics, Inc. www.micromedexsolutions.com. Dostęp 15 czerwca 2018.
16. Constantine G, Graham S, Portman DJ, et al. Female sexual function improved with ospemifene in postmenopausal women with vulvar and vaginal atrophy: results of a randomized, placebo-controlled trial. Climacteric. 2015;18(2):226-232.
17. Labrie F, Archer DF, Kołtun W, et al. Efficacy of intravaginal dehydroepiandrosterone (DHEA) on moderate to severe dyspareunia and vaginal dryness, symptoms of vulvovaginal atrophy, and of the genitourinary syndrome of menopause. Menopause. 2016;23(3):243-256.