Użycie i znaczenie ogniw i baterii są niekwestionowane. W naszym codziennym życiu korzystamy z ogniw na wiele różnych sposobów. W ostatnich kilku koncepcjach, już wprowadziliśmy Cię w baterie w ogóle. Jednak tutaj przedstawimy Ci dogłębną analizę ogniw galwanicznych. Więc, zaczynajmy.
Sugerowane filmy
Ogniwa galwaniczne
Pośród innych ogniw, ogniwo galwaniczne jest rodzajem ogniwa elektrochemicznego. Służy do dostarczania prądu elektrycznego poprzez przeniesienie elektronów w wyniku reakcji redoks. Ogniwo galwaniczne jest przykładem na to, jak można wykorzystać energię za pomocą prostych reakcji zachodzących pomiędzy kilkoma danymi elementami. Zadziwiające jest studiowanie, jak ogniwo galwaniczne może być skonfigurowane i wykorzystane do uzyskania energii.
Wyjaśniając w najprostszych słowach, ogniwo galwaniczne działa jako urządzenie, w którym zachodzą jednoczesne reakcje utleniania i redukcji. Reakcje te są wykorzystywane do przekształcania energii chemicznej w energię elektryczną, która może być wykorzystana do dowolnych celów komercyjnych.
Browse more Topics under Electrochemistry
- Baterie
- Przewodnictwo roztworów elektrolitycznych
- Korozja
- Ogniwa elektrochemiczne
- Ogniwa elektrolityczne i elektroliza
- Ogniwa paliwowe
- Równanie Nernsta
- Zmienność przewodnictwa i przewodnictwa molowego ze stężeniem
.
Praca ogniw galwanicznych

Praca ogniwa galwanicznego jest dość prosta. Polega ono na reakcji chemicznej, której efektem końcowym jest energia elektryczna. Podczas reakcji redoks, ogniwo galwaniczne wykorzystuje transfer energii pomiędzy elektronami do konwersji energii chemicznej w energię elektryczną.
Ogniwo galwaniczne wykorzystuje zdolność do oddzielenia przepływu elektronów w procesie utleniania i redukcji, powodując reakcję połówkową i łącząc każdy z nich z przewodem tak, że ścieżka może być utworzona dla przepływu elektronów przez taki przewód. Ten przepływ elektronów nazywany jest zasadniczo prądem. Taki prąd może być wykonany do przepływu przez drut, aby zakończyć obwód i uzyskać jego wyjście w dowolnym urządzeniu, takim jak telewizor lub watch.
Centrum galwaniczne może być wykonane z dowolnych dwóch metali. Te dwa metale mogą tworzyć anodę i katodę, jeśli pozostaną w kontakcie ze sobą. Takie połączenie pozwala na korozję galwaniczną tego metalu, który jest bardziej anodowy. Obwód łączący jest wymagany, aby korozja mogła mieć miejsce.
Ustawienie ogniwa galwanicznego
Aby stworzyć ogniwo galwaniczne, należy przejść przez następujące ustawienia. Idealnie byłoby gdyby ogniwo zawierało dwie elektrody. Jedna z tych elektrod, katoda, powinna być elektrodą dodatnio naładowaną, podczas gdy druga, anoda, powinna być elektrodą ujemnie naładowaną.
Te dwie elektrody powinny tworzyć dwa zasadnicze składniki ogniwa galwanicznego. Reakcja chemiczna związana z redukcją zachodzi na katodzie, podczas gdy półreakcja utleniania zachodzi na anodzie. Jak już zostało powiedziane, dowolne dwa metale mogą być użyte do stworzenia reakcji chemicznej.
Zrozumienie ogniwa galwanicznego na przykładzie
Przyjrzyjrzyjmy się przykładowi, gdzie dwa metale zaangażowane w reakcję chemiczną to cynk i miedź. Jak reakcja chemiczna ma miejsce, Cynk będzie skończyć tracąc dwa elektrony. Zostanie to podjęte przez miedź, aby stać się elementarnej miedzi. Ponieważ te dwa metale będą umieszczone w dwóch oddzielnych pojemnikach i będą połączone przewodnikiem, powstanie prąd elektryczny, który przeniesie wszystkie elektrony z jednego metalu do drugiego.
W tym samym czasie, te dwa metale będą zanurzone w roztworze soli, powiedzmy, siarczan cynku i siarczan miedzi w tym przypadku. W tym przypadku, oba roztwory nie są mieszane ze sobą bezpośrednio, ale mogą być połączone za pomocą mostka lub medium. To medium będzie odpowiedzialne za transfer jonów, ale również upewnić się, że dwa roztwory nie przyjść do mieszania się ze sobą.
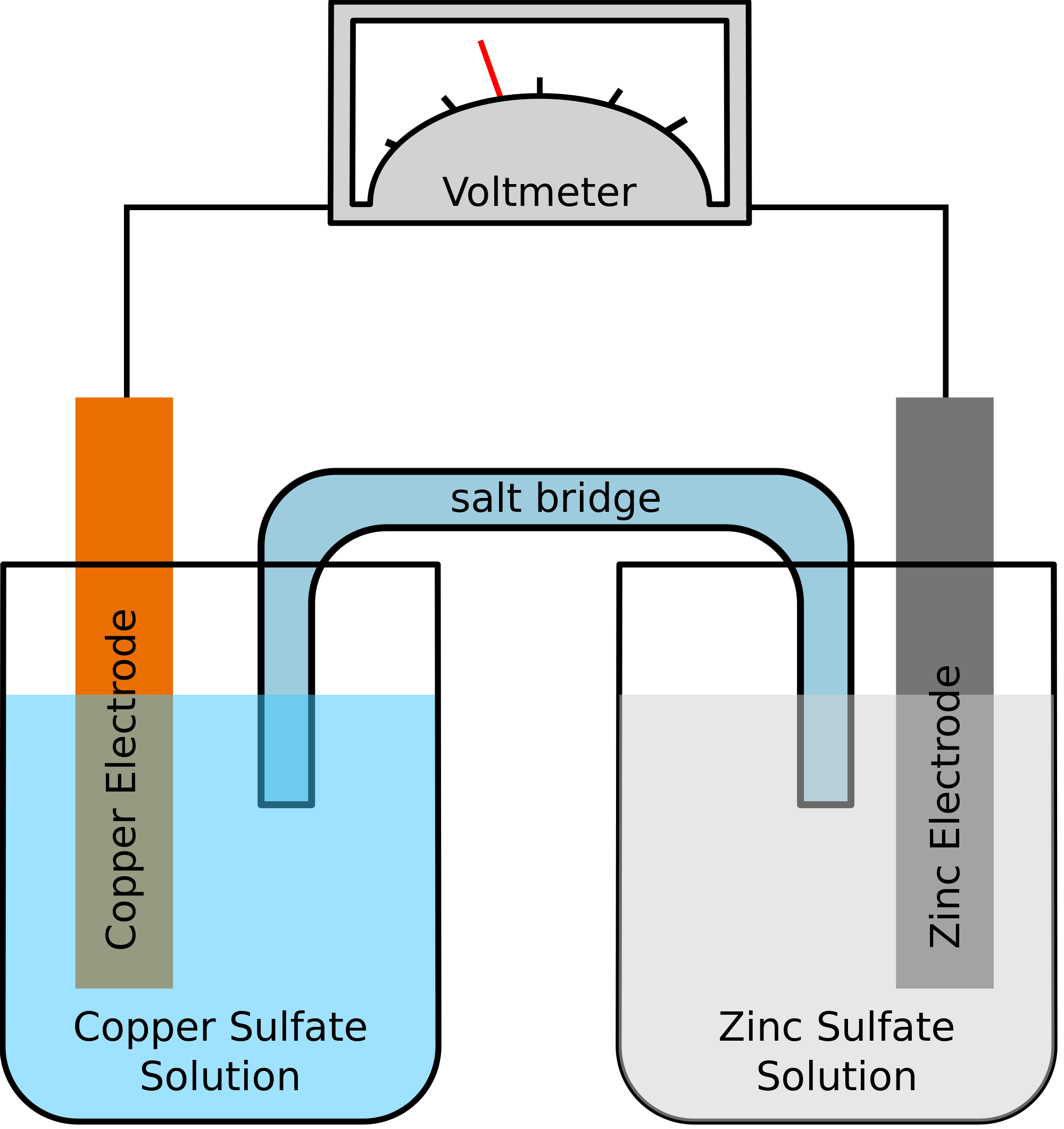
Taki most pomaga w uzupełnianiu obwodu do przenoszenia ładunku elektrycznego, a także upewnia się, że roztwory w pojemnikach z metali pozostają neutralne i nie mieszają się ze sobą. Tak długo, jak mostek solny nie zakłóca reakcji redoks, w której zachodzi utlenianie i redukcja, nie ma znaczenia, który mostek solny jest używany w reakcji chemicznej.
Kilka ważnych terminów
Kilka ważnych terminów wprowadzonych do użycia w ogniwach galwanicznych jest wymienionych poniżej:
- Granice faz: Odnosi się do dwóch metali, które działają jako katoda i anoda.
- Mostek solny: Mostek łączący lub medium, które umożliwia zajście reakcji redoks.
- Oksydacja i redukcja: Procesy chemiczne, które pozwalają na powstanie i przepływ prądu elektrycznego przez ogniwo galwaniczne.
Solved Examples for You
Pytanie: W ogniwie galwanicznym, co by się stało, gdyby podczas zachodzenia reakcji redoks nie zastosowano mostka solnego?
Rozwiązanie: W przypadku braku mostka solnego wewnątrz każdego pojemnika zawierającego metale, reakcja redoks rozpoczęłaby się w bardzo podobny sposób. Jednak w przypadku braku mostka solnego, reakcja ta zakończyłaby się dość gwałtownie. Odpowiednie roztwory nie będą w stanie utrzymać swojej elektrycznej neutralności. Poza tym, nie będzie żadnych zmian w reakcji chemicznej ani żadnych zmian jakiegokolwiek typu z powodu braku mostka solnego lub medium.