Przegląd ogólny
Duża część mikroorganizmów nie tylko przebywa w nas, ale także żyje na nas. Rzeczywiście, ludzka skóra jest siedliskiem heterogenicznej mieszanki głównie niepatogennych bakterii, grzybów i wirusów, które prawdopodobnie przyczyniają się do zdrowia powierzchni skóry (rysunek 1). Propionibacterium acnes (P. acnes) jest wszechobecnym, wolno rosnącym, prętkokształtnym, nietworzącym zarodników, Gram-dodatnim beztlenowcem (Ryc. 2) występującym w różnych miejscach ciała, w tym w mieszkach łojowych twarzy i szyi (Funke i in., 1997; Grice i Segre, 2011; Findley i Grice, 2014). Jest on często uważany za część naszej mikrobioty komensalnej w miejscach barierowych (Cogen i in., 2008), która jest ustalana poprzez mechanizmy adaptacyjnej tolerancji immunologicznej we wczesnym okresie noworodkowym (Scharschmidt i in., 2015). Chociaż topograficzne rozmieszczenie anaerobów w miejscach łojotokowych jest znaczące, to przestrzenne i osobnicze rozmieszczenie P. acnes jest bardziej indywidualne niż site-specific (Oh i in., 2014). Co więcej, biogeografia i indywidualność P. acnes jest wysoce dynamiczna, ponieważ zmiany w stanie zdrowia lub zmiany pH, temperatury, wilgotności i/lub zawartości łoju mogą również wpływać na zakres nisz zajmowanych przez ten mikroorganizm (Grice i in., 2009). Podobnie jak w przypadku rozmieszczenia mikrobów skóry, warunki skórne mogą również kształtować funkcje P. acnes w zakresie ekspansji patogenów w chorobach. Na przykład, P. acnes został powiązany z uszkodzeniami skóry, takimi jak trądzik pospolity na twarzy i szyi oraz postępująca hipermelanoza plamista na plecach (Bojar i Holland, 2004; Kurokawa i in., 2009; Barnard i in., 2016). Ponadto, niektóre chorobotwórcze filotypy P. acnes mają zdolność do utrzymywania się na implantach ciała i urządzeniach chirurgicznych, powodując szeroki zakres pooperacyjnych stanów zakaźnych, takich jak zapalenie wsierdzia, endophthalmitis i wewnątrznaczyniowe zakażenia układu nerwowego (Perry i Lambert, 2011; Portillo i wsp., 2013). Niekorzystne cechy P. acnes obejmują również gruczoł krokowy, gdzie często odnotowywano inwazję tkanek i wewnątrzkomórkowe odkładanie się bakterii w komórkach nabłonka gruczołowego i krążących makrofagach; zjawisko to uważa się za pośrednio przyczyniające się do łagodnego przerostu gruczołu krokowego (BPH) i raka prostaty (Tanabe i in., 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016). Nie jest jednak jasne, jakie są podstawowe mechanizmy wykorzystywane przez P. acnes w celu wywołania infekcji, zapalenia i/lub przerzutów poza skórę. Wiadomo z całą pewnością, że zakażone bakteriami keratynocyty, sebocyty i/lub adipocyty wydzielają kilka chemokin i cytokin prozapalnych, a także czynniki antybakteryjne (np, katelicydyna) wskazujące na specyficzne mechanizmy chorobowe (Graham et al., 2004; Nagy et al., 2006; Lee et al., 2010; Zhou et al., 2015; Sanford et al., 2016; Yu et al., 2016).
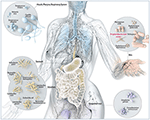
Rysunek 1. Schematyczna ilustracja powszechnych mikrobów występujących na miejscach barierowych u ludzi, w tym P. acnes. Chociaż P. acnes jest obecny na wszystkich powierzchniach zewnętrznych i wewnętrznych (tj. nabłonek jamy ustnej i przewodu pokarmowego, spojówki), to najbardziej rozpowszechniony jest na skórze człowieka. Tam bytuje w mieszkach włosowych twarzy i pleców, gdzie jest związany z powszechną chorobą skóry – trądzikiem pospolitym. Przez większość, P acnes jest nadal uważany za drobnoustrój głównie łagodny i komensalny, jednak doniesienia o jego złośliwej, oportunistycznej stronie są coraz częstsze. Adaptacja i za uprzejmą zgodą z Bryan Christie Design (http://bryanchristiedesign.com/).
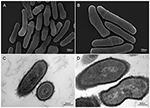
Rysunek 2. Obrazy w skaningowym i transmisyjnym mikroskopie elektronowym (SEM i TEM) szczepu P. acnes KPA (A, B = SEM; C, D = TEM). Ostatnie postępy w technikach izolacji i hodowli ujawniają, że infekcje P. acnes były rażąco niedoceniane, rzucając nowe światło na ten oportunistyczny gatunek bakterii. Mikroskopia Volker Brinkmann, Max Planck Institute for Infection Biology, Berlin, Niemcy. Scale bar = 200/300nm.
Sarkoidoza
Sarkoidoza jest chorobą o nieznanej etiologii, która prowadzi do zapalenia w narządach tak różnych jak płuca, wątroba, skóra i układy limfatyczne. Domniemany związek sarkoidozy z P. acnes został po raz pierwszy zaproponowany, gdy bakteria ta została wyizolowana ze zmian sarkoidalnych skóry i węzłów chłonnych (Eishi i in., 2002; Yamada i in., 2002). Wyniki te zostały znacząco potwierdzone (de Brouwer i in., 2015), a następnie rozszerzone przez różne eksperymenty in vitro wykazujące zdolność inwazyjną P. acnes w liniach komórkowych HEK293T (human embryonic kidney) i A549 (human alveolar epithelial carcinoma) (Tanabe i in., 2006). Najnowsze prace w płynie z płukania oskrzelowo-pęcherzykowego (BAL) i komórkach sarkoidalnych wykazały znaczącą regulację odpowiedzi immunologicznej specyficznej dla P. acnes (Schupp i in., 2015). Ponadto, eksperymenty na myszach wykazały, że żywe P. acnes mogą indukować ziarniniaki płucne podobne do tych obserwowanych u pacjentów z sarkoidozą (Werner i in., 2017). Ogólny przegląd szczegółowo opisujący związek między sarkoidozą a P. acnes jest ponadto podany przez Eishi (2013).
Badania próbujące scharakteryzować szlaki sygnalizacyjne aktywowane przez P. acnes podczas infekcji wykazały, że czynnik jądrowy-kappaB , czynnik transkrypcyjny, który reguluje ekspresję genów zaangażowanych w kaskady immunologiczne i zapalne, jest aktywowany przez P. acnes (Kim et al., 2002). W szerszym ujęciu, wykazano, że receptor toll-podobny 2 (TLR2) jest krytycznym receptorem dla zależnej od NF-κB odpowiedzi na P. acnes, ujawniając zdolność tej bakterii do prowokowania selektywnej aktywacji genów odporności wrodzonej (Inohara i Nuñez, 2001; Chamaillard i in., 2003; Moreira i Zamboni, 2012). Ponadto, zbadano rolę genetyki gospodarza w przypadkach sarkoidozy, które były związane z infekcją P. acnes. Polimorfizmy pojedynczych nukleotydów (SNPs) w domenie oligomeryzacji wiążącej nukleotydy (NOD) białek NOD1 i NOD2 były skorelowane z zakażeniem P. acnes wśród 73 pacjentów z sarkoidozą, 52 ze śródmiąższowym zapaleniem płuc i 215 zdrowych osób z grupy kontrolnej (Tanabe i in., 2006). NOD1 i NOD2 są wewnątrzkomórkowymi receptorami rozpoznającymi wzór, które mogą wyczuwać cząsteczki bakteryjne, takie jak cząsteczki peptydoglikanu. Podobnie, eksperymenty in vitro wykazały, że internalizacja P. acnes do komórek HEK293T może prowadzić do aktywacji NOD1 i NOD2, co sugeruje mechanizm chorobowy oparty na przewlekłym stanie zapalnym lub lokalnej immunosupresji (Tanabe i in., 2006). Wyniki te sugerują również, że inwazyjne P. acnes mogą działać jako ligandy bakteryjne powodujące nieprawidłową aktywację receptorów NOD u niektórych osób z długotrwałą podatnością na sarkoidozę. Jednakże, przyszłe eksperymenty muszą wyjaśnić dokładną chronologię mechanistyczną tego, czy lub jak P. acnes-mediated aberrant NF-κB activation may induce granuloma formation in a NOD1/NOD2-dependent manner.
Although invasive P. acnes could be a possible etiology of sarcoidosis and perhaps other diseases, elucidating causation and correlation between P. acnes i patologią jest niejasne, ponieważ heterogenność szczepów bakterii, genetyka gospodarza, jak również środowisko gospodarza muszą być brane pod uwagę zawsze, gdy badanie łączy mikrobiom ze stanem chorobowym.
Złośliwy przerost gruczołu krokowego (BPH) i rak gruczołu krokowego
Przewlekłe lub nawracające procesy zapalne są od dawna implikowane w progresji BPH i raka gruczołu krokowego (De Marzo i wsp., 1999; Nelson et al., 2004; Sfanos et al., 2014). Zapalenie przypisuje się obecności specyficznych biomarkerów, takich jak podwyższone stężenie interleukiny (IL)-6, czynnika martwicy nowotworów alfa (TNFα) oraz białka ostrej fazy, białka C reaktywnego (Mechergui i wsp., 2009; Menschikowski i wsp., 2013; Yu i wsp., 2015). Ostatnie prace dotyczące płynów urologicznych (tj. moczu, płynu nasiennego, wydzieliny gruczołu krokowego), jak również biopsji prostaty sugerują znaczące przesunięcie warunkowe w kierunku pewnych gatunków drobnoustrojów, które mogą być wykorzystane jako wskaźnik diagnostyczny (Yu i wsp., 2015; Ni i wsp., 2016).
Duża ilość prac sugeruje, że specyficzne powiązanie P. acnes z prostatą, a w szczególności inwazja komórek nabłonka prostaty (Rycina 3) może przyczyniać się do patologii BPH lub raka prostaty z komponentą zapalną (Sfanos i wsp., 2013; Davidsson i wsp., 2016). Jednak obecnie nie jest jasne, czy P. acnes reprezentuje prawdziwy czynnik zakaźny prostaty, komensala czy przypadkowy mikrobion prostaty. Jest prawdopodobne, że zlokalizowane w prostacie P. acnes pochodzą ze skóry, które zostały przypadkowo wprowadzone, na przykład podczas biopsji prostaty – co powinno budzić obawy w przypadku niektórych scenariuszy badań diagnostycznych.
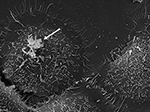
Rysunek 3. SEM szczepu P6 (strzałka) P. acnes in vitro na hodowanych komórkach nabłonka gruczołu krokowego RWPE1. Inwazyjność P. acnes w stosunku do komórek nabłonka prostaty jest dobrze udokumentowana zarówno w badaniach in vivo, jak i w badaniach na komórkach, gdzie prawdopodobny jest proces inwazji z udziałem wimentyny (Mak et al., 2012). Mikroskopia Volker Brinkmann, Max Planck Institute for Infection Biology, Berlin, Niemcy. Scale bar = 2 μm.
Niezależnie od drogi wniknięcia lub potencjału patogennego, znaczna liczba tkanek prostaty uzyskanych w wyniku resekcji przezcewkowej z powodu BPH lub radykalnej prostatektomii z powodu raka, była wcześniej badana pozytywnie na obecność agregatów P. acnes najwyraźniej rezydujących w wędrujących makrofagach (Alexeyev i in., 2007; Bae i in., 2014). Dodatkowe doniesienia oparte na próbkach ludzkich dostarczyły dalszych dowodów na związek między BPH lub rakiem prostaty a P. acnes przy użyciu różnych podejść technicznych, w tym hodowli, mikroskopii konfokalnej do wizualizacji bakterii i hybrydyzacji in situ, immunohistochemii (rysunek 4) i profilowania bakteryjnego 16S rRNA opartego na PCR (Hochreiter i in., 2000; Cohen i in., 2005; Sfanos i in., 2008; Fassi-Fehri i in., 2011; Bae i in., 2014; Davidsson i in., 2016). Dalsze dowody pochodzą z badań na zwierzętach wskazujących, że inokulacja P. acnes do prostaty i pęcherza moczowego u myszy lub szczurów prowadzi do jawnej, długotrwałej odpowiedzi zapalnej i szerokiego zakresu zaburzeń komórkowych w obrębie gruczołu krokowego (Olsson i in., 2012; Shinohara i in., 2013).
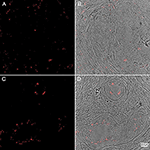
Rysunek 4. Immunohistochemia ludzkich próbek tkanki prostaty barwionych przeciwciałem P. acnes (czerwony). Zaadaptowano za zgodą Fassi-Fehri et al., 2011 (Supplementary Figure 2B). Obecność P. acnes w próbkach tkanki ludzkiej prostaty z łagodnym przerostem gruczołu krokowego (A,B); lub gruczolakorakiem (C,D). W obu przypadkach wykryto rozległe obciążenie bakteryjne.
Próby filogenetycznej analizy związanych z chorobą szczepów P. acnes pochodzących z gruczołów nowotworowych prostaty ujawniły, że większość izolatów z prostaty należy do kladów filogenetycznych, które są rzadkie na ludzkiej skórze, co wskazuje, że zanieczyszczenie pochodzące ze skóry podczas pobierania próbek jest mało prawdopodobne (Mak i in., 2013; Davidsson i in., 2016). W tym samym kierunku, podobne szlaki zapalne, jak te opisane dla sarkoidozy, w tym NF-κB, IL-6, STAT3 i COX2, wydają się być aktywowane przez P. acnes zarówno w warunkach in situ, jak i in vitro (Drott et al., 2010; Fassi-Fehri et al., 2011; Mak et al., 2013; Tsai et al., 2013; Bae et al., 2014). Chociaż dokładna etiologia tych zmian zapalnych nie jest jeszcze jasna, w układzie moczowo-płciowym ssaków szeroko rozpowszechnionych jest kilka związanych z błonami szlaków receptorów rozpoznawania wzorców, które chętnie rozpoznają składniki bakteryjne i wirusowe (Jorgensen i Seed, 2012; Gambara i in., 2013). Te receptory komórek gospodarza, na przykład TLRs, promują produkcję cytokin, która jest podstawową cechą wrodzonej odporności przeciwko patogenom mikrobiologicznym. Łącznie, wyniki te sugerują, że poprzez zdolność do wyzwalania różnych aspektów odporności, inwazyjne P. acnes mogą działać jako główny czynnik i/lub wzmacniacz ciężkości choroby.
Zapalenie krążka międzykręgowego i ból pleców
Jednym z kilku powikłań pooperacyjnych z udziałem P. acnes jest zapalenie krążka międzykręgowego i otaczającej go przestrzeni międzykręgowej (diskitis) po discektomii (Harris et al., 2005). Towarzyszące temu zwyrodnieniowe zakażenie sąsiednich kręgów (spondylodiscitis) może być częstą cechą i przyczyną poważnych uszkodzeń neurologicznych i bólu, jeśli leczenie jest opóźnione (Uçkay et al., 2010). Poza niezamierzonym chirurgicznym wprowadzeniem bezpośrednio do kręgosłupa, patogeny mogą również dostać się poprzez tętnicze i żylne ukrwienie kręgosłupa (rozprzestrzenianie hematogenne). Podczas gdy Staphylococcus aureus, Escherichia coli i Proteus species są najczęściej izolowane, P. acnes jest najliczniejszym beztlenowym patogenem w tym kontekście i prawdopodobnie jest niedostatecznie opisywany z powodu trudności w hodowli. Istnieją pewne dowody kliniczne, że u pacjentów z przepukliną jądra miażdżystego (nucleus pulposus) dysku zakażonego patogenami beztlenowymi w ogóle, a P. acnes w szczególności, częściej występuje zapalenie i obrzęk sąsiednich kręgów (zmiany Modica typu I) oraz ból pleców (Albert i in., 2013; Urquhart i in., 2015). Badania kliniczne i obserwacje na zwierzętach potwierdzają obecnie wstępne ustalenia wskazujące, że miejscowa proliferacja P. acnes powoduje upregulation markerów zapalnych i degenerację dysku zgodną ze zmianami Modica (Aghazadeh et al., 2016; Dudli et al., 2016). Obecnie istnieją nawet pierwsze dowody kliniczne sugerujące, że bakteryjne zakażenie dysku międzykręgowego bakteriami P. acnes i/lub Staphylococcus epidermidis może faktycznie poprzedzać wszystkie inne kwestie jako pierwotna przyczyna przepukliny dysku i związanych z nią zmian patologicznych (Rajasekaran i wsp., 2017).
Parkinson’s Disease (PD)
Zdegenerowany mózg charakteryzuje się uszkodzeniem układu nerwowego, które można przypisać nietypowej agregacji i odkładaniu zmutowanych lub błędnie sfałdowanych białek (np. ciał Lewy’ego i neurytów Lewy’ego), co wyraźnie udokumentowano w idiopatycznej PD (Taylor i in., 2002). Na ogół nie docenia się faktu, że mózg jest również podatny na inwazję patogenów, począwszy od wirusów i bakterii, a skończywszy na grzybach. Patogeny te, a dokładniej ich endogenne składniki i/lub metabolity, mogą wywoływać ośrodkowe deficyty neurologiczne, począwszy od subtelnych objawów otępienia i dystonii, które są wynikiem przewlekłej, nawracającej infekcji (De Chiara i in., 2012; Bibi i in., 2014), aż po cięższe choroby neuronów ruchowych, jak na przykład obserwowane w przypadku ludzkiego endogennego retrowirusa K (Li i in., 2015). Jest zatem jasne, że ludzie mają ogromne obciążenie systemowe mikrobami (Potgieter i in., 2015; Spadoni i in., 2015), które mogą przypadkowo przyczyniać się do patologii postępujących chorób neurodegeneracyjnych z atypowym komponentem białkowym. Z pewnością ta hipoteza robocza zyskuje znaczące wsparcie, ponieważ wydaje się, że na zachowania poznawcze, emocjonalne lub patologiczne pośrednio wpływa przestrzenna i osobnicza dystrybucja mikrobów działających poprzez oś jelito-mózg (Rycina 5) (Collins i wsp., 2012; Dinan i wsp., 2013; Mayer i wsp., 2014; Burokas i wsp., 2015). Rzeczywiście, ostatnie badanie case-control wykazało, że zmienność mikrobiologiczna w przewodzie pokarmowym, zarówno między osobami, jak i w obrębie osobników; odpowiada w największym stopniu zmienności fenotypowej w PD (Scheperjans i in., 2015; Vizcarra i in., 2015). Chociaż podstawowe mechanizmy łączące skład mikrobioty z różnicami w PD nie są jasne, powyższe odkrycie może przynajmniej wyjaśniać wysoką częstość występowania nieprawidłowości żołądkowo-jelitowych obserwowanych u pacjentów z PD (Dobbs i in., 2016). Dalej łącząc mikrobiotę z ciężkością PD, biopsje błony śluzowej esicy i materiał kałowy pobrany od pacjentów z PD wykazały obecność oportunistycznych i prozapalnych gatunków bakterii, które często powodują przewlekłe zaparcia, zespół jelita drażliwego i wrzodziejące zapalenie jelita grubego (Keshavarzian et al., 2015). Łącznie, te wstępne wyniki sugerują, że relacje między różnymi społecznościami bakteryjnymi w jelitach są powszechną współchorobowością w PD, i że unikalne indywidualne sygnatury ekosystemu jelitowego mogą wzmacniać klasyczne upośledzenia ruchowe PD.
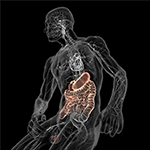
Rysunek 5. Schematyczna ilustracja osi jelita-mózg (pokolorowana) z wypełnionym mikrobami układem pokarmowym na jednym końcu i mózgiem z jego ośrodkami homeostazy (podwzgórze i przysadka) na drugim. Oba są połączone poprzez sercowo-naczyniowy i autonomiczny układ nerwowy, w tym nerw błędny (nerw czaszkowy X), który mógłby ułatwić mikrobom przejście do ośrodkowego układu nerwowego (OUN). Kindly z pozwoleniem od Bryan Christie Design (http://bryanchristiedesign.com/).
Against to tło, pytanie by być zadane jest czy jest jakikolwiek dowód , że P. acnes gra jakąkolwiek rolę w patofizjologii PD. Aby taka możliwość zaistniała, muszą być spełnione dwa warunki: (1) zakażenie P. acnes musi poprzedzać wystąpienie klasycznych objawów choroby, takich jak drżenie, inicjacja ruchowa i spowolnienie ruchów; oraz (2) inokulacja P. acnes musi w wystarczającym stopniu wywoływać objawy PD i/lub prowadzić do utraty neuronów projekcyjnych dopaminy w jądrze śródmózgowia znanym jako substantia nigra pars compacta. Jak dotąd, nasze laboratorium wykryło skupiska P. acnes zlokalizowane w neuronach śródmózgowia i pobliskich strukturach korowych w mózgach chorych na PD poddanych autopsji (Rycina 6). To nieoczekiwane odkrycie dodatkowo uwiarygodnia tezę, że P. acnes pośrednio przyczyniają się do lokalnych wybuchów zapalenia, podobnych do tych obserwowanych w sarkoidozie i BPH. Otwartą kwestią pozostaje zakres, w jakim P. acnes może pośrednio wzmacniać niektóre cechy patologiczne PD. Ponieważ PD jest zaburzeniem wysoce heterogennym, jest mało prawdopodobne, aby jeden mechanizm chorobowy miał zastosowanie do wszystkich fenotypów PD. Niemniej jednak, intrygujące są spekulacje, że mikroby zamieszkujące skórę mogą inicjować lub wzmacniać progresję PD poprzez czynniki zapalne i/lub genetyczne predyspozycje.

Rysunek 6. Immunohistochemia ludzkich próbek tkanki śródmózgowia PD barwionych na P. acnes (zielony; A+B), mikrotubule neuronalne (MAP2; czerwony; A) i jądra (DAPI; niebieski; A+B). Związaną z wiekiem autofluorescencję lipofuscyny wygaszono czernią sudanową B. Obecność P. acnes (strzałka) w przestrzeni peryplazmatycznej ludzkiego neuronu (A) między jądrem (n) a cytoszkieletem; lub neutrofila (B) z charakterystycznym wielopłatkowym jądrem wewnątrz kapilary śródmózgowia (Cap). Odkrycia te są typowe dla PD i nieobecne w większości przekrojów kontrolnych. Ruchy wsteczne wzdłuż nerwów czaszkowych, mikrokrwawienia wywołane urazem, jak również nowo odkryty układ limfatyczny stanowią potencjalne drogi drobnoustrojów do OUN.
Jeśli P. acnes może uzyskać dostęp do komórek dopaminergicznych w śródmózgowiu, jaka jest najbardziej prawdopodobna droga inokulacji i infekcji? Mimo, że skóra jest fizycznie oddzielona od mózgu, krzyżowa inokulacja pozostaje czynnikiem ryzyka. Na przykład, w jamie nosowej mogą potencjalnie znajdować się patogenne szczepy P. acnes, które następnie translokowałyby się do miąższu mózgu w celu nadaktywności miejscowych makrofagów zwanych mikroglejem; zjawisko to jest stałą cechą patologii PD (omówione przez Chao i in., 2014). Badania nad zakażeniami szpitalnymi wykazują, że gatunki bakterii tak różne jak Pneumococcus sp. (Zwijnenburg i wsp., 2001) i Salmonella sp. (Bollen i wsp., 2008) łatwo wędrują wzdłuż nerwu węchowego (nerw czaszkowy 1; CN 1) i ostatecznie do opuszki węchowej. Inną potencjalną drogą wejścia dla szkodliwych mikroorganizmów lub niebezpiecznych, źle złożonych białek jest nerw błędny (nerw czaszkowy 10; CN 10). Rzeczywiście w pewnych okolicznościach błędnie uformowane agregaty w postaci ciał Lewy’ego i neurytów Lewy’ego wydają się migrować z nerwu błędnego do mózgu, dostarczając kolejnych dowodów na to, że patogenne bakterie w połączeniu z toksycznymi białkami mogą potencjalnie przyczyniać się do selektywnej podatności neuronów (Holmqvist i in., 2014). Co ciekawe, jądra mózgu CN 1 i CN 10 są jednymi z pierwszych miejsc, w których preferencyjnie wykazuje się odkładanie ciał Lewy’ego i neurytów Lewy’ego w przebiegu progresji PD (Braak i in., 2004). Ta szczególna obserwacja nie tylko podkreśla prawdopodobną drogę wejścia bakterii do mózgu, ale także dostarcza potencjalnego mechanizmu dla obserwacji, że wagotomia pniowa znacząco zmniejsza ryzyko PD (Svensson i in., 2015). Związek między urazem głowy a PD (Harris i in., 2013; Jafari i in., 2013; Pearce i in., 2015), wraz z pojęciem zróżnicowanego mikrobiomu krwi (Potgieter i in., 2015), implikuje ogromny potencjał dla patogennego oportunizmu, gdy dochodzi do traumatycznych naruszeń bariery krew-mózg. Wraz z niedawnym odkryciem mózgowego układu limfatycznego (glymphatic) (Iliff et al., 2012; Hitscherich et al., 2016) należy rozważyć kolejną potencjalną drogę zakażenia mózgu.
Podsumowując, istnieją przedkliniczne i niektóre kliniczne dowody pośrednio wskazujące na P. acnes jako niezależną zmienną wpływającą na występowanie lub nasilenie PD. Dowody te są uzupełnione doniesieniami o powiązaniu poważnego zaburzenia skórnego, trądziku odwróconego, z chorobą Alzheimera (Wang i in., 2010). Z perspektywy terapeutycznej, możliwość wywoływania lub wzmacniania przez P. acnes podstawowych cech PD stanowi ważne źródło dla antybiotykowych podejść do chorób neurodegeneracyjnych. A z perspektywy badawczej warto byłoby dokładniej zbadać pacjentów z chorobami skóry pod kątem dowodów neuropatologii o wcześniejszym początku i cięższym fenotypie choroby.
Perspektywy na przyszłość
Przegląd przedstawiony w tym artykule zarysowuje nieoczekiwaną ciemną stronę P. acnes w odniesieniu do patologii. Wewnątrzkomórkowe utrzymywanie się P. acnes jest związane z chorobami płuc, gruczołu krokowego i prawdopodobnie mózgu. Jest to wyraźny dowód na patogenność bakterii pochodzących ze skóry w pewnych fenotypach chorobowych. Dalsze badania będą musiały skupić się na kilku nurtujących pytaniach dotyczących biologii P. acnes: (1) jakie są kluczowe interakcje P. acnes w podatności na choroby? (2) Jakie są mechanizmy wykorzystywane przez P. acnes do wpływania na postęp choroby? (3) Jeżeli pewne populacje P. acnes mogą zwiększać podatność na ciężkość choroby, to czy istnieją inne konfiguracje P. acnes, które działają ochronnie? (4) Dowód koncepcji, że infekcja P. acnes bezpośrednio wiąże się z patologią choroby, lub bardziej szczegółowo, czy badanie koncepcji wykazuje związek przyczynowy czy tylko korelację? I wreszcie (5) Czy patologia choroby wywołana przez P. acnes może być leczona za pomocą konwencjonalnej antybiotykoterapii i aplikacji diagnostycznych?
Wkład Autorów
JL, KER, JC, KR, CH, AM, HB i GT przygotowali manuskrypt. JL i MS przygotowali ryciny.
Funding
Wewnętrzne finansowanie dla JL zostało zapewnione przez NYIT College of Osteopathic Medicine.
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.