Acetylacja odnosi się do reakcji, która wprowadza acetylową grupę funkcyjną do związku chemicznego, w którym atom wodoru grupy hydroksylowej jest zastąpiony przez grupę acetylową (CH3 CO), aby uzyskać specyficzny ester, octan. Acetylacja białek powszechnie występuje w dwóch różnych formach. U ludzi, prawie (80%-90%) białka ulegają ko-translacyjnej acetylacji na ich Nα-końcach powstających łańcuchów polipeptydowych. Innym typem jest acetylacja na resztach lizyny.
Acetylacja N-końcowa
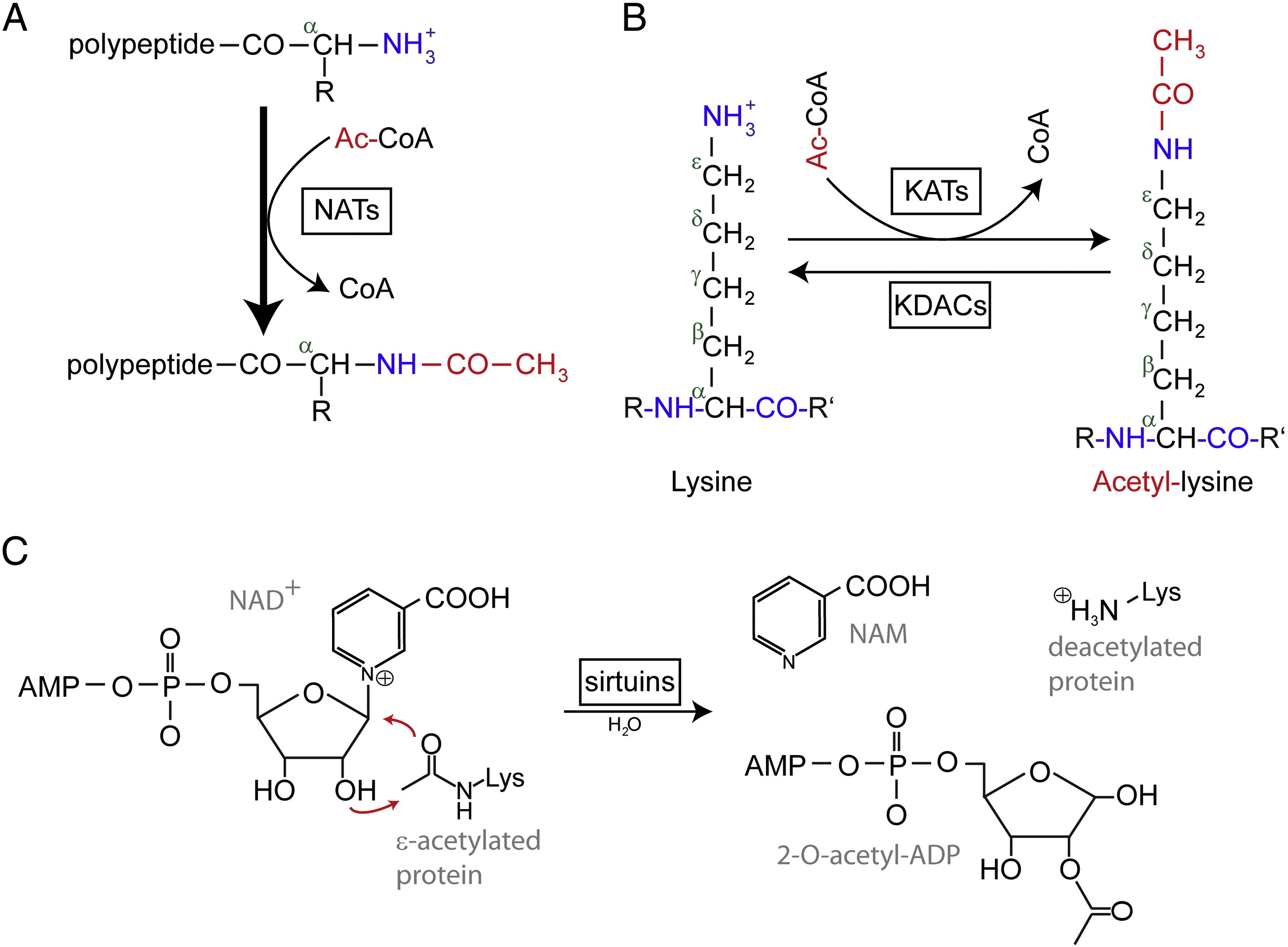
Acetylacja N-końcowa (Nt) jest katalizowana przez Nt-acetylotransferazy (NATs) i jak dotąd uznawana jest za nieodwracalną. NATs, jedno- lub wielopodjednostkowe enzymy składaj±ce się z podjednostki katalitycznej i do dwóch podjednostek pomocniczych, mog± przenosić grupę acetylow± z acetylo-koenzymu A (Ac-CoA) na grupę α-aminow± pierwszej reszty aminokwasowej białka. W NATs główna podjednostka pomocnicza moduluje aktywność i specyficzność substratową podjednostki katalitycznej. Za acetylację Nt odpowiedzialne są różne NAT. U ludzi do tej pory odkryto sześć NAT, w tym NatA, NatB, NatC, NatD, NatE i NatF. Oprócz różnicy w składzie podjednostek, różne NAT różnią się w swoich specyficznościach substratowych.
Acetylacja Nt odgrywa różne role w efektach molekularnych. Po pierwsze, Nt-acetylacja określa lokalizację subkomórkową dla niektórych białek. Na przykład, Arl3 i Grh1, dwa białka związane z Golgim, nie mogą kojarzyć się z aparatem Golgiego, gdy brakuje grupy Nt-acetylowej. Po drugie, donosi się, że Nt-acetylacja zatrzymuje białka w cytozolu i hamuje potranslacyjną migrację translokacyjną do retikulum endoplazmatycznego (ER) i szlaku sekrecyjnego. Ponadto, acetylacja Nt może zmieniać wła¶ciwo¶ci N-końca, przez co oddziaływania białko-białko ulegaj± modulacji. W przypadku kilku białek wykazano, że po acetylacji Nt wzrasta ich powinowactwo do partnerów wiążących. Na przykład, enzym sprzęgający ubikwitynę E2 Ubc12 ulega Nt-acetylacji przez NatC, co umożliwia zwiększenie powinowactwa do jego partnera interakcji, ligazy ubikwitynowej E3 Dcn1. Ponadto, Nt-acetylacja kontroluje jakość i żywotność białek oraz reguluje stechiometrię białek poprzez ścieżkę N-end rule.
N-końcowa acetylacja ma wiele funkcji w fizjologii. NATs są niezbędne dla prawidłowego rozwoju, rozwoju kości i naczyń krwionośnych. N-końcowa acetylacja może regulować ciśnienie krwi, lokalizacja proteasomu, hormonów, jak również struktury organelli i funkcji. W chorobach człowieka, to związane z chorobami neurodegeneracyjnymi (takich jak choroba Alzheimera, choroba Parkinsona, i otępienie z ciałami Lewy’ego) i nowotworami (jak rak płuc, rak piersi, rak jelita grubego).
Acetylacja lizyny
Cetylowane reszty lizyny zostały po raz pierwszy odkryte w histonach regulujących transkrypcję genów. Ale acetylacja lizyny nie jest ograniczona do histonów. W przeciwieństwie do acetylacji Nt, acetylacja lizyny jest odwracalna. Acetylacja jest katalizowana przez acetylotransferazy lizyny (KATs), a deacetylacja reszt lizyny jest katalizowana przez deacetylazy lizyny (KDACs).
Donoszono, że w ludzkim genomie zidentyfikowano 17-22 genów KAT (dokładna liczba KAT jest kontrowersyjna), które można zaklasyfikować do trzech różnych rodzin, w tym rodziny GCN5 (general control non-derepressible 5)-związanej z acetylotransferazą (GNAT), rodziny MYST i rodziny p300/CBP (CREB-binding protein). Znanymi substratami kompleksów KAT s± nie tylko białka histonowe, ale także różne czynniki transkrypcyjne, koregulatory transkrypcji oraz białka specyficznych komórkowych szlaków sygnałowych, takie jak p53, β-katenina, NF-κB, MyoD czy Rb. A nawet niektóre cząsteczki RNA mogą być acetylowane. Istnieją cztery różne typy KDAC, w tym klasa I, II, III i IV. Klasa I, II i IV są Zn2 +-zależnymi amidohydrolazami, podczas gdy klasa III (zwana również sirtuinami) używa NAD+ jako współsubstratu do swojej aktywności katalitycznej są Zn2 +-zależnymi amidohydrolazami.
Histony są pierwszymi odkrytymi acetylowanymi białkami. Cząsteczki histonów są modyfikowane przez różne PTM, w tym fosforylację, metylację i acetylację. acetylacja histonów, determinuje składanie histonów, jak również składanie i zwartość interakcji DNA-histony, a zatem stanowi przełącznik między permisywną i represywną strukturą chromatyny. Poza histonami, KAT mog± katalizować białka cytoszkieletowe. Istnieją pewne nowe zidentyfikowane miejsca acetylacji w innych białkach, w tym białkach HMG, c-Myc, receptorach estrogenowych i androgenowych, E2F/Rb i tak dalej.
Zgłaszano fizjologiczne role acetylacji lizyny. Białka histonowe są związane z ścisłą regulacją zasadniczo wszystkich rodzajów procesów DNA-szablonowych, jak transkrypcja, replikacja, rekombinacja, naprawa, jak również tłumaczenie i tworzenie wyspecjalizowanych struktur chromatyny. Dlatego też acetylacja lizyny białek wpływa na szereg komórkowych szlaków sygnałowych, jak również na metabolizm, reakcje na stres, apoptozę i handel błonami.
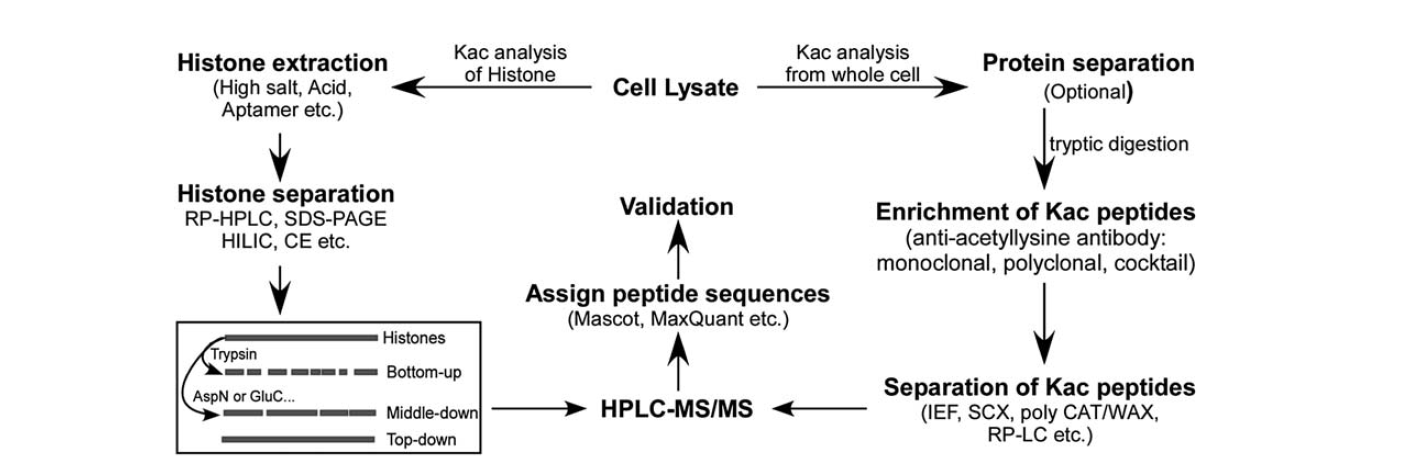
Dostępnych jest stosunkowo niewiele narzędzi do identyfikacji acetylacji lizyny. Wraz z rozwojem spektrometrii mas, stała się ona ważnym narzędziem do identyfikacji i kwantyfikacji acetylacji lizyny. Analiza acetylacji lizyny histonów obejmuje kilka etapów, w tym lizat komórkowy, ekstrakcję histonów, separację histonów, spektrometrię mas i analizę danych. Etapy analizy acetylacji lizyny białek z całej komórki obejmują lizat komórkowy, separację białek, wzbogacanie peptydów acetylacji lizyny, separację peptydów acetylacji lizyny, spektrometrię masową i analizę danych.
.