
Kiedy gazowy chlor jest wydmuchiwany przez butlę z sokiem pomidorowym, mieszanina chloru i soku pomidorowego zmienia się prawie całkowicie w biel w ciągu pięciu minut. Ta spektakularna zmiana jest wynikiem chemicznego działania chloru, działającego jako utleniający środek wybielający, na pigmenty w soku pomidorowym. Kiedy stare wycinki z gazet, odbarwione w wyniku starzenia się i ekspozycji na światło, są traktowane 1 procentowym wodnym roztworem borohydryku sodu, papier ulega radykalnemu wybieleniu w ciągu dwudziestu minut. W tym przypadku, papier został przywrócony do swojego pierwotnego białego koloru przez działanie borohydryku sodu działającego jako redukujący środek wybielający.
Środek wybielający to substancja, która może wybielać lub odbarwiać inne substancje. Kolorowe substancje zazwyczaj zawierają grupy atomów, zwane chromoforami, które mogą pochłaniać światło widzialne o określonej, charakterystycznej długości fali i odbijać lub przekazywać część światła, która nie jest pochłaniana. Na przykład, jeśli chromofor absorbuje światło niebieskie, będzie odbijał światło koloru uzupełniającego, a substancja zawierająca chromofor będzie wydawała się żółta. Środki wybielające zasadniczo niszczą chromofory (usuwając w ten sposób kolor), poprzez utlenianie lub redukcję tych grup absorpcyjnych. Tak więc, wybielacze mogą być klasyfikowane jako środki utleniające lub redukujące.
Niektóre z zastosowań środków wybielających to:
- Wybielanie tekstyliów i tkanin
- Wybielanie masy drzewnej
- Usuwanie plam
- Pranie i czyszczenie komercyjne i domowe
- . Jako składniki środków czyszczących do szorowania i produktów do mycia naczyń
- Wybielanie włosów
Wybielacze utleniające
Duża liczba wybielaczy utleniających została przejrzana przez Julesa A. Szilard w Bleaching Agents and Techniques (1973). Utleniające wybielacze (i środki wybielające) w powszechnym użyciu to: chlor, dwutlenek chloru, alkaliczne podchloryny, nadtlenek wodoru, związki nadtlenowe oraz światło słoneczne i sztuczne.
Chlor (Cl 2 ). Odkrycie chloru przez szwedzkiego chemika Carla Wilhelma Scheele w 1774 roku zapoczątkowało nowoczesną erę wybielania. Jak podaje Sidney M. Edelstein w artykule z 1948 roku zatytułowanym „The Role of Chemistry in the Development of Dyeing and Bleaching”, francuski chemik Claude-Louis Berthollet jako pierwszy użył chloru do wybielania bawełny i lnu.
Chlor był stosowany do bielenia masy drzewnej. Wiele celulozowni stosujących proces rozwłókniania Krafta przygotowuje wodorotlenek sodu (potrzebny do trawienia wiórów drzewnych) na miejscu poprzez elektrolizę solanki, stężonego wodnego roztworu chlorku sodu.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Chlor jest produktem ubocznym. Dalsze bielenie chlorem brązowej masy celulozowej daje produkt, który może być stosowany do produkcji papieru do pisania i drukowania. Niestety, związki organiczne zawarte w masie papierniczej ulegają zarówno utlenieniu, jak i chlorowaniu, dając niewielkie ilości związków chloroorganicznych, w tym
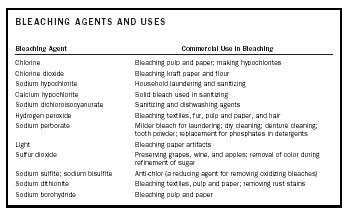
| ŚRODKI WYBIELAJĄCE I ICH UŻYTKOWANIE | |
| Środek wybielający | Zastosowanie handlowe w wybielaniu |
| Chlor | Wybielanie masy celulozowej i papieru; Wytwarzanie podchlorynów |
| Dwutlenek chloru | Wybielanie papieru siarczanowego i mąki |
| Podchloryn sodu | Pranie i odkażanie w gospodarstwach domowych |
| Podchloryn wapnia podchloryn | Wybielacz stały stosowany w sanityzacji |
| Dichloroizocyjanuran sodu | Środki do sanityzacji i zmywania naczyń |
| Nadtlenek wodoru | Wybielanie tekstyliów, futer, celulozy i papieru oraz włosów |
| Nadboran sodu | Łagodniejsze wybielacze do prania; czyszczenie na sucho; czyszczenie protez; proszek do zębów; zamiennik fosforanów w detergentach |
| Światło | Wybielanie artefaktów papierowych |
| Dwutlenek siarki | Konserwowanie winogron, wina i jabłek; usuwanie koloru podczas rafinacji cukru |
| Siarczyn sodu; wodorosiarczyn sodu | Anty-chlor (środek redukujący do usuwania utleniających wybielaczy) |
| Ditionit sodu | Wybielanie tekstyliów, masy celulozowej i papieru; usuwanie plam z rdzy |
| Borohydryd sodu | Wybielanie pulpy i papieru |
dioksyny. W rzeczywistości, najbardziej rozpowszechniona dioksyna wytwarzana w procesie bielenia masy celulozowej i papieru, 2,3,7,8-tetrachlorodibenzo- p-dioksyna (2,3,7,8-TCDD), została uznana zarówno za czynnik rakotwórczy, jak i śmiertelną toksynę. Dlatego też chlor jako środek wybielający jest zastępowany przez bezpieczniejsze środki wybielające – dwutlenek chloru i nadtlenek wodoru. W rzeczywistości, trend w przemyśle celulozowym i papierniczym zmierza w kierunku bielenia całkowicie bezchlorowego (TCF). Chlor jest obecnie używany w przemyśle bielącym głównie do przygotowywania roztworów podchlorynu i suchych wybielaczy, takich jak podchloryn wapnia.
Dwutlenek chloru (ClO 2 ). Dwutlenek chloru był stosowany jako środek wybielający zarówno w fazie gazowej, jak i w roztworze wodnym. Ze względu na jego wybuchowy charakter, dwutlenek chloru w fazie gazowej jest często rozcieńczany azotem lub dwutlenkiem węgla. W przypadku przechowywania lub transportu, dwutlenek chloru jest przepuszczany przez zimną wodę i przechowywany w warunkach chłodniczych.
Dwutlenek chloru jest otrzymywany przemysłowo przez redukcję chloranu sodu dwutlenkiem siarki w roztworze wodnym.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
Stosunkowo bezpieczna metoda otrzymywania ClO 2 polega na reakcji chloranu sodu (NaClO 2 ) z formaldehydem (H 2 CO).
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
W miarę przebiegu reakcji 3 spada pH roztworu (w wyniku wytwarzania kwasu mrówkowego ). Wzrost kwasowości roztworu sprzyja tworzeniu się ClO 2 , co przedstawia równanie 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
W kwaśnym roztworze dwutlenek chloru zachowuje się jak utleniacz. Całkowitą redukcję ClO 2 przedstawia równanie 5.
ClO 2 + 4H + + 5 e – → Cl – + 2H 2 O (5)
W poszczególnych etapach tej ogólnej reakcji redukcji powstają HClO 2 , HOCl i Cl 2 , które zachowują się jak utleniacze. Wymagane jest kwaśne środowisko, ponieważ ClO 2 ulega dysproporcjonowaniu w roztworze alkalicznym, jak pokazano w równaniu 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Dwutlenek chloru jest stosowany głównie do bielenia masy papierniczej.
Podchloryny (OCl – ). Roztwory wybielaczy podchlorynowych są wytwarzane z NaOCl i, w mniejszym stopniu, z Ca(OCl) 2 . Podchloryny są stosowane w praniu, jako środki dezynfekujące, w bieleniu masy celulozowej i tekstyliów oraz w usuwaniu tuszu z papieru makulaturowego. Handlowe roztwory wybielające są otrzymywane przez przepuszczenie gazowego chloru przez zimny, rozcieńczony, wodny wodorotlenek sodu, jak pokazano w równaniu 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternatywnie, jon podchlorynu może być generowany przez hydrolizę organicznych związków azotowo-chlorowych. Niektóre z ważniejszych związków azotu i chloru używanych w ten sposób są chlorowane izocyjanurany. Znajdują one zastosowanie w produktach czyszczących i zmywarkach do naczyń.
Aby być skutecznym wybielaczem, roztwór podchlorynu powinien być utrzymywany w stanie alkalicznym (pH > 9,0), w celu zahamowania hydrolizy OCl – (patrz równanie 8) i zapobieżenia tworzeniu się niestabilnego HOCl.
OCl – + H 2 O → HOCl + OH – (8)
W roztworach kwaśnych tworzy się i rozkłada HOCl.
3HOCl → HClO 3 + 2HCl (9)
HOCl będzie również reagował z HCl, jednym z produktów rozkładu.
HOCl + HCl → H 2 O + Cl 2 (10)
Roztwory wybielające podchlorynu nie mogą zawierać kationów metali ciężkich, ponieważ kationy te (podobnie jak światło lub ciepło) sprzyjają rozkładowi HOCl, jak pokazano w równaniu 11.
2HOCl → 2HCl + O 2 (11)
Aktywne składniki wybielaczy podchlorynowych zmieniają się w zależności od pH. Przy pH < 2, Cl 2 jest głównym składnikiem w roztworze; przy pH 4 do 6, HOCl jest dominującym gatunkiem; przy pH > 9, OCl – jest jedynym składnikiem obecnym. Jest to jon podchlorynu w roztworze podstawowym, który jest aktywnym składnikiem wybielaczy domowych, który jest zwykle około 5 do 6 procent NaOCl. Jon OCl utlenia chromofory w kolorowych materiałach, a sam jest redukowany do jonów chlorkowych i wodorotlenkowych.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Proces wybielania przeprowadzany przez komercyjne wybielacze podchlorynowe jest często wzmacniany przez zastosowanie rozjaśniaczy optycznych, związków, które absorbują padające światło ultrafioletowe i emitują światło widzialne, dzięki czemu tkanina wydaje się jaśniejsza i bielsza.
Nadtlenek wodoru (H 2 O 2 ) . Nadtlenek wodoru może być przygotowany przez reakcję nadtlenku baru i kwasu siarkowego (patrz równanie 13). Ponieważ wytrąca się siarczan baru, łatwo oddziela się nadtlenek wodoru.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Nadtlenek wodoru, jako środek wybielający stosowany w przemyśle celulozowym i papierniczym, ma tę zaletę, że nie zanieczyszcza środowiska. Ze względu na niestabilność czystego nadtlenku wodoru, do bielenia stosuje się roztwory wodne. W temperaturze pokojowej, nadtlenek wodoru bardzo powoli rozkłada się na wodę i tlen.
2H 2 O 2 → H 2 O + O 2 (14)
Jednakże obecność kationów metali przejściowych (w szczególności Fe 3+ , Mn 2+ , i Cu 2+ ) i innych katalizatorów gwałtownie przyspiesza tę reakcję. W rezultacie, wodny nadtlenek wodoru musi być stabilizowany środkami kompleksującymi, które sekwestrują kationy metali przejściowych.
Aktywnym gatunkiem wybielającym w nadtlenku wodoru jest anion perhydroksylowy , OOH – , powstający w wyniku jonizacji H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
Stała jonizacji kwasowej nadtlenku wodoru jest bardzo niska ( K a = 2 × 10 -12 ), co powoduje, że roztwory H 2 O 2 muszą być alkaliczne, aby

aby podnieść stężenie OOH – . W przypadku braku medium alkalicznego, nadtlenek wodoru nie jest już skuteczny jako środek wybielający. Na przykład, na etapie wybielania podczas farbowania włosów często stosuje się nadtlenek wodoru (5-6%), ale także amoniak w celu zapewnienia środowiska alkalicznego.
Jednocześnie pH nie może wzrosnąć powyżej 11, ponieważ w tym momencie zaczyna zachodzić rozkład OOH -.
2OOH – → O 2 + 2OH – (16)
Związki nadtlenowe. Istnieje szereg stałych związków nadtlenowych, które po rozpuszczeniu w wodzie wydzielają nadtlenek wodoru. Należą do nich nadboran sodu (NaBO 3 z 4H 2 O lub NaBO 2 z H 2 O 2 z 3H 2 O) i nadtlenohydrat węglanu sodu (2Na 2 CO 3 z 3H 2 O 2 ). Struktura nadboranu sodu zawiera peroksoanion B 2 (O 2 ) 2 (OH) 4 2- , który zawiera dwa wiązania O-O łączące dwie tetraedryczne grupy BO 2 (OH) 2-. Te związki peroksygenowe są stosowane w detergentach, środkach do czyszczenia protez i proszkach do zębów.
Wybielanie światłem. Wybielanie, które obejmuje albo naturalne światło słoneczne lub sztuczne światło było używane do usuwania plam z artefaktów papierowych i do obróbki tkanin. Materiał, który ma być wybielony jest najpierw zanurzany w alkalicznym roztworze wodorowęglanu wapnia lub magnezu, a następnie chroniony przed promieniowaniem ultrafioletowym przez przykrycie go pleksiglasem, Lexanem lub Mylarem. Ekspozycja na światło jest następnie dozwolona przez dwie do czterech godzin w przypadku naturalnego światła słonecznego i dwie do dwunastu godzin w przypadku światła sztucznego.
Wybielacze redukujące
Środki redukujące stosowane w bieleniu obejmują siarczyny, dwusiarczyny, ditionity i borohydryd sodu, z których wszystkie są stosowane w bieleniu masy celulozowej i tekstyliów.
Siarczyny (SO 3 2- ) i wodorosiarczyny (HSO 3 – ). Stan utlenienia siarki zarówno w SO 3 2- jak i HSO 3 – wynosi +4, a utlenianie do +6 zachodzi łatwo, z utworzeniem odpowiednio SO 4 2- i HSO 4 – , co czyni siarczyny i dwusiarczyny dobrymi środkami redukującymi.
Ditionity (S 2 O 4 2- ) . Zarówno ditionit sodu, jak i ditionit cynku znalazły zastosowanie w bieleniu mechanicznych mas celulozowych i tekstyliów. Otrzymywanie jonu ditionitowego odbywa się poprzez redukcję jonu wodorosiarczynowego i ditlenku siarki za pomocą pyłu Zn.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
Jon ditionitowy, S 2 O 4 2- , który ma siarkę w stanie utlenienia +3, zachowuje się jako silny środek redukujący w roztworze alkalicznym.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
Wraz z obniżaniem pH spada siła redukująca jonu ditionitowego, co przewiduje zasada LeChateliera.
Ditionity są użyteczne w usuwaniu plam rdzy, a neutralne roztwory cytrynianowe Na 2 S 2 O 4 były używane do usuwania produktów korozji żelaza z przedmiotów odzyskanych z Titanica.
Borohydryd sodu (NaBH 4 ). Borohydryd sodu znalazł zastosowanie głównie w przemysłowym bieleniu mas mechanicznych. Jon BH 4 – jest silnym środkiem redukującym w roztworze alkalicznym.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Jednym z problemów przy stosowaniu borohydryku sodu jest to, że jon BH 4 – powoli rozkłada się w roztworze wodnym.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Jako alternatywną metodę, sole BH 4 – można rozpuścić w CH 3 OH lub mniej toksycznym C 2 H 5 OH. Rozkład jonów BH 4 – w alkoholach zachodzi znacznie wolniej:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Wniosek
Środek wybielający może wybielić lub odbarwić substancję poprzez reakcję z chromoforami, które są odpowiedzialne za barwę substancji. W zależności od natury chromoforów, środek wybielający będzie albo środkiem utleniającym albo redukującym. Oznacza to, że chromofor jest albo utleniany, albo redukowany w celu uzyskania bezbarwnej lub wybielonej substancji. Środki wybielające i ich zastosowania handlowe są podsumowane w Tabeli 1.