Mięsak naczynioruchowy skóry ma jedno z najgorszych rokowań wśród wszystkich nowotworów skóry. Jest bardzo agresywny i ma wysoki wskaźnik nawrotów miejscowych. Według większości badań 5-letnie przeżycie wynosi od 12% do 34%,1,2 ale może sięgać nawet 62%.3 W przeciwieństwie do innych mięsaków, stopień zróżnicowania nie ma związku z rokowaniem w przypadku naczyniakomięsaka skórnego.4
Klasyczna postać naczyniakomięsaka skórnego jest nieokreśloną, sinoczerwoną, obrzękową zmianą o łagodnym przebiegu klinicznym we wczesnych fazach. Występuje na twarzy lub skórze głowy u starszych pacjentów (mięsak naczynioruchowy Wilsona-Jonesa) i stanowi około 50% wszystkich pierwotnych skórnych mięsaków naczynioruchowych.5-8 Dwie inne typowe postacie mięsaka naczynioruchowego to zespół Stewarta-Trevesa, który rozwija się w obszarach długotrwałego obrzęku limfatycznego i jest szczególnie częsty u kobiet po radykalnej mastektomii,9-11 oraz mięsak naczynioruchowy popromienny, który rozwija się w obszarach skóry napromienianej, szczególnie w okolicy piersi u kobiet z rakiem piersi leczonych radioterapią.12-Wygląd histopatologiczny skórnych naczyniakomięsaków waha się od form względnie zróżnicowanych z rozpoznawalnymi przestrzeniami naczyniowymi pokrytymi widocznymi komórkami śródbłonka z pewną atypią i wzorem naciekania przecinającym wiązki kolagenowe do bardziej litych, wysoce niezróżnicowanych form złożonych z komórek wrzecionowatych lub nabłonkowatych ze znacznie większą atypią i pleomorfizmem oraz większą liczbą mitoz. Przestrzenie naczyniowe są rzadkie, a guzy mogą czasami imitować raka.
Podstawową metodą leczenia skórnych naczyniakomięsaków – i jedyną, która jest potencjalnie lecznicza, jeśli osiągnięte zostaną wolne od choroby marginesy – jest chirurgiczne wycięcie z szerokimi marginesami, a następnie miejscowa radioterapia, a nawet, zdaniem niektórych autorów, napromienianie regionalnych węzłów chłonnych.6 W większości przypadków nie jest jednak łatwo osiągnąć wolne od choroby marginesy z powodu rozległego subklinicznego rozsiewu. Ponadto guzy te są często wieloogniskowe. Chemioterapia odgrywa czysto paliatywną rolę w leczeniu skórnego naczyniakomięsaka.
Aczkolwiek skórny naczyniakomięsak jest rzadki (stanowi mniej niż 1% wszystkich mięsaków), większość przypadków naczyniakomięsaka ma swoje źródło w skórze. Ze względu na niską częstość występowania, naczyniakomięsaki skórne są włączane do serii dotyczących naczyniakomięsaków trzewnych lub kostnych, które mają jeszcze bardziej fatalne rokowanie.1 W związku z tym w piśmiennictwie istnieje niewiele dużych serii dotyczących naczyniakomięsaka skórnego, ze względu na brak długoterminowych, jednorodnych przypadków.2,4,5,7,16 Postępowanie z naczyniakomięsakiem jest dodatkowo często przygnębiające, przede wszystkim w przypadkach zaawansowanej choroby, które mają bardzo złe rokowanie pomimo stosowania od początku agresywnego leczenia. Zmotywowani trudnościami związanymi z leczeniem angiosarcoma skórnego i niewielką ilością dostępnego piśmiennictwa, zbadaliśmy wszystkie przypadki angiosarcoma skórnego leczonego w Instituto Valenciano de Oncología (IVO), w Walencji, w Hiszpanii, w celu zidentyfikowania czynników klinicznych, histologicznych i związanych z leczeniem, które mogą mieć związek z rokowaniem. W tym celu dokonaliśmy przeglądu dokumentacji medycznej i wyników badań klinicznych w poszukiwaniu danych eksploracyjnych, które mogłyby służyć jako wskazówka do wczesnej diagnostyki, ponieważ pacjenci z wczesną chorobą i małymi guzami mają znacznie większe szanse na przeżycie.
Materiał i metody
Przeprowadziliśmy retrospektywne badanie obserwacyjne wszystkich przypadków skórnego naczyniakomięsaka leczonych w IVO między styczniem 2000 a grudniem 2015 roku. Wszystkie zebrane informacje zostały zaczerpnięte z dokumentacji medycznej pacjentów, archiwum biopsyjnego zakładu patologii oraz archiwum fotograficznego naszego oddziału. Spośród 20 początkowo zidentyfikowanych przypadków, 4 musiały zostać wykluczone: 1 z powodu braku obserwacji, drugi z powodu niewystarczającego materiału do określenia, czy guz był hemangioendothelioma czy angiosarcoma, a 2 ponieważ guzy nie były pierwotnymi angiosarcomas. Te 2 guzy zostały początkowo oznaczone jako skórne angiosarcoma, ponieważ wszystkie slajdy histologiczne wykazały skórne zajęcie piersi. Jednak po ponownym zbadaniu bloków stwierdziliśmy, że zajęcie skóry było wtórne w obu przypadkach, a guz pierwotny znajdował się w miąższu sutka, skąd rozciągał się aż do skóry.
Kryteriami włączenia do badania były wyniki kliniczne sugerujące skórnego naczyniakomięsaka oraz histologiczne potwierdzenie rozpoznania za pomocą barwienia hematoksyliną-eozyną wycinków biopsyjnych, poparte badaniami immunohistochemicznymi, które w większości przypadków obejmowały barwienie CD31, CD34, D240 i Ki-67.
W odniesieniu do każdego pacjenta badano następujące zmienne: wiek, płeć, lokalizację i wielkość guza, typ naczyniakomięsaka (pierwotny, popromienny, związany z obrzękiem limfatycznym), leczenie (chirurgia, radioterapia, chemioterapia), nawrót, przerzuty, przeżycie i zgon. W przypadku guzów popromiennych i związanych z obrzękiem limfatycznym odnotowywano również typ poprzedniego guza oraz liczbę lat, które upłynęły od radioterapii lub obrzęku limfatycznego. Zmienne histologiczne poddane analizie to: stan marginesu, wzór histopatologiczny (naczyniopochodny, lity lub mieszany), dominujący typ komórek (nabłonkowate lub wrzecionowate), obecność martwicy (tak, nie), poziom inwazji (naskórek, skóra właściwa, podskóra, mięśnie, kości), odczyn limfocytarny, wzór naciekania i liczba mitoz na 10 pól.
Wyniki
Do badania włączono 16 przypadków skórnych angiosarcoma. Było to 11 kobiet i 5 mężczyzn w wieku od 35 do 83 lat (średnia 67 lat; mediana 71 lat). Dziesięć z nich to mięsaki popromienne (10 przypadków), 5 to mięsaki Wilsona-Jonesa, a tylko 1 to mięsak limfatyczny. Najczęstszą lokalizacją był tułów (10 przypadków), a następnie głowa i szyja (5 przypadków). Kończyny górne były zajęte tylko w 1 przypadku. Najmniejszy rozmiar guza wynosił 1 cm, a największy 50 cm (średnia, 10 cm; mediana, 6,5 cm).
Jeden z pacjentów miał w wywiadzie chorobę nowotworową (rak piersi w 10 przypadkach i seminoma w 1). Z wyjątkiem 1 przypadku inwazyjnego raka zrazikowego, wszystkie raki piersi były inwazyjnymi rakami przewodowymi.
Średni czas pomiędzy radioterapią a rozwojem angiosarcoma w 10 przypadkach angiosarcoma po napromienianiu wynosił 8,2 roku. Tylko 1 z przypadków pojawił się w ciągu 5 lat od radioterapii; reszta pojawiła się co najmniej 5 lat później.
Czternaście przypadków było leczonych chirurgicznie, a radioterapia adjuwantowa była stosowana w 4 z nich. Ośmiu chorych otrzymało chemioterapię, która była pierwszym i jedynym leczeniem u 2 chorych.
Doksorubicynę i taksol zastosowano w 4 przypadkach, ifosfamid w 3 przypadkach, a paklitaksel i dakarbazynę w 1 przypadku. Odpowiedź na chemioterapię była słaba i chociaż prawie wszyscy pacjenci wykazywali częściową odpowiedź, we wszystkich przypadkach nastąpiła progresja choroby i pacjenci zmarli w trakcie obserwacji (8/8).
Pięciu pacjentów miało przerzuty odległe, które w większości przypadków obejmowały wiele miejsc. Najczęstszymi lokalizacjami były płuco i wątroba.
Dziesięciu z 16 pacjentów zmarło z powodu angiosarcoma w trakcie obserwacji. Pozostałych 6 pacjentów jest obecnie wolnych od choroby. Średni czas obserwacji wynosił 42,5 miesiąca (mediana, 26 miesięcy; zakres, 7-188 miesięcy).
Histologicznie, 8 przypadków miało lity wzór wzrostu, 4 miały wzór naczyniopochodny, a 4 miały wzór mieszany. Dominującym typem komórek był nabłonkowaty w 14 przypadkach i wrzecionowaty tylko w 2. Martwicę zaobserwowano w 6 guzach, a wzór naciekania był podskórny w większości przypadków (n=10). Cztery przypadki były ograniczone do skóry właściwej, a tylko 2 dotyczyły płaszczyzn mięśniowych. Marginesy chirurgiczne nie były możliwe do oceny w 3 przypadkach. Spośród pozostałych przypadków 8 miało marginesy ujemne, a 5 – dodatnie. Odczyn limfocytarny był łagodny lub umiarkowany w 10 przypadkach, intensywny w 2 i nieistniejący w 4. W 14 przypadkach z odczynem limfocytarnym naciek był okołotumoralny w 2 przypadkach, wewnątrztumoralny w 8 i mieszany w 2. Średnia liczba mitoz wynosiła 15 na 10 pól (zakres, 0-37 mitoz).
Najważniejsze wyniki kliniczne i patologiczne podsumowano w tabeli 1. Wyniki porównania pomiędzy osobami, które przeżyły i nie przeżyły są podsumowane w Tabeli 2.
Selekcja wyników klinicznych i patologicznych dla 16 skórnych naczyniakomięsaków.a
| Pacjent | Age, y | Sex | Type | Location | Size, cm | Time Since Rx, mo | Dose, Gy | Poprzedni nowotwór | Typ raka piersi | |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 78 | F | PR | Lewa pierś | 18 | . 60 | 46 | Pierś | IDC | |
| 2 | 71 | F | ST | Lewe ramię | 12 | – | -. | Piersi | IDC | |
| 3 | 51 | F | PR | Prawa okolica podżuchwowa | 1 | 57 | 50 | Piersi | IDC | |
| 4 | 76 | F | WJ | Głowa i szyja | 3 | – | – | Nie | . | |
| 5 | 77 | F | PR | Prawa pierś | 1 | 94 | . | 46 | Pierś | IDC |
| 6 | 71 | F | PR | Lewa pierś | 50 | 171 | 48 | Pierś | IDC | |
| 7 | 48 | M | PR | Ściana brzuszna | 2 | 96 | 26 | Seminoma | -. | |
| 8 | 55 | F | PR | Lewa pierś | 10 | 88 | . | 46 | Pierś | ILC |
| 9 | 69 | F | PR | Lewa pierś | 8 | 143 | 46 | Pierś | IDC | |
| 10 | 76 | M | WJ | Prawy policzek | 6 | – | – | Nie | -. | |
| 11 | 35 | F | PR | Pierś prawa | 12 | 66 | . | 50 | Pierś | IDC |
| 12 | 57 | F | PR | Prawa pierś | 8 | 108 | 50 | Pierś | IDC | |
| 13 | 68 | M | WJ | Głowa i szyja | 2 | – | – | Nie | -. | |
| 14 | 80 | M | WJ | Głowa i szyja | 15 | – | -. | Nie | – | |
| 15 | 79 | M | WJ | Głowa i szyja | 2 | -. | – | Nie | – | |
| 16 | 83 | F | PR | Lewa pierś | 3 | 110 | 50 | Piersi | IDC | |
| X=67.1 | 11W, 5M | 10 RI, 5 WJ, 1 ST | 9 pierś, 5 głowa i szyja, 1 brzuch, 1 kończyna górna | X=10 | X=100.3 | X=45.8 | 10 rak piersi, 1 seminoma |
10 rak piersi: 9 IDC, 1 ILC |
| Pacjent | Chirurgia | Margin, cm | AS Treatment | Death | HP Pattern | Cell Type | Necrosis | DoI | Mitoses/mm2 | Survival, mo | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Tak | 0.2 | 13 | Tak | 1 | E | Nie | 3 | 7 | 24 | |
| 2 | Nie | . ns | 3 | Tak | 2 | E | Nie | 3 | 37 | 8 | |
| 3 | Tak | 3.5 | 1 | Nie | 1 | E | Nie | 3 | 2 | 29 | |
| 4 | Tak | 2 | . | 123 | Tak | 2 | E | Nie | 3 | 28 | 26 |
| 5 | Tak | ns | 1 | Tak | 2 | E | Nie | 2 | 14 | 8 | |
| 6 | Nie | ns | 3 | Tak | 1 | E | Nie | 2 | 0 | 19 | |
| 7 | Tak | ns | 1 | Nie | 3 | E | Nie | 3 | 6 | 187 | |
| 8 | Tak | ns | . | 13 | Tak | 2 | E | Tak | 4 | 6 | 28 |
| 9 | Tak | ns | 13 | Tak | 3 | E | Tak | 3 | 22 | 24 | |
| 10 | Tak | ns | 12 | Tak | 2 | E | Tak | 3 | 16 | 7 | |
| 11 | Tak | 0.5 | 1 | Nie | 2 | SC | Nie | 3 | 18 | 76 | |
| 12 | Tak | 0 | 13 | Tak | 3 | E | Tak | . | 3 | 36 | 26 |
| 13 | Tak | 2 | 12 | Nie | 3 | E | Nie | 3 | 5 | 95 | |
| 14 | Tak | 2 | 123 | Tak | 2 | E | Tak | 4 | 17 | 24 | |
| 15 | Tak | 2 | 1 | Nie | 2 | E | Tak | 2 | 6 | 53 | |
| 16 | Tak | 3 | 1 | Nie | 1 | SC | Nie | 2 | 23 | 51 | |
| 14 tak, 2 nie | 1.68 | 14: Qx 4: Rt 8: Qt |
10 tak 6 nie |
4 vasof 8 solid 4 mixed |
14 E, 2 SC | 6 Yes 10 No |
4 dermis 10 hypodermis 2 muscle |
X=15 | X=42.8 |
Pacjenci, którzy zmarli, są przedstawieni pogrubioną czcionką.
AS treatment, leczenie angiosarcoma (1, surgery ; 2, radiation therapy ; 3, chemotherapy ); DoI, depth of invasion (2, dermis ; 3, hypodermis ; 4, muscle); E, epithelioid; HP, histopathologic (1, vasoformative ; 2,solid; 3, mieszany); IDC, inwazyjny rak przewodowy; ILC, inwazyjny rak zrazikowy; M, mężczyzna; ns, nie określono; PR, mięsak naczynioruchowy po napromienianiu; Rx, napromienianie; SC, wrzecionowatokomórkowy; ST, mięsak naczynioruchowy Stewarta-Trevesa; W, kobieta; WJ, mięsak naczynioruchowy Wilsona-Jonesa: X, mean.
Comparison of Variables Between Survivors and Patients Who Died of Cutaneous Angiosarcoma.
| Zmienna | Przeżyli (n=6) | Zmarli (n=10) |
|---|---|---|
| Wiek, średnia, y | 61 | 71 |
| Kobiety | 3 | 8 |
| Mężczyźni | 3 | 2 |
| Popromienne | 4 | 6 |
| Idiopatyczne | 2 | 3 |
| Limfedema-…związany | 0 | 1 |
| Pień | 4 | 6 |
| Głowa i szyja | 2 | 3 |
| Kończyny górne | 0 | 1 |
| Wielkość, cm | 3.6 | 13,1 |
| Czas od radioterapii, mo | 82,25 | 110.6 |
| Dawka promieniowania, Gy | 44 | 47 |
| Piersi | 3 | 7 |
| Seminoma | 1 | |
| Chirurgia | 6 | 8 |
| Radioterapia | 1 | 3 |
| Chemioterapia | 0 | 8 |
| Wazoformatywna | 2 | 2 |
| . Stałe | 2 | 6 |
| Mieszane | 2 | 2 |
| Martwica | 1 | 5 |
| Skóra właściwa | 2 | 2 |
| Skóra podskórna | 4 | 6 |
| Mięśnie | 0 | 2 |
| Mitozy | 10 | 18.3 |
| Survival, mo | 81,8 | 19.4 |
Dyskusja
Mięsak naczynioruchowy skóry jest bardzo rzadkim nowotworem, o czym świadczy fakt, że udało nam się zebrać dane tylko o 16 guzach zdiagnozowanych w okresie 14 lat w szpitalu onkologicznym. Ogólnie rzecz biorąc, naczyniakomięsak skórny występuje nieco częściej u starszych mężczyzn. Wynika to z faktu, że najczęstszą postacią naczyniakomięsaka skórnego w populacji ogólnej jest pierwotny mięsak naczynioruchowy głowy i szyi (znany również jako idiopatyczny lub Wilson-Jones angiosarcoma)(ryc. 1), który ma tendencję do występowania u starszych mężczyzn.5,7,17 Angiosarcoma postradiation (ryc. 2) jest obecnie drugą co do częstości występowania postacią skórnego naczyniakomięsaka z powodu częstszego stosowania radioterapii zamiast radykalnej mastektomii w leczeniu raka piersi.2,13,18 Zmiana ta doprowadziła również do zmniejszenia częstości występowania angiosarcoma lymphedema-associated, który jest obecnie najrzadziej występującą postacią tego nowotworu. Częstość występowania różnych postaci naczyniakomięsaka skórnego w naszej serii nie pokrywa się z doniesieniami w piśmiennictwie, ponieważ w naszym szpitalu leczona jest duża liczba kobiet z rakiem piersi, co tłumaczy, dlaczego najczęstszą postacią naczyniakomięsaka skórnego w naszym szpitalu był naczyniakomięsak popromienny. Ta przewaga przypadków raka piersi wyjaśnia również, dlaczego 11 z 16 pacjentów to kobiety. Odnotowano tylko 1 przypadek naczyniakomięsaka związanego z obrzękiem limfatycznym (ryc. 3), co pokrywa się z częstością występowania opisywaną w innych publikacjach. Pacjentka miała przewlekły obrzęk limfatyczny lewego ramienia wtórny do dysekcji pachowych węzłów chłonnych wykonanej w ramach leczenia raka piersi 22 lata wcześniej.
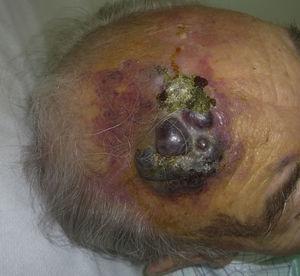
Czerwonawo-wiśniowa blaszka z obszarami guzkowymi na czole u starszego mężczyzny.
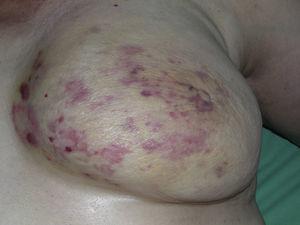
Wielość plam i plam rumieniowych z kilkoma czerwonawymi grudkami na żółtawej skórze na piersi napromienianej z powodu raka.
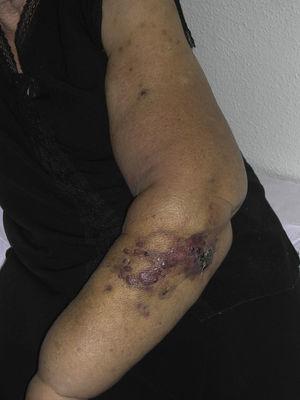
Czerwonawo-wiśniowe grudki i guzki z obszarami przypominającymi siniaki na ramieniu z obrzękiem limfatycznym wtórnym do operacji raka piersi.
Z wyjątkiem 1 kobiety, która miała idiopatycznego lub Wilson-Jones angiosarcoma, reszta kobiet w naszej serii (n=10) miała historię raka piersi. Dziewięć z tych nowotworów było inwazyjnymi rakami przewodowymi. Ponieważ 80% raków piersi w populacji ogólnej to inwazyjne raki przewodowe, a tylko 10% to raki zrazikowe, wysoka częstość występowania inwazyjnego raka przewodowego w naszym badaniu jest prawdopodobnie odzwierciedleniem wysokiej częstości występowania tego raka w populacji ogólnej, a nie szczególnego związku między popromiennym skórnym mięsakiem naczynioruchowym a inwazyjnym rakiem przewodowym, jak zdawałyby się sugerować nasze wyniki. Innymi słowy, proporcje obserwowane w naszej serii są zgodne z częstościami opisywanymi dla różnych nowotworów piersi w populacji ogólnej. Na uwagę zasługują 2 przypadki angiosarcoma piersi, które początkowo włączono do naszego badania. Zgłaszano, że mięsak naczynioruchowy piersi ma tendencję do skórnego, gdy jest indukowany przez promieniowanie i miąższowego, gdy nie jest.19 W naszej serii, z 18 przypadków skórnego mięsaka naczynioruchowego początkowo zidentyfikowanych, były 2 przypadki mięsaka naczynioruchowego piersi nie indukowane przez radioterapię. Po przejrzeniu tych przypadków stwierdziliśmy, że pierwotną lokalizacją guza był miąższ sutka, a nie skóra. Guzy te zostały zatem wyłączone z badania, ponieważ były wtórne, a nie pierwotne. Pozostałe przypadki były pierwotnymi angiosarcomas piersi wywołanymi promieniowaniem, zgodnie z doniesieniami w literaturze.
Najczęstszą lokalizacją angiosarcoma w naszej serii była pierś (10 przypadków), a nie twarz lub skóra głowy, jak można by się spodziewać. Jedynym przypadkiem, który dotyczył kończyn był naczyniakomięsak związany z obrzękiem limfatycznym. Ponownie, fakt, że najczęstszym miejscem występowania nowotworu była pierś, można wyjaśnić przewagą nowotworów wywołanych promieniowaniem w naszej serii.
Ale okres utajenia między ekspozycją na radioterapię a rozwojem naczyniakomięsaka jest bardzo zróżnicowany zgodnie z doniesieniami w literaturze (3-50 lat), ma tendencję do wydłużania się (średnio 25 lat), gdy choroba leczona promieniowaniem jest łagodna. Okresy utajenia zgłaszane w przypadku chorób złośliwych są krótsze (około 10-15 lat), z wyjątkiem angiosarcoma piersi, dla którego opisano średnią wynoszącą około 5 lat.12 Przyczyna tego krótszego okresu w przypadku angiosarcoma piersi jest niejasna, chociaż zaproponowano kilka teorii, w tym dużą objętość napromieniowanej skóry, obecność towarzyszącego obrzęku limfatycznego, czynniki, które są prawdopodobnie wewnętrzne dla piersi i możliwy efekt synergiczny z chemioterapią.13,14 W naszych 10 przypadkach po napromienianiu angiosarcoma został rozpoznany po średnio 8,2 roku, a w 90% przypadków upłynęło co najmniej 5 lat. Nie stwierdzono związku między okresem utajenia a rokowaniem w przypadku angiosarcoma. W naszej serii, średni czas od radioterapii do rozwoju angiosarcoma był nieco dłuższy u pacjentów, którzy zmarli (110,6 miesięcy) niż u tych, którzy przeżyli (82,25 miesięcy). W jedynym przypadku zespołu Stewarta-Trevesa chory został poddany zabiegowi usunięcia węzłów chłonnych 22 lata wcześniej. Okresy utajenia opisywane dla naczyniakomięsaka związanego z obrzękiem limfatycznym są bardzo zmienne, wahają się od 1 do 30 lat, a średnia wynosi 10 lat. Zespół Stewarta-Trevesa stanowi 90% wszystkich przypadków naczyniakomięsaka związanego z obrzękiem limfatycznym.9,11 Angiosarcoma może jednak powstać również w innych postaciach obrzęku limfatycznego, takich jak obrzęk limfatyczny wrodzony, obrzęk limfatyczny filariowy i obrzęk limfatyczny wtórny do dysekcji węzłów chłonnych w innych częściach ciała.10
Rozmiar guza jest obecnie najszerzej akceptowanym markerem prognostycznym dla skórnego naczyniakomięsaka, i często donoszono, że naczyniakomięsaki mierzące 5cm lub więcej mają gorsze rokowanie niż mniejsze guzy.5,17 W naszej serii, obserwowaliśmy różnice w średnim rozmiarze guza pomiędzy osobami, które przeżyły i nie przeżyły. U chorych, którzy przeżyli, średni rozmiar guza wynosił 3,6 cm i był ponad 3-krotnie mniejszy niż średni rozmiar guza (13,1 cm) w grupie chorych, którzy zmarli. Nasze wyniki potwierdzają więc pogląd, że większe guzy wiążą się z gorszym rokowaniem w angiosarcoma i podkreślają znaczenie rozpoznania guza, gdy zaczyna się on jako zmiana siniakowata, choć jest to szczególnie trudne w przypadku angiosarcoma skóry głowy, a tym bardziej, gdy chory ma jeszcze włosy (ryc. 4). Angiosarcoma piersi po napromienianiu jest łatwiejszy do zdiagnozowania, ponieważ każda utrzymująca się zmiana w tej okolicy o wyglądzie naczyniaka lub siniaka powinna być poddana biopsji. Jedną z potencjalnie użytecznych wskazówek diagnostycznych jest żółtawa aureola (odpowiadająca hemosyderynie) wokół podejrzanej zmiany (ryc. 5), ponieważ nigdy nie obserwowaliśmy tego objawu w łagodnych rozrostach naczyniowych na napromienianej skórze. Angiosarcoma po napromienianiu i atypowe rozrosty naczyniowe na napromienianej skórze muszą być rozróżnione histologicznie, ale pomocne mogą być cechy kliniczne. Atypowe rozrosty naczyniowe są zwykle znacznie mniejsze niż naczyniakomięsaki i mają na ogół krótszy okres utajenia.20 W przeciwieństwie do naczyniakomięsaków, rozrosty te są ograniczone do skóry właściwej powierzchownej i środkowej i nie zajmują tkanki podskórnej. Ponadto w badaniu histologicznym nie stwierdza się charakterystycznej atypii jądrowej obserwowanej w angiosarcoma, ani wielu warstw komórek śródbłonka czy figur mitotycznych. Niemniej jednak, rozróżnienie tych dwóch jednostek chorobowych może być czasami trudne i istnieją doniesienia o współistnieniu tych dwóch zmian w tej samej napromienianej piersi. Opisywano nawet przypadki progresji atypowych rozrostów naczyniowych wywołanych promieniowaniem do angiosarcoma.21 W bardzo skomplikowanych przypadkach pomocne może być poszukiwanie nadekspresji genu MYC, jeśli wykonywane jest badanie immunohistochemiczne, lub amplifikacji, jeśli stosowana jest hybrydyzacja fluorescencyjna in situ. Amplifikacja MYC jest dość częsta we wtórnych naczyniakomięsakach, ale nie wydaje się występować w atypowych rozrostach naczyniowych na napromienianej skórze.22
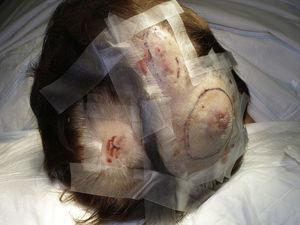
Multifocal erythematous nodules on the scalp.
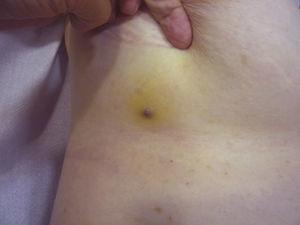
Reddish-violaceous papule measuring less than 1cm surrounded by a yellowish area of skin.
Drugim najczęściej akceptowanym markerem prognostycznym w angiosarcoma jest wiek. W naszej serii pacjenci, którzy przeżyli, byli średnio młodsi niż ci, którzy zmarli (62 vs 71 lat). Niezależnie od tego, 10 z 16 pacjentów w naszej serii zmarło przed końcem badania, potwierdzając złe rokowanie ogólnie związane z angiosarcoma.
W przeciwieństwie do innych mięsaków, American Joint Committee on Cancer nie uważa stopnia histologicznego za istotny marker prognostyczny w angiosarcoma. Kilku autorów zasugerowało jednak, że pewne cechy histopatologiczne mogą mieć wpływ na rokowanie. Niektóre ostatnie badania, na przykład, twierdziły, że dominujący lity wzór może być stosunkowo dobrym markerem prognostycznym w angiosarcoma głowy i szyi.3,16 Nie miało to miejsca w naszej serii, ponieważ 6 z 10 pacjentów, którzy zmarli, miało ten wzór w porównaniu z zaledwie 2 z 6 pacjentów, którzy nadal żyli pod koniec badania (ryc. 6 i 7).
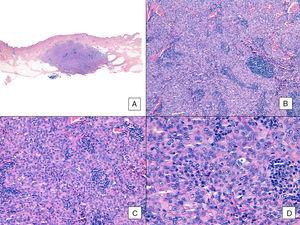
Angiosarcoma z dominującym wzorem litym. A, Obraz panoramiczny pokazuje inwazję środkowej i głębokiej skóry właściwej siatkowej oraz podskórnej (hematoksylina-eozyna, oryginalne powiększenie ×10). B, Gęsto komórkowy guz, który zniszczył istniejące wcześniej struktury i któremu towarzyszą guzkowe nacieki limfoidalne (hematoksylina-eozyna, oryginalne powiększenie ×100). C i D, widok szczegółowy ukazujący przewagę komórek epitelioidalnych z towarzyszącym naciekiem limfocytarnym (hematoksylina-eozyna, odpowiednio ×200 i ×400).
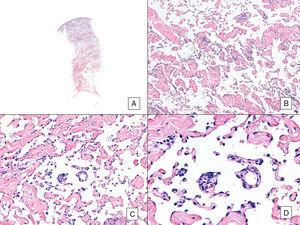
Angiosarcoma with a predominant vasoformative pattern. A, obraz panoramiczny ukazujący naciek skóry właściwej aż do podskóry (hematoksylina-eozyna, oryginalne powiększenie ×10). B, nowotworowe przestrzenie naczyniowe z wyraźną dyssekcją kolagenu (hematoksylina-eozyna, oryginalne powiększenie ×100). C i D, Nieneoplastyczne naczynia rozcięte przez nowotworowe komórki śródbłonka, które pozostają „pływające” w skórze właściwej (objaw promontory) (hematoksylina-eozyna, oryginalne powiększenie odpowiednio ×200 i ×400).
Innymi potencjalnie wysoce ryzykownymi czynnikami histologicznymi proponowanymi w literaturze są obecność martwicy, morfologia epitelioidalna i większa głębokość inwazji.5,7 Nasze wyniki potwierdzają te potencjalne markery, ponieważ wszystkie 3 zmienne występowały częściej w grupie osób, które nie przeżyły. Martwica była obserwowana u 5 z 10 pacjentów, którzy zmarli i tylko u 1 z 6 pacjentów, którzy przeżyli. Podobnie, tylko 2 pacjentów z przewagą komórek wrzecionowatych nadal żyło pod koniec badania. Żaden z pacjentów, którzy zmarli, dla kontrastu, nie miał takiego wzorca. Wreszcie, jedynych 2 pacjentów z zajęciem płaszczyzn mięśniowych zmarło. Średnia liczba mitoz była również wyższa w grupie chorych, którzy nie przeżyli (18,3 vs 10).
Leczeniem z wyboru mięsaka naczynioruchowego skóry jest wycięcie chirurgiczne z szerokimi marginesami, a następnie radioterapia.6 Częsta wieloogniskowość mięsaka naczynioruchowego i jego skłonność do subklinicznego rozsiewu często komplikują uzyskanie wyraźnych marginesów. Co więcej, nie ma uniwersalnej zgody co do tego, co stanowi odpowiedni margines, a większość badań dostarcza nieprecyzyjnych informacji, takich jak wycięcie z „szerokim marginesem”. W naszej serii u 14 z 16 pacjentów leczenie chirurgiczne było leczeniem z wyboru. Marginesy 3 cm zastosowano tam, gdzie było to technicznie możliwe, a w pozostałych przypadkach podjęto próbę usunięcia nowotworu, stosując marginesy 2 cm. 14 pacjentów poddano operacji radykalnej. Pozostałych 2 nie zostało uznanych za kandydatów do operacji i otrzymało paliatywną chemioterapię. Zmarli oni w trakcie obserwacji. Radioterapię adjuwantową na lożę pooperacyjną zastosowano tylko u 4 chorych. Tak małe zastosowanie radioterapii w leczeniu angiosarcoma w naszej serii można prawdopodobnie wytłumaczyć dużą liczbą przypadków angiosarcoma popromiennego w naszej serii. Innymi słowy, prawdopodobnie wpływ na to miał pewien stopień oporu przed stosowaniem napromieniania w tych przypadkach. Zastosowanie radioterapii w naczyniakomięsakach popromiennych znajduje jednak poparcie w piśmiennictwie, a nawet bywa stosowane jako monoterapia, bez zabiegu operacyjnego.23,24 Chemioterapię zastosowano u połowy chorych. Jak już wspomniano, pełniła ona jedynie rolę paliatywną i we wszystkich przypadkach wiązała się ze złym wynikiem leczenia. Chociaż monoterapia paklitakselem nie była najczęściej stosowanym schematem chemioterapii w naszej serii (ponieważ przypadki były diagnozowane jakiś czas temu), schemat ten jest obecnie stosowany jako opcja pierwszego rzutu w większości przypadków. Pomimo początkowych oczekiwań, leki angiogenne (sunitinib, sorafenib, bevacizumab, talidomid) nie są stosowane w tym przypadku ze względu na rozczarowujące wyniki.
Pomimo niewielkiej liczby przypadków w naszej serii skórnych naczyniakomięsaków, co uniemożliwiło nam przeprowadzenie analiz statystycznych, zaobserwowaliśmy, że większy rozmiar guza i starszy wiek były związane z gorszym rokowaniem. Mniej wyraźny związek zaobserwowano również pomiędzy złym rokowaniem a następującymi cechami histologicznymi: obecność martwicy, przewaga komórek epitelioidalnych, inwazja głębszych warstw i większa liczba mitoz.
Ujawnienia etyczneOchrona ludzi i zwierząt
Autorzy deklarują, że w celu przeprowadzenia tego badania nie przeprowadzono żadnych testów na ludziach ani zwierzętach.
Poufność danych
Autorzy oświadczają, że postępowali zgodnie z protokołem swojego szpitala w sprawie publikacji danych dotyczących pacjentów.
Prawo do prywatności i świadoma zgoda
Autorzy oświadczają, że w tym artykule nie pojawiają się żadne prywatne dane pacjentów.
Konflikt interesów
Autorzy oświadczają, że nie mają konfliktu interesów.
.