Trend 2: Dla kwasów tlenowych z danym atomem centralnym kwasowość wzrasta wraz ze stanem utlenienia pierwiastka centralnego lub, innymi słowy, liczbą oksygenów związanych z atomem centralnym.
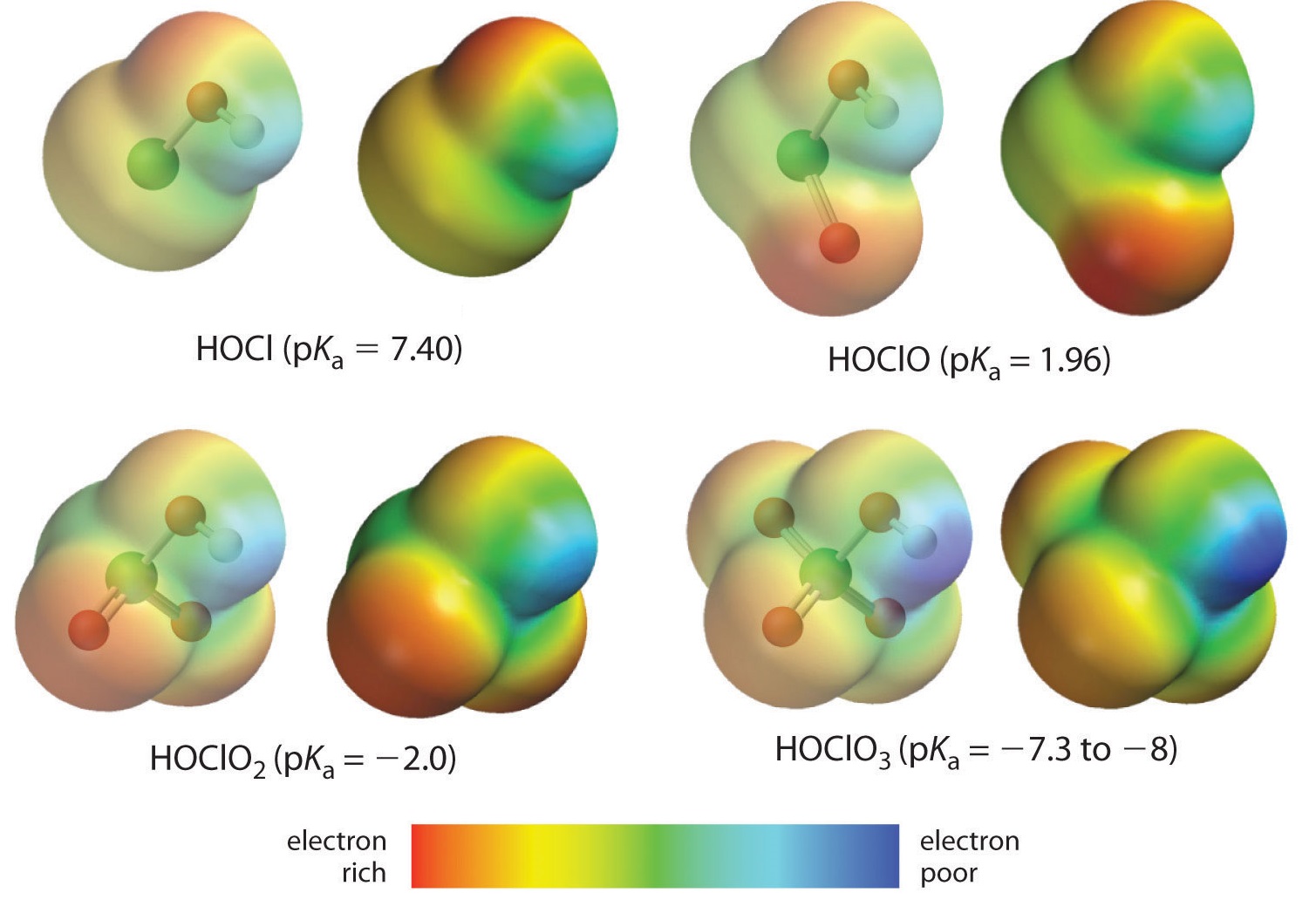
Przyglądamy się tutaj trendowi dla kwasów, w których występuje zmienna liczba tlenu związanego z danym atomem centralnym. Przykładem jest szereg kwasów nadchlorowych (^ClO_4^{-}}), chlorowych (^ClO_3^{-}}), chlorkowych (^ClO_2^{-}}) i hipochlorowych (^ClO^{-}}). W takich szeregach im większa liczba oksygenów, tym mocniejszy kwas. Można to wyjaśnić na kilka sposobów. Z punktu widzenia samego kwasu kluczowym czynnikiem jest ponownie efekt indukcyjny, w tym przypadku polegający na zdolności oksygenów przyłączonych do atomu centralnego do przyciągania gęstości elektronów przez wiązanie OH. Widać to na wykresie gęstości ładunku dla tlenokwasów chlorkowych pokazanym na rysunku (\PageIndex{1}}), w którym częściowy ładunek dodatni na kwaśnym wodorze wzrasta wraz z liczbą obecnych oksygenów.
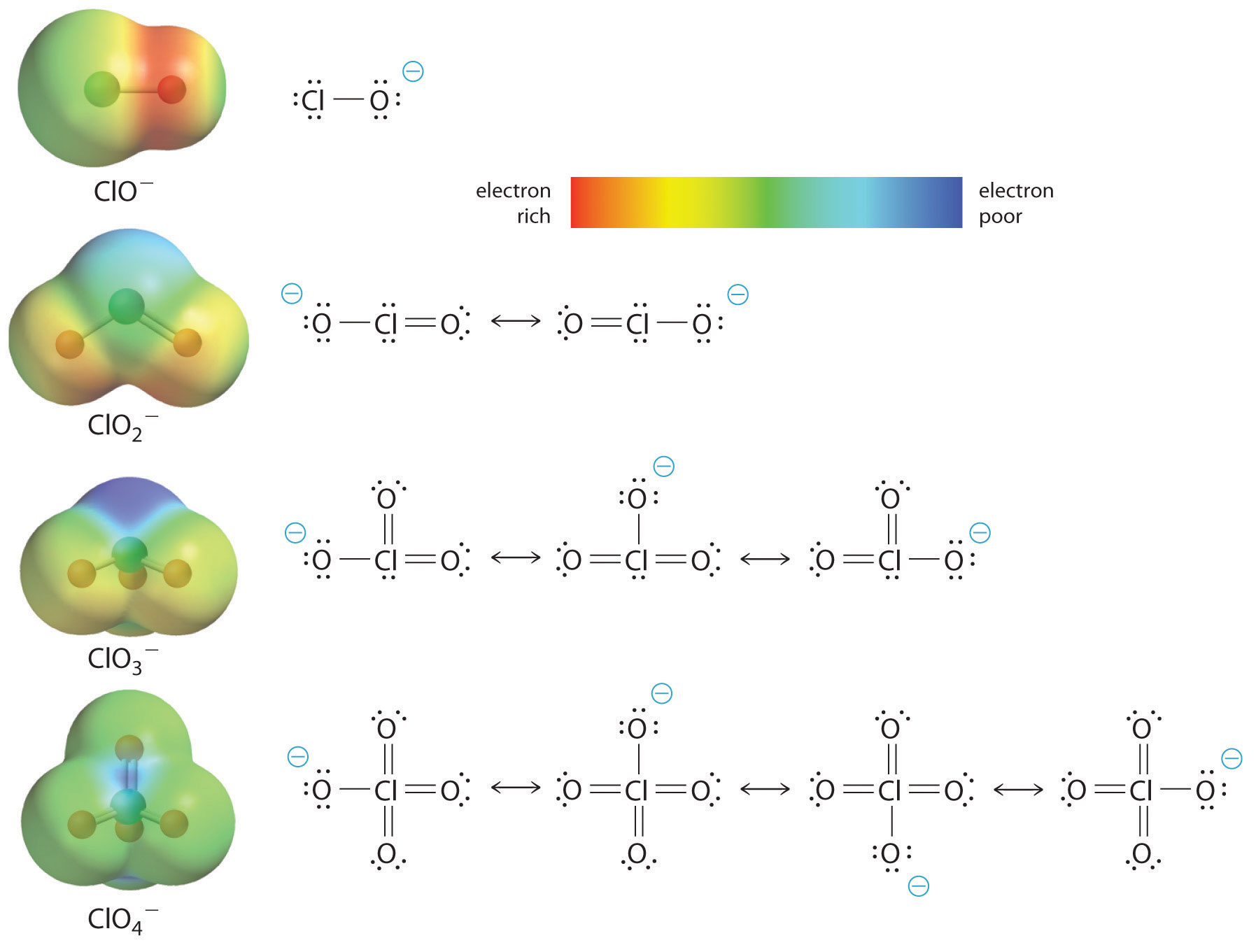
Wzrost kwasowości kwasów tlenowych wraz z liczbą oksygenów związanych z atomem centralnym można również zaobserwować rozpatrując stabilność sprzężonego oksyanionu. To, że stabilność sprzężonej zasady wzrasta wraz z liczbą oksygenów można zauważyć na podstawie diagramów rozkładu ładunku i modeli wiązania Lewisa dla oksyanionów chloru przedstawionych na rysunku \(\PageIndex{2}). Ponieważ ładunek ujemny jest rozłożony na więcej atomów tlenu, staje się on coraz bardziej rozproszony.
Ćwiczenie \(\PageIndex{1}})
Zarówno siarka, jak i selen tworzą tlenokwasy o wzorze \(\H_2EO_4}, gdzie E jest albo S, albo Se. Są one nazywane odpowiednio kwasem siarkowym i selenowym. Który z kwasów tlenowych powinien być bardziej kwaśny: kwas selenowy czy siarkowy?
Odpowiedź
Kwas siarkowy powinien być bardziej kwaśny. Ponieważ siarka jest bardziej elektronegatywna niż selen, siarka w większym stopniu polaryzuje wiązania OH, przez co stają się one bardziej kwaśne. Przewidywania te potwierdza porównanie wartości pK_a dla kwasów:
| kwas | (pK_{a1}) | (pK_{a2}) |
|---|---|---|
| kwas siarkowy, \(H_2SO_3\) | 1.85 | 7,2 |
| kwas selenowy, \(H_2SeO_3\) | 2,62 | 8,32 |
.