W reakcjach takich jak Hofmann’s Exhaustive Methylation – reakcje eliminacji, najmniej podstawione olefiny jest ogólnie utworzony jako główny produkt. Nazywa się to regułą Hofmanna. We wszystkich tego typu reakcjach występują naładowane grupy opuszczające, takie jak -NR3+ lub -SR2+ i zaangażowane są silne zasady. Reguła Zaitseva (lub reguła Saytzeffa) zwraca naszą uwagę na inną możliwość. Po wyeliminowaniu HX otrzymuje się bardziej stabilną olefinę (Rys. 2.3.1). Pozorna sprzeczność w tym zestawie reguł jest łatwa do rozwiązania poprzez krytyczne spojrzenie na mechanizmy zaangażowane w te dwa zestawy warunków reakcji.
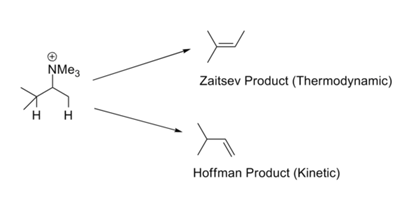
Mogą być dwa powody takich preferencji. Ingold (1960) i Bunnett (1969) zasugerowali, że dodatnio naładowana grupa opuszczająca zwiększa kwasowość β-protonów. Podstawnik w pozycji β mógłby hiperkoniugacyjnie zmniejszyć kwasowość protonu β. W konsekwencji, terminalna grupa metylowa (która nie posiada podstawnika alkilowego) jest bardziej kwaśna niż wewnętrzny proton metynowy (posiadający co najmniej jeden podstawnik alkilowy). Gdy grupą opuszczającą jest halogen, mechanizm przesuwa się w kierunku E1. W tych warunkach istotna staje się stabilność powstającego wiązania podwójnego, co prowadzi do powstania produktu stabilniejszego termodynamicznie. Szkoła H.C. Browna zasugerowała (1956), że czynniki steryczne rządzą takimi reakcjami eliminacji. Naładowane grupy opuszczające są duże w porównaniu do neutralnych grup opuszczających.
Większe grupy opuszczające jak -NR3+ i -SR2+ dają więcej produktu Hoffmanna niż mniejsze grupy jak halogeny. Masywność bazy również zwiększa produkt Hoffmanna kosztem produktu Zaitsava. Sytuacja wydaje się być bardziej złożona. Kiedy siła zasady była zwiększana bez zwiększania objętości w miejscu reakcji (X-C6H4-O¯), produkt Hoffmanna wzrastał kosztem produktu Zaitsava (Froemsdorf (1966,67)). Sugeruje to mechanizm E1cB, w którym kwasowość protonu β jest istotna. Tak więc mechanizm (a więc i skład produktów) może być zmieniany przez takie czynniki jak wielkość grupy opuszczającej, wielkość zasady, charakter grupy opuszczającej i siła zasady.
Wydawcy
- Prof. R Balaji Rao (Wydział Chemii, Banaras Hindu University, Varanasi) w ramach Information and Communication Technology
.