Aqui está o problema da cobertura de “aminas” no Org 2: não há narrativa.
Não é como a maioria dos capítulos, não começa com um conjunto de conceitos e depois constrói uma série de exemplos que você pode então aplicar esses conceitos a.
Não. Um capítulo típico sobre aminas num livro de introdução é essencialmente apenas um hodge-podge de tópicos aparentemente aleatórios jogados juntos que não cabiam em nenhum outro lugar. O único fio unificador é que eles contêm nitrogênio de alguma forma.
Caso em questão: o post aleatório de aminas de hoje é sobre os rearranjos de Hofmann e Curtius.
O que leva a isso, você pode perguntar? Não há uma boa resposta. A maioria dos cursos os cobre em algum momento, e eles têm que se encaixar em algum lugar. Então que se lixe. Porque não agora?
>
Tabela de conteúdos
- Os rearranjos de Hofmann e Curtius
- O mecanismo dos rearranjos de Hofmann e Curtius, Parte Um – Configurando o rearranjo
- Parte Dois: O passo chave do rearranjo de Hofmann e Curtius
- Parte Três: Formação do Isocianato
- Conjunta os Passos
- O Destino do Isocianato: Formação de Carbamatos, Aminas e Ureas
- Sumário: Os rearranjos de Hofmann e Curtius
- Notas
- (Avançado) Referências e Leitura Adicional
>
- Os rearranjos de Hofmann e Curtius
- O Mecanismo dos rearranjos de Hofmann e Curtius, Parte 1: Configurando o rearranjo
- Parte 1: Prelúdio
- 3. O passo chave na rearranjo do Hofmann e Curtius
- Formação do Isocianato
- Junta os passos
- O Destino do Isocianato
- Resumo: Os rearranjos de Hofmann e Curtius
- Notas
- (Advanced) References and Further Reading
Os rearranjos de Hofmann e Curtius
>
Os rearranjos de Hofmann e Curtius são dois exemplos de uma família inteira de reações de rearranjo que compartilham um passo mecanicista comum.
No rearranjo de Hofmann, um amido é tratado com bromo e base (geralmente NaOH ou KOH). Após o aquecimento, forma-se um isocianato intermediário, que não é isolado. Na presença de água, o isocianato perde dióxido de carbono (“decarboxilatos”) para dar uma amina.
A ligação chave que se forma no Hofmann é a ligação C2-N. Observe como o grupo carbonilo (C1) é perdido, formando dióxido de carbono (CO2). (nota: isto não é numeração IUPAC, apenas numeração para facilitar a discussão)
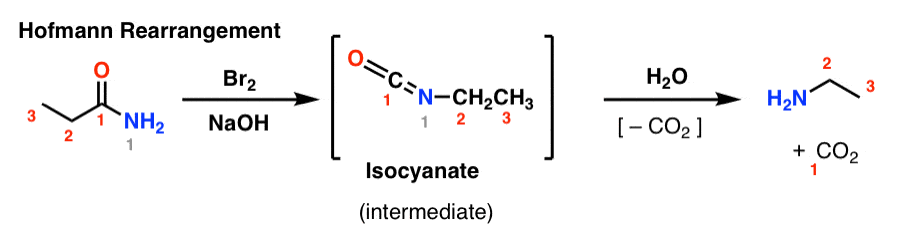
No rearranjo do Curtius, uma azida acilo é aquecida, e um isocianato é formado. No Curtius, o isocianato pode ser isolado, mas geralmente é transformado em outras espécies como carbamato, uréia ou (via descarboxilação, como no Hofmann) em uma amina (mais sobre os abaixo).
>
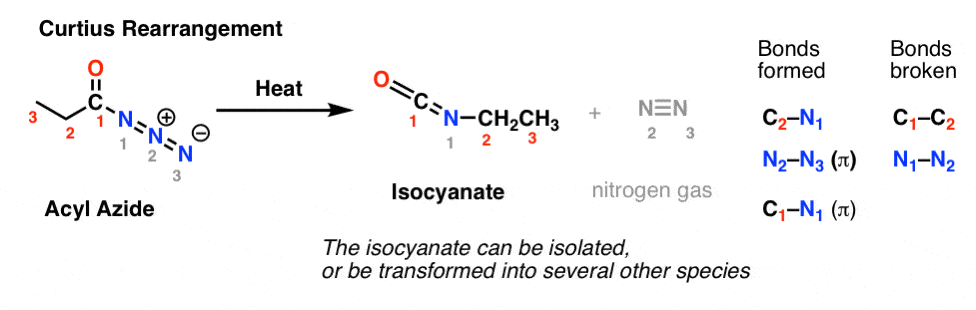
A observação chave a ser observada em ambos os casos é que a ligação C1-C2 se rompeu, e uma nova ligação C2-N se formou.
A questão é COMO?
O Mecanismo dos rearranjos de Hofmann e Curtius, Parte 1: Configurando o rearranjo
Há quatro partes importantes para o mecanismo dos rearranjos de Curtius e Hofmann, e vamos caminhar por todos eles.
- Prelúdio (direto)
- O passo de migração da chave (complicado, mas menos complicado se você perceber que você viu uma variante dele no Org 1 !)
- Formação do isocianato (directo)
4. Epílogo: Transformações do isocianato
Parte 1: Prelúdio
- O rearranjo de Hofmann ocorre com um amido.
- O rearranjo do Curtius ocorre com uma azida acyl.
Alguns são convenientemente preparados a partir de halogenetos acyl através de uma reação de adição-eliminação. Se você estiver cobrindo aminas agora, então as reações carbonílicas são provavelmente território familiar. Os halogenetos de acilo podem ser preparados a partir de ácidos carboxílicos através do uso de um reagente como cloreto de tionilo (SOCl2) ou pentacloreto de fósforo (PCl5).
>
>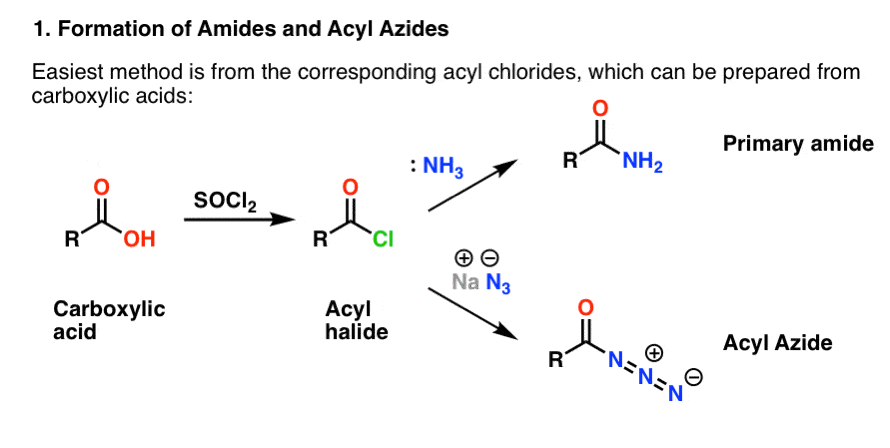 >
>
>
Configurando o Hofmann
No rearranjo de Hofmann, a amida é tratada com bromo (Br2) e uma base como NaOH. Isto resulta na quebra do N-H e na formação do N-Br, resultando na instalação de um bom grupo de saída sobre o nitrogênio. Chamamos isto de “N-bromo amida”.
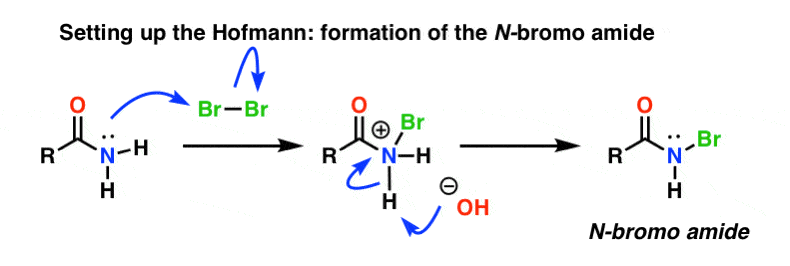
O Curtius não precisa de “instalação”, pois a azida acyl já tem um esplêndido grupo de saída incorporado: N2. É por isso que as azidas orgânicas devem ser tratadas com cuidado, pois um tratamento rude pode levar a explosões.
3. O passo chave na rearranjo do Hofmann e Curtius
Agora vamos ao que interessa.
O passo chave nos rearranjos de Hofmann e Curtius é a migração de um átomo de carbono para deslocar um grupo de saída sobre um nitrogênio adjacente.
É necessário desenhar duas setas curvas, que são mostradas na estrutura na extrema esquerda (abaixo).
- Na primeira seta curva, a ligação C-C quebra, e uma nova ligação C-N forma.
- Na segunda seta curva, a ligação N-LG (grupo de saída) quebra.
No entanto, nem sempre é fácil ir diretamente da estrutura na extrema esquerda para a estrutura na extrema direita (que é desenhada bem arrumada! ).
Pontos incontáveis são desnecessariamente perdidos em exames todos os anos por alunos que conseguem as flechas curvas certas, mas acabam desenhando a estrutura errada! É por isso que eu encorajo os alunos a desenhar primeiro uma “versão feia”, que parece uma porcaria, mas pelo menos tem todos os laços no lugar certo. Há sempre tempo para redesenhá-la e fazê-la parecer bem mais tarde.
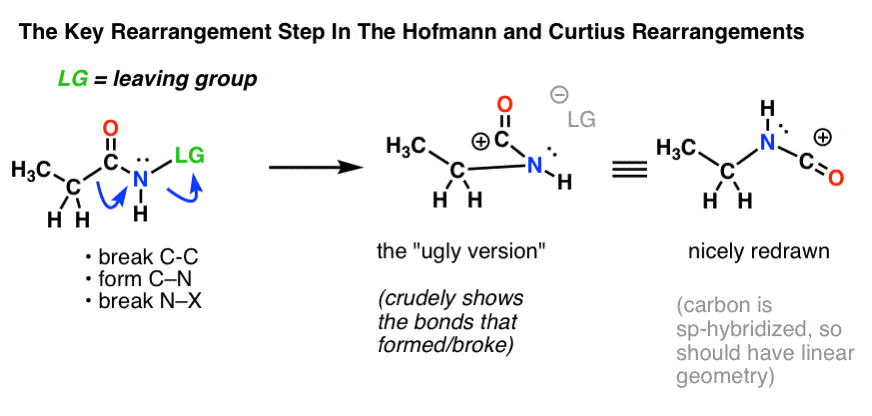
No início esta reorganização provavelmente parece… estranha. Mas na verdade é uma reação que você já viu antes! (mas de forma disfarçada).
>
Anyone remember the mechanism for the “oxidation” step in hydroboration-oxidation?
>
É basicamente a mesma coisa!
>
Aqui está um refresco:
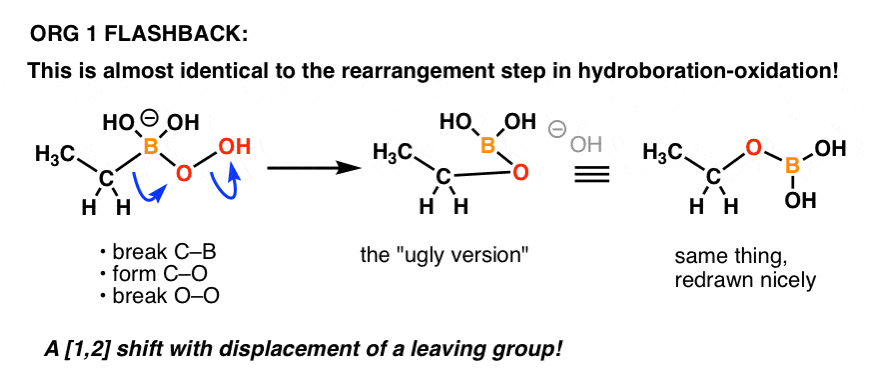
Mais um exemplo de como as coisas que se aprendem numa parte anterior da química orgânica podem voltar numa parte posterior do curso!
>
Vamos visitar o passo específico de rearranjo nos rearranjos de Hofmann e Curtius com exemplos concretos.
>>
Aqui está o passo chave no Hofmann, onde o aquecimento resulta em quebra de C-C , formação de C-N, e quebra de N-Br.
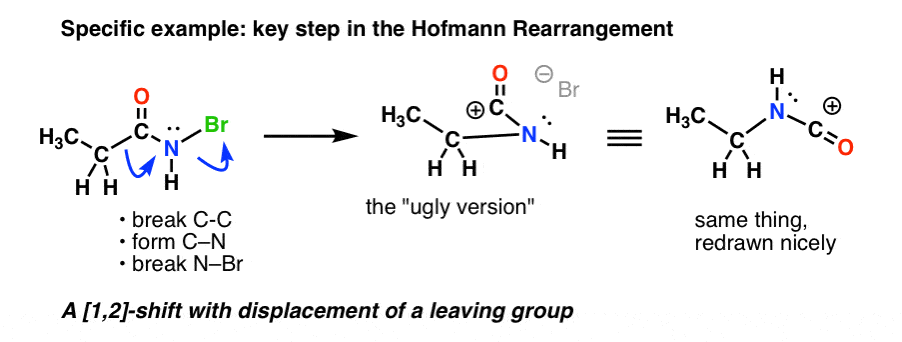
Se você seguir todas as setas, você deve acabar com uma carbonização de aparência esquisita (acima à direita), que trataremos em um minuto.
No Curtius, aquecer a azida acilo resulta em rearranjo. O grupo de saída é o gás nitrogênio (N2).
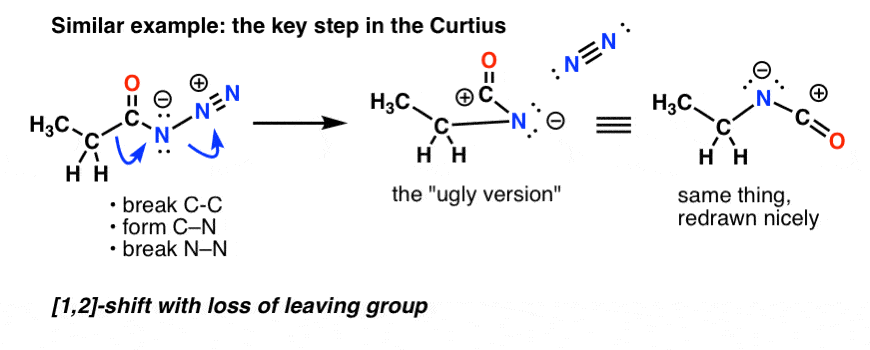
(Uma diferença sutil entre o Curtius e o Hofmann é que não há hidrogênio ligado ao N no Curtius, então acabamos com uma carga negativa sobre o nitrogênio na espécie rearranjada)
Formação do Isocianato
O próximo passo é ir da nossa espécie rearranjada para o isocianato. Para qualquer pessoa acostumada a desenhar formas de ressonância, isto não deve ser muito difícil.
(Como discutiremos abaixo, estudos determinaram que a formação do isocianato ocorre ao mesmo tempo em que a migração. Mas, para nossos propósitos de ensino, acho que ajuda a tratar este passo isoladamente. Podemos juntar tudo isso em um minuto).
Como você deve se lembrar de waayyyyy no Org 1, uma forma de ressonância com octetos completos é superior a uma sem (revisão rápida). Nosso produto de aparência esquisita de rearranjo tem uma carbonização adjacente a um par de nitrogênio contendo um par único. Portanto, o primeiro passo é desenhar a formação de uma nova ligação C-N pi. Isto é essencialmente apenas uma forma de ressonância.
O rearranjo de Hofmann ocorre na presença de base. Assim, após desenhar a forma de ressonância, o próximo passo é a desprotonação da ligação N-H dando o isocianato neutro.
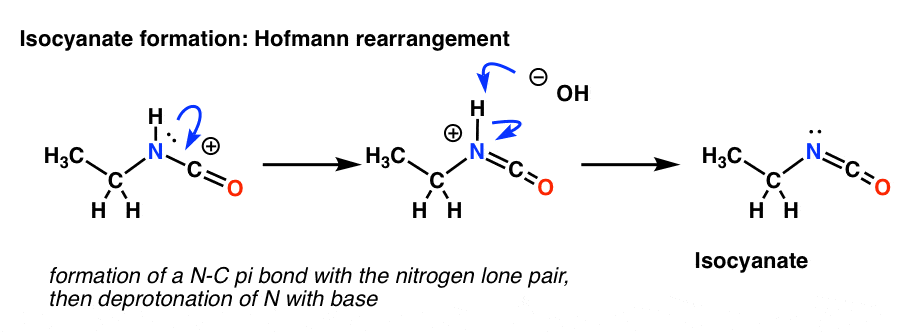
Não há hidrogênio sobre o nitrogênio no Curtius. Assim, a formação de isocianato é conseguida apenas pela doação de um par solitário de nitrogênio para a carbonização. Você pode apenas olhar para ele como desenhando uma forma de ressonância.
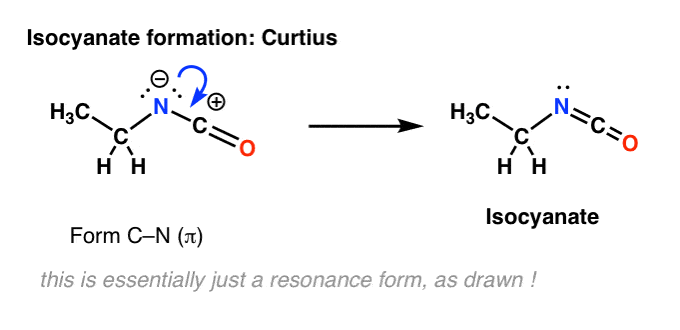
Junta os passos
Estudos sobre o mecanismo dos rearranjos de Hofmann e Curtius determinaram que estes dois passos não acontecem sequencialmente; eles realmente acontecem ao mesmo tempo! (como sabemos isso? ver Nota 1 )
Isto é, a migração acontece ao mesmo tempo que a formação do isocianato.
>
Precisamos redesenhar os mecanismos de Hofmann e Curtius para refletir isso, incorporando os dois passos.
Aqui está o Hofmann (note que o evento de desprotonação é realmente separado).
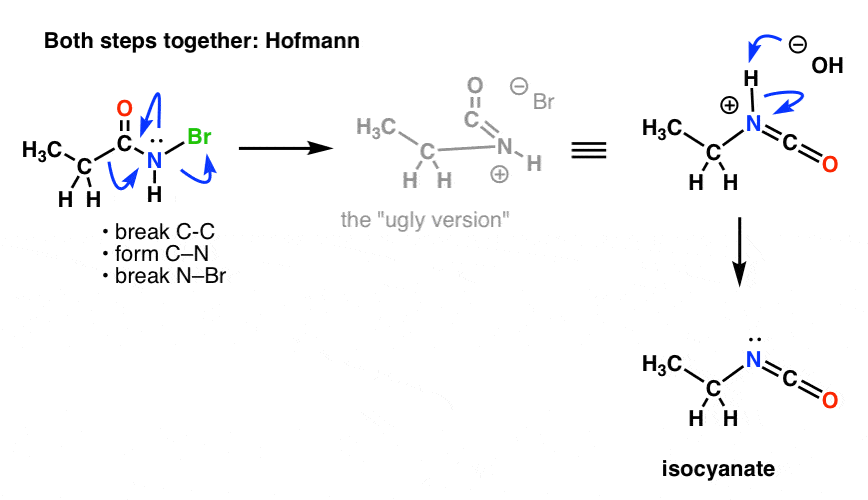
E o Curtius:
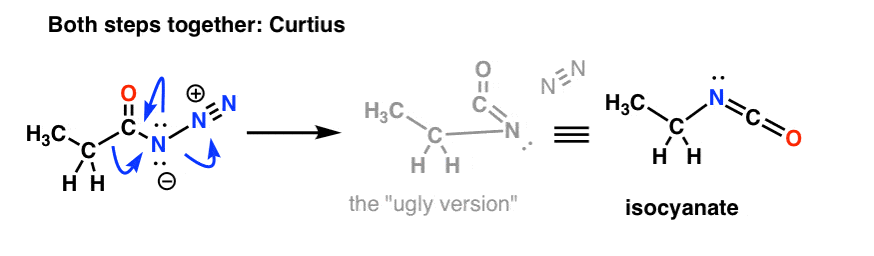
O Destino do Isocianato
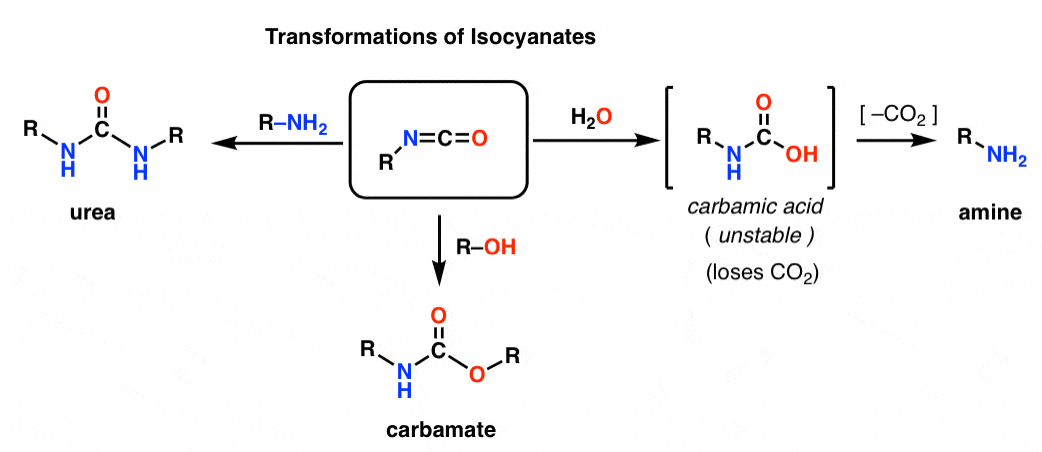
Bambos o Hofmann e o Curtius dão origem a um isocianato. Você provavelmente nunca encontrou isocianatos antes. À primeira vista, eles são espécies bastante estranhas, mas sua química não é tão diferente da de outras espécies de carbonil como ésteres, amidas e acyl halides.
A estrutura do isocianato assemelha-se muito à do dióxido de carbono, CO2. O carbono é ligado por pi a dois átomos fortemente eletronegativos. Isto faz do carbono um excelente eletrofilo.
>
Adicionando vários nucleófilos, os isocianatos podem ser transformados em outras espécies úteis.
>
– Adicionando um álcool resulta na formação de um carbamato
– Adicionando uma amina resulta em uma uréia
– Adicionando água resulta em um ácido carbâmico, que é instável. Os ácidos carbâmicos rapidamente perdem dióxido de carbono para dar uma amina.
>
 >
>
>
Em particular, o caminho da descarboxilação apresenta uma forma elegante de fazer aminas. Nós aprendemos toneladas de maneiras de fazer ácidos carboxílicos, mas não muitas maneiras de fazer aminas (além de substituição nucleofílica e aminação redutora). O Hofmann é um bom truque para ter no bolso de trás em situações onde nenhuma dessas situações pode se aplicar – como fazer anilinas substituídas, por exemplo.
Mecanismos? OK, tudo bem. Veja o tópico bônus 1.
Resumo: Os rearranjos de Hofmann e Curtius
O mecanismo desses rearranjos é complicado à primeira vista, mas fica consideravelmente mais fácil quando você percebe que já viu uma variante da reação de migração antes (i.e. em hidroboration-oxidation).
Eu recomendo vivamente que se desenhe primeiro a versão feia, porque ela irá ajudá-lo a concentrar-se em ver os laços que se formam e quebram, antes de tentar redesenhá-la numa estrutura esteticamente mais apelativa. Isto também vale para os rearranjos Beckmann e Wolff, que têm um passo semelhante.(ver abaixo)
Notas
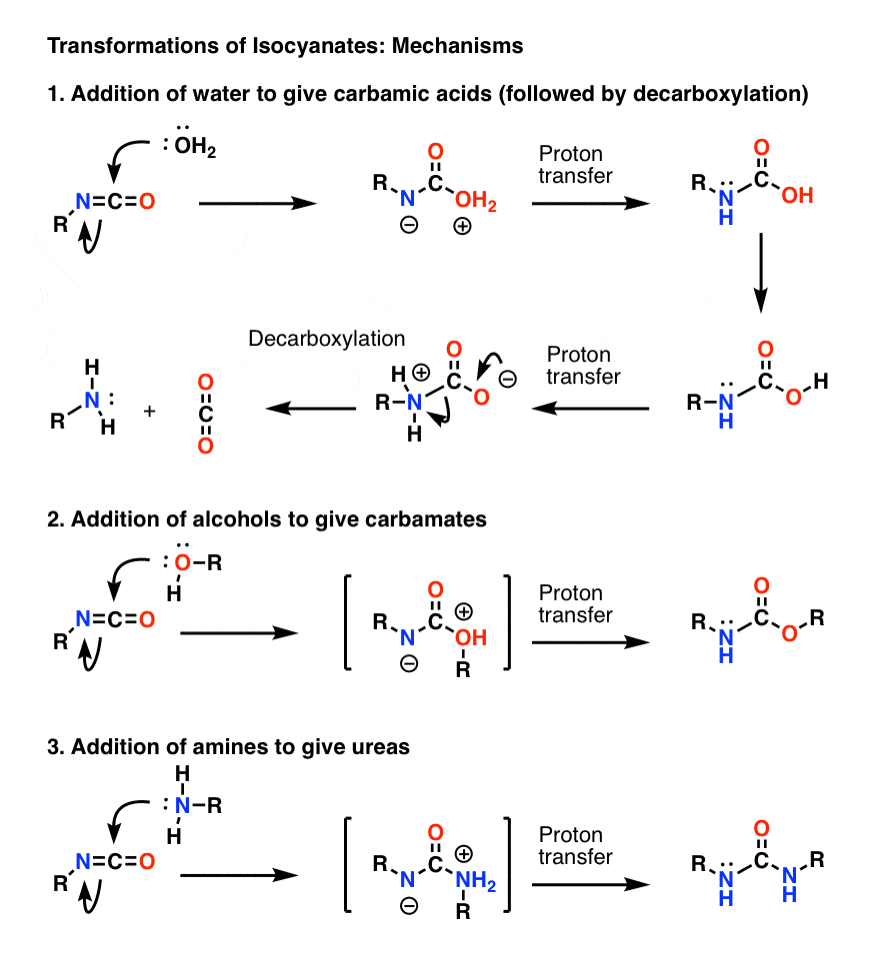
Bonus Tópico 1: Isocianatos
O mecanismo mais importante dos isocianatos é a adição electrofílica (isto é, adicionar um nucleófilo ao carbono central, electrofílico). No mecanismo abaixo mostrei o nucleófilo adicionando ao carbono para formar um ânion sobre o nitrogênio, embora esta provavelmente não seja a melhor forma de ressonância (o oxigênio é melhor para estabilizar a carga negativa do que o nitrogênio). A transferência de prótons do oxigênio para o nitrogênio resulta em uma espécie neutra. (Eu usei a Varinha Mágica de Transferência de Protões aqui, porque é mais rápida).
Note que o passo de descarboxilação em 1) não precisa ser precedido pela deportação do oxigênio, embora definitivamente precise ocorrer de tal forma que o nitrogênio seja protonado durante o passo (você não quer formar um íon amida fortemente básico, por exemplo).
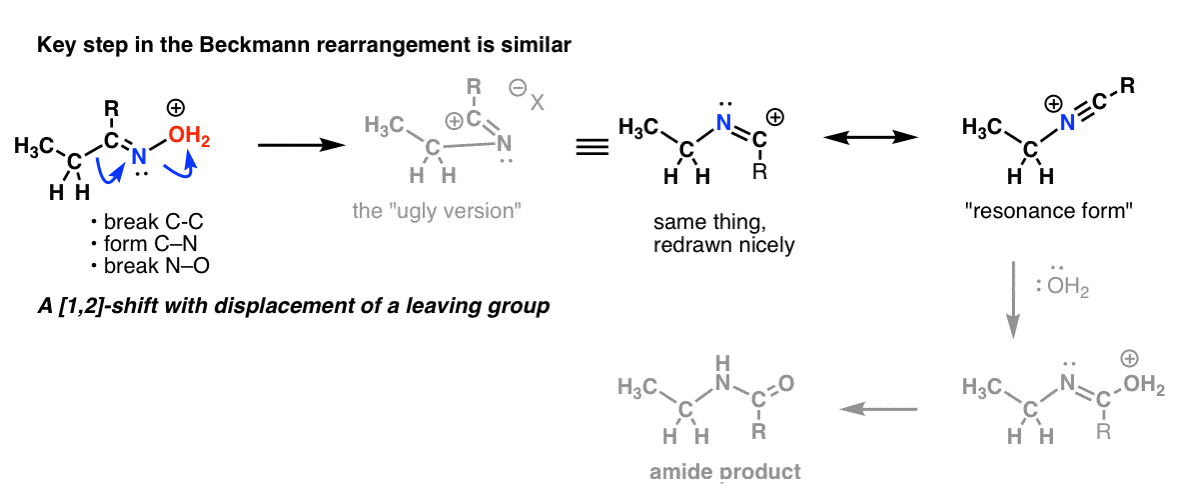
Bonus Tópico 2: O Beckmann, Wolff, e outros rearranjos partilham um passo semelhante
Mas espere, há mais!
Há um turno de 1,2 turnos com perda de um grupo de saída no rearranjo do Beckmann. O passo chave é essencialmente o mesmo que vimos no Hofmann e Curtius.
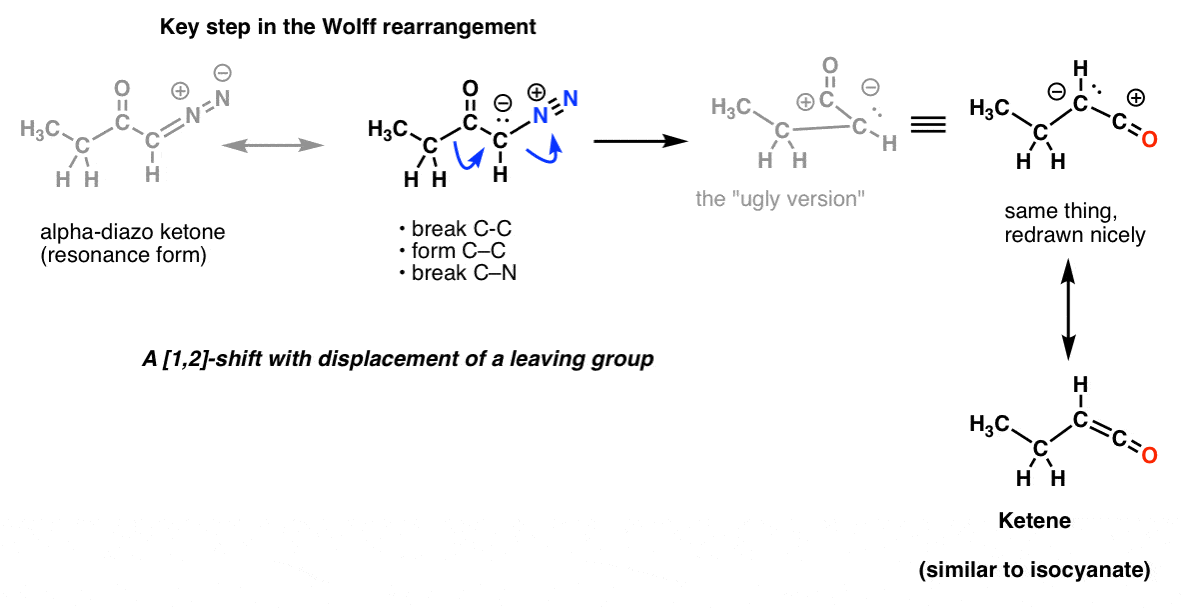
E no rearranjo Wolff, que normalmente também é coberto, você também pode reconhecer o mesmo passo chave.
E isso não é tudo! Há uma reação chamada rearranjo Schmidt, que é como o Curtius, mas vem da adição de HN3 a um cloreto de acilo (ou ácido carboxílico). E há outra chamada de rearranjo Lossen que ocorre com os ácidos hidroxiâmicos. Não há prêmios por adivinhar o passo chave nesses dois processos. E nós nem sequer mencionamos o Baeyer-Villiger, que não envolve nitrogênio, mas é praticamente o mesmo tipo de processo.
Quando eu aprendi o passo de hidroboration-oxidation no Org 1, muitas luas atrás, eu certamente nunca esperei que eu veria o mesmo padrão de reação se repetir em tantos guises diferentes.
A linha de fundo é que há um monte de reações que vão por nomes diferentes que procedem através do mesmo processo mecanicista. Isto realça a importância de aprender os padrões chave na química orgânica, porque eles certamente se repetem muito.
Endnote. Concertado, não separado?
Se o Curtius fosse escalonado, a perda de nitrogênio levaria a um nitrogênio. Os nitrenos sofrem uma série de reacções interessantes, como a inserção em ligações C-H (!). Assim, pode-se fazer um experimento para testar isto: se tentarmos o seguinte rearranjo do Curtius, poderíamos procurar evidências da formação de um anel de cinco membros.
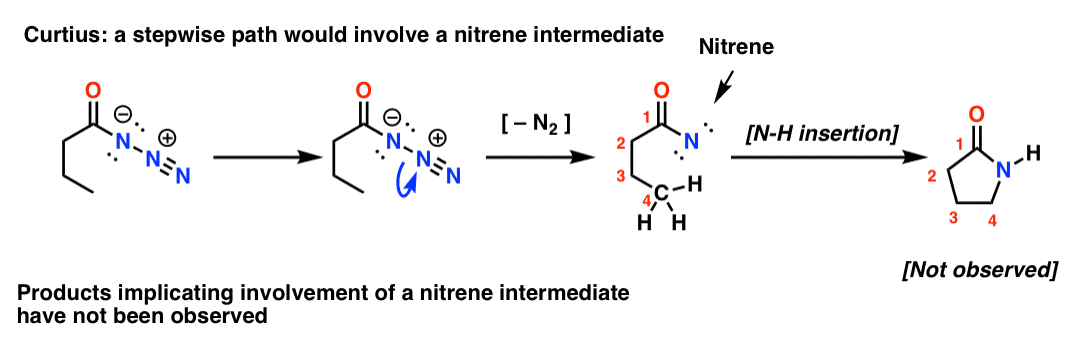
A ausência de tais produtos, juntamente com outras evidências, aponta para um mecanismo concertado.
(Advanced) References and Further Reading
- Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide
W. Hofmann
Chem. Ber. 1881, 14, 2725-2736
DOI: 10.1002/cber.188101402242
Papel original de A. W. Hofmann (que foi um químico muito produtivo e tem seu nome atribuído a muitas outras transformações) sobre a degradação de amidas a aminas primárias. - A Mild and Efficient Modified Hofmann Rearrangement
Xicai Huang, Mehran Seid, and Jeffrey W. Keillor
The Journal of Organic Chemistry 1997, 62 (21), 7495-7496
DOI:10.1021/jo9708553
Esta é uma rearranjo Hofmann modificada realizada em metanol – neste caso, o ácido carbâmico intermediário pode reagir com o solvente metanol para produzir carbamatos de metila em bom rendimento. - FORMAÇÃO DE CARBAMATO DE METILO ATRAVÉS DE REARRANGEMENTOS DE HOFMANN MODIFICADOS: METHYL N-(p-METHOXIPHENYL)CARBAMATO
Jeffrey W. Keillor e Xicai Huang
Org. Synth. 2002, 78, 234
DOI: 10.15227/orgsyn.078.0234
Um procedimento confiável e testado independentemente para a Reorganização Hofmann modificada na Ref #2. - A Reação Hofmann
Wallis, Everett L.; Lane, John F.
Org. Reagir. 1946, 3, 267-306
DOI: 10.1002/0471264180.or003.07
Uma revisão antiga mas abrangente (para seu tempo) sobre a reação de Hofmann (a reação amide to amine, para não ser confundida com suas outras reações). - Notas – Um Re-exame das Limitações da Reação de Hofmann
Ernest Magnien e Richard Baltzly
The Journal of Organic Chemistry 1958, 23 (12), 2029-2032
DOI:10.1021/jo01106a630
Este é um artigo interessante onde os autores tentaram estender o escopo do rearranjo de Hofmann para além do descrito no artigo original, ajustando cuidadosamente as condições de reação. - 20. Hydrazide und Azide organischer Säuren
Curtius, T. I. Abhandlung.
Journal Für Praktische Chemie, 50(1), 275-294. (1894).
DOI:1002/prac.18940500125 - Ueber Stickstoffwasserstoffsäure (Azoimid) N3H.
Curtius, T.
Berichte Der Deutschen Chemischen Gesellschaft, 23(2), 3023-3033.(1890).
DOI:1002/cber.189002302232
Primeiro trabalho de Theodore Curtius descrevendo a reatividade de hidrazidas acyl e azidas acyl. - A Reação Curtius
Smith, P. A. S.
Org. Reagir. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Uma revisão antiga mas abrangente da reação de Curtius, que inclui a história da descoberta deste rearranjo, escopo do substrato, limitações, comparação com outras reações similares e procedimentos experimentais. - ISOCYANATE UNDECYL
F. H. Allen e Alan Bell
Org. Synth. 1944, 24, 94
DOI: 10.15227/orgsyn.024.0094
Um procedimento antigo mas reprodutível e testado para sintetizar isocianatos através do Rearranjo Curtius. - Uma Síntese Expediente de (±)-Dievodiamina Total Livre de (±)-Dievodiamina
William P. Unsworth, Christiana Kitsiou, e Richard J. K. Taylor
Cartas Orgânicas 2013 15 (13), 3302-3305
DOI:1021/ol4013469
A primeira etapa desta síntese total usa um rearranjo Curtius para efetuar uma ciclização intramolecular do ácido carboxílico substituído pelo indole. - Métodos sintéticos e reações. 121. Preparação catalisada com iodeto de zinco de azidas aroílicas de cloretos aroílicos e trimetilsilílicos
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, e George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051
Um procedimento conveniente para a preparação de azidas aromáticas de arilo do Prémio Nobel Prof. Estas podem então ser usadas para rearranjos de Curtius.