VerbrandingEdit
Zoals de meeste andere koolwaterstoffen kunnen ook onverzadigde koolwaterstoffen verbrandingsreacties ondergaan waarbij bij volledige verbranding kooldioxide en water ontstaan. De reactievergelijking is:
- CxHy + y+4x/4O2 → y/2H2O + xCO2
Bij gebrek aan zuurstof zal de verbranding overgaan in onvolledige verbranding en koolmonoxide en koolstof produceren.
De onverzadigde koolwaterstoffen zullen gemakkelijker een onvolledig verbrandingsproduct produceren dan de verzadigde. Dientengevolge, heeft de verbranding van onverzadigde koolwaterstoffen gewoonlijk gele vlam, verschillend van de blauwe vlam van verzadigde degenen. Dit wijst erop dat bij de verbranding van onverzadigde koolwaterstoffen meerstappenmechanismen betrokken zijn, en het verbranden van koolstof geeft de gele vlamkleur.
Sinds onverzadigde koolwaterstoffen minder waterstofgehalte hebben, zal het minder water produceren en de vochtigheid van de vlam verminderen, evenals het zuurstofgebruik verminderen. Acetyleen (ethyne), bijvoorbeeld, kan worden gebruikt als brandstof.

Vergeleken met de enkele σ C-C bindingen in de verzadigde koolwaterstoffen, hebben de onverzadigde de elektronendichtheid in de π bindingen, die niet veel elektronendichtheid overlappen als de σ. Dientengevolge is de chemische energie die in één dubbele binding is opgeslagen minder dan in twee enkele bindingen. Bij de verbranding van onverzadigde koolwaterstoffen, waarbij de koolstof-koolstofbindingen worden verbroken om energie vrij te maken, komt dus minder energie vrij dan bij de verbranding van dezelfde molariteit van verzadigde koolwaterstoffen met hetzelfde aantal koolwaterstoffen. Deze tendens is duidelijk te zien in de lijst van standaard enthalpie van verbranding van koolwaterstoffen.
| Aantal Koolstof | Stof | Type | Formula | Hcø(kJ/mol) |
|---|---|---|---|---|
| 2 | ethaan | verzadigd | C2H6 | -1559.7 |
| etheen | onverzadigd | C2H4 | -1410.8 | |
| ethyne | onverzadigd | C2H2 | -1300.8 | |
| 3 | propaan | verzadigd | CH3CH2CH3 | -2219.2 |
| propeen | onverzadigd | CH3CH=CH2 | -2058.1 | |
| propyne | onverzadigd | CH3C≡CH | -1938.7 | |
| 4 | butaan | verzadigd | CH3CH2CH2CH3 | -2876.5 |
| but-1-eneen | onverzadigd | CH2=CH-CH2CH3 | -2716.8 | |
| but-1-yne | onverzadigd | CH≡C-CH2CH3 | -2596.6 |
Elektrofiele additieEdit
De dubbele of drievoudige bindingen die in onverzadigde koolwaterstoffen aanwezig moeten zijn, zorgen voor een hoge elektronendichtheid, waardoor de moleculen perfecte plekken worden voor elektrofiele additiereacties. In dit soort reacties zal één π binding tussen koolwaterstoffen breken in 2 afzonderlijke σ bindingen tussen elke koolstof en de toegevoegde groep. Bij het mechanisme is meestal een carbokation-tussenproduct betrokken.
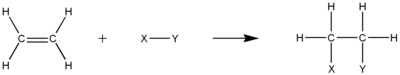
HydrogeneringEdit
Hydrogenering is de elektrofiele additie van waterstofgas aan onverzadigde koolwaterstof. Het resultaat zal een meer verzadigde koolwaterstof zijn, maar wordt niet noodzakelijkerwijs een verzadigde koolwaterstof. Zo kan bij half-hydrogenering van een alkyne een alkeen worden gevormd. Niettemin moet het totale aantal π-bindingen in het proces afnemen. De π koolstof-koolstof binding is ook noodzakelijk voor dit proces.
De reactievergelijking van hydrogenering van etheen tot ethaan is:
- H2C=CH2 + H2→H3C-CH3
De hydrogeneringsreactie vereist gewoonlijk katalysatoren om de snelheid ervan te verhogen.
Het totale aantal waterstof dat aan een onverzadigde koolwaterstof kan worden toegevoegd, hangt af van de onverzadigingsgraad van die koolwaterstof. Aan een onverzadigde koolwaterstof met formule CXHY kunnen maximaal 2X+2-Y waterstofatomen worden toegevoegd. Hierdoor wordt het molecuul verzadigd.
HalogeneringEdit
Gelijk aan waterstof levert de heterolyse van halogeen(X2) een elektrofiel X+ ion op, waarna het wordt aangevallen door het elektron op de π-binding. Anders dan waterstof zal halogenering haloniumionen als tussenproduct produceren in plaats van carbokationen in de meeste andere gevallen. Het haloniumkation laat weinig ruimte over voor de aanval van het X-ion en zal alleen in een transproduct veranderen. Het nettoresultaat van halogenering is een afname van één π-binding en een toename van twee koolstof-halogeen σ-bindingen op de 2 carbons.

De reactievergelijking voor broomadditie aan etheen is bijvoorbeeld:
- H2C=CH2 + Br2→H2CBr-CH2Br (trans)
Broomtest wordt gebruikt om de verzadiging van koolwaterstoffen te testen. Bij de proef wordt broomwater aan de onbekende koolwaterstof toegevoegd; als het broomwater door de koolwaterstof wordt ontkolomd, hetgeen het gevolg is van een halogeneringsreactie, kan worden geconcludeerd dat de koolwaterstof onverzadigd is. Wordt hij niet ontkolood, dan is hij verzadigd.
De broomproef kan ook worden gebruikt als indicatie van de onverzadigingsgraad voor onverzadigde koolwaterstoffen. Het broomgetal wordt gedefinieerd als de gram broom die kan reageren met 100 gram product. Net als hydrogenering is ook de halogenering van broom afhankelijk van het aantal π-bindingen. Een hoger broomgetal duidt op een hogere onverzadigingsgraad.
HydratatieEdit
De π-binding van onverzadigde koolwaterstoffen zijn ook bereid om H+ en OH- uit water te accepteren. Bij de reactie is meestal een sterk zuur als katalysator betrokken. Dat komt omdat de eerste stap van het mechanisme van hydratatie inhoudt dat de π-binding een H+ van het sterke zuur deprotoneert om een carbokation te vormen. Het nettoresultaat van de reactie is een alcohol.
De reactievergelijking voor hydratatie van etheen is:
- H2C=CH2 + H2O→H3C-CH2OH
De π-bindingen in de drievoudige binding kunnen in zure toestand ook hydrateren en enolen vormen. Het enol zal echter geen product zijn maar een tussenproduct, en het eindproduct zal een keton zijn. Het enol tussenproduct ondergaat tautomerisatie en vormt het stabielere keton.
De reactievergelijking van hydratatie van ethyne tot acetaldehyde is:
- HC≡CH + H2O → H2C=CH-OH
- H2C=CH-OH ⇌ H3C-CHO
HydrohalogeneringEdit

Bij hydrohalogenering wordt H-X toegevoegd aan onverzadigde koolwaterstoffen. Hierdoor neemt één π C=C binding af en ontstaan er 2 C-H en C-X σ bindingen met 2 afzonderlijke koolwaterstoffen. De vorming van het tussenliggende carbokation is selectief en volgt de regel van Markovnikov. De hydrohalogenering van alkeen resulteert in haloalkaan, en de hydrohalogenering van alkyne resulteert in vinylhalogenide. De hydrohalogenering van alkyne is veel langzamer dan de alkene.
De reactievergelijking van HBr-additie aan etheen is:
- H2C=CH2 + HBr→H3C-CH2Br
OxidatieEdit

Oxidatie van onverzadigde koolwaterstoffen is afhankelijk van de sterkte van het oxidatiemiddel. Een zwak oxidatiemiddel zal leiden tot dihydroxylering, verwijdering van één π-binding om twee σ-bindingen met zuurstof te vormen. Dihydroxylering van alkeen produceert diol, en dihydroxylering van alkyne produceert vicinale dicarbonyl.
Een sterker oxidatiemiddel, bijvoorbeeld KMnO4 of ozon, zal leiden tot oxidatieve splitsing. In dit geval breekt de π-binding met de σ-binding, waardoor het koolwaterstofmolecuul in tweeën wordt gedeeld. Zuurstof bindt zich met de resterende twee π-bindingen afzonderlijk. Oxidatieve splitsing van alkeen produceert ketonen of aldehyden, afhankelijk van de plaats van de dubbele binding, en splitsing van alkynen produceert carboxylzuur.
Allylische substitutieEdit
De π binding in onverzadigde koolwaterstoffen zal de dissociatie-energie van de allylische C-H bindingen verlagen, dat zijn C-H bindingen van de koolstof die grenst aan de sp2 koolwaterstoffen. Dientengevolge zal de vrije radicale substitutiereactie worden begunstigd boven de additiereacties.
Een voorbeeld hiervan is de NBS-bromeringsreactie met alkeen. De N-Br binding in NBS is zwak zodat er veel Br vrije radicaal zal worden gevormd. Het vrije radicaal zal de verzwakte allylische hydrogenen aanvallen en vervangen door broomatomen. De reactievergelijking is:
- RCH2CH=CH2 + (CH2CO)2NBr → RCHBrCH=CH2 + RCH=CHCH2Br + (CH2CO)2N
De reactie levert twee isomeren op waarbij broom aan verschillende koolwaterstoffen is gebonden. De reactie vereist een grote hoeveelheid vrije Br-radicalen in plaats van elektrofiele Br+-ionen, die een additiereactie zullen ondergaan. NBS is essentieel om een dergelijke toestand te bereiken.
Als koolwaterstofgroepen aan allylische koolstof zijn gehecht, zal deze koolstof meer verzadigd zijn. Volgens de regel van Zaitsev zal deze koolstof een stabieler carbokation intermediair vormen. Als gevolg daarvan zal allylische herschikking optreden en zal de π-binding naar deze koolstof verhuizen. Dit zal een belangrijk product opleveren van broom gesubstitueerd aan de koolstof vier bindingen verwijderd van de koolwaterstofgroep.
CycloadditionEdit

Voor onverzadigde koolwaterstoffen kunnen ringstructuur en π-bindingen beide de mate van onverzadiging verhogen, uitwisseling tussen ringstructuur en π-bindingen kan onder speciale omstandigheden optreden. Bijvoorbeeld, voor een geconjugeerd diene en een gesubstitueerd alkeen zal een Diels-Alder reactie optreden die een cyclohexeen vormt. Een dergelijke reactie is zeer selectief in de stereochemie.
Alkynen kunnen onder metaalkatalysatoren, bijvoorbeeld kobalt, ook een cycloadditie-reactie ondergaan die alkyne-trimeerisatie wordt genoemd. Drie alkynen ondergaan een “2+2+2” cyclisatiereactie en voegen zich snel samen om een benzeen te vormen. Trimerisatie van verschillende alkenen zijn gewoonlijk niet selectief, maar speciaal ontworpen katalysatoren kunnen de selectiviteit verhogen.
Reageren als ligandEdit

De gedelokaliseerde π-binding in onverzadigde koolwaterstoffen levert een hoge elektronendichtheid op, waardoor het molecuul een metaalligand kan worden. In alkeen ligand kan de bindingsstructuur worden beschreven door het Dewar-Chatt-Duncanson model. In dit geval wordt de π elektronendichtheid gedoneerd aan de metaal d orbitalen. Hoe sterker de donatie is, hoe sterker de back bonding van de metaal d orbitaal naar de π* anti-bonding orbitaal van het alkeen. Dit effect vermindert de bindingsvolgorde van het alkeen en vergroot de C-C bindingslengte. Als gevolg hiervan vormt het metaal een kleine ringstructuur met de twee carbons.
Het DCD-model kan ook de alkyne ligandstructuur beschrijven. Metaalcomplex kan ook tussenproduct zijn van trimerisatie van alkynen, zodat metalen katalysatoren van de reactie kunnen zijn.
De synthese van alkeenligandcomplexen kan worden beschreven als een elektrofiele additiereactie.
Gelijk aan lineaire onverzadigde koolwaterstoffen hebben de arenen ook gedelokaliseerde π bindingen die in staat zijn aan metalen te doneren om complexen te vormen. In gevallen zoals benzeen, doneren de koolstoffen evenveel elektronendichtheid aan het metaal, terwijl in sommige andere gevallen, de koolstoffen verschillend doneren aan het metaal, waardoor het areen wordt gebogen of dearomatiseert.