In deze serie geeft Colin Baker van de Bedford School spectaculaire demonstraties, bedoeld om tot de verbeelding van de leerling te spreken. De demonstraties zijn gemakkelijk voor te bereiden, veilig om weg te gooien en ze werken.
Niets heeft de neiging om chemische feiten zo op het netvlies te prenten als de tentoonstelling van interessante experimenten – Samuel Parkes, 1816
In september 1931 rapporteerde de Amerikaanse chemicus Wallace Carothers, werkzaam in de laboratoria van DuPont, onderzoek naar ‘reusachtige’ moleculen, polymeren genaamd, gebaseerd op een begrip van de chemische structuur van wol. Zijn werk concentreerde zich op een vezel die eenvoudigweg “66” werd genoemd, een getal dat was afgeleid van de moleculaire structuur ervan. In 1935 was nylon, de ‘wondervezel’, geboren en het was een enorm succes op zijn eerste markt, die van kousen voor vrouwen. Toen de VS in december 1941 de Tweede Wereldoorlog inging, bestemde de War Production Board de hele productie van nylon voor militair gebruik, waaronder parachutes en banden voor B29-bommenwerpers.

Bron: Colin Baker
De reactie tussen decaandioyl dichloride en 1,6-diaminohexaan
Een diacidechloride in een organisch oplosmiddel vormt een onmengbare laag met een alifatische diamine in water. Op het grensvlak, waar de twee kleurloze oplossingen elkaar ontmoeten, wordt een wit polymeer met lange ketens gevormd. Deze polymeerfilm kan van het grensvlak worden getrokken en wordt onmiddellijk vervangen wanneer hij wordt verwijderd. Als men stopt met trekken, lijkt er niets te gebeuren – de reactie stopt, maar wordt onmiddellijk hervat als men opnieuw begint te trekken. De reactie kan zich over verscheidene uren uitstrekken.

Bron: Colin Baker
Kit
- Cyclohexaan, 100cm3 (irriterend, licht ontvlambaar);
- Decaandioyl dichloride, 5.0cm3;
- Gedestilleerd water, 100cm3;
- Natriumwatervrij carbonaat, 10g;
- 1,6-diaminohexaan, 5.0g;
- Twee bekerglazen, 250cm3;
- Beker, 5cm3;
- Wisselpincetten;
- Glasstaafjes.
Veiligheid
Decaandioyl dichloride en 1,6-diaminohexaan zijn bijtend. Ze zijn schadelijk bij inslikken of inademen, en bij contact met de huid veroorzaken ze brandwonden. Het zijn ernstige irriterende stoffen. Cyclohexaan is licht ontvlambaar en irriterend.
Procedure
Prepareer de volgende twee oplossingen:
Oplossing A: decaandioyldichloride in cyclohexaan. Doe 100 cm3 cyclohexaan in een bekerglas van 250 cm3, voeg 5,0 cm3 decaandioyl dichloride toe en roer om op te lossen. Deze oplossing is ongeveer vier weken houdbaar.
Oplossing B: 1,6-diaminohexaan in waterig natriumcarbonaat. Breng 100 cm3 gedestilleerd water in een bekerglas van 250 cm3, voeg 10 g watervrij natriumcarbonaat toe en roer om op te lossen. Voeg 5,0 g vast 1,6-diaminohexaan toe en roer om op te lossen.
Giet 2 cm3 oplossing A in een 5 cm3 bekerglas. Voeg voorzichtig een gelijk volume van oplossing B toe. Oplossing A bevat het organische oplosmiddel, is dichter dan de waterige laag, en is daarom de onderste laag. Pak de polyamidefilm (een witte vaste stof) die zich begint te vormen op het grensvlak van deze twee oplossingen met een pincet vast en trek hem langzaam uit het bekerglas. Wikkel de vezel om een glazen staaf en blijf trekken. Stop het proces wanneer een van de reactanten is opgebruikt.
Speciale tips
Bij het toevoegen van de tweede oplossing moet men voorzichtig te werk gaan om vermenging te voorkomen. Demonstreer hoe de vezel in één ononderbroken draad kan worden uitgetrokken en organiseer vervolgens een wedstrijd om te zien welk tweetal leerlingen de langste vezel kan produceren. Zij moeten in staat zijn tot 5m te produceren voordat de vezel knapt. Al snel zullen ze beseffen dat ze hulp nodig hebben om de vezel te ondersteunen – ik verdeel de klas in twee grote groepen, elk gewapend met glazen staven. Mijn leerlingen hebben vezels van meer dan 30 m geproduceerd en zelfs geprobeerd om hoeken om te gaan. U moet het maximale volume van elke oplossing beperken tot 10 cm3. De leerlingen moeten handschoenen dragen en contact met de vezel vermijden. Als de vezel knapt, moet hij in absorberend papier worden gewikkeld. Eventueel gemorst materiaal moet met absorberend papier worden opgedweild en bij het afval worden gedaan.
Leerdoelen
Polyamiden zijn polymeren waarin de repeterende eenheden bij elkaar worden gehouden door amideverbindingen, -CO-NH-.
Nylon-6,10
Nylon-6,10 is gemaakt van twee monomeren, waarvan het ene zes koolstofatomen bevat en het andere 10 – vandaar de naam. Het monomeer met 10 koolstofatomen is decaandioleendichloride (ClOC(CH2)8 COCl), een zuurchloride met een -COCl-groep aan elk uiteinde. Het andere monomeer is een keten van zes koolstofatomen met een aminogroep, -NH2, aan elk uiteinde. Dit is 1,6-diaminohexaan (H2 N(CH2)6 NH2, ook bekend als hexaan-1,6-diamine).
Wanneer deze twee verbindingen polymeriseren, verbinden de amine- en zuurgroepen zich, waarbij telkens een molecuul waterstofchloride verloren gaat:
n ClOC-(CH2)8-COCl + n H2N-(CH2)6-NH2 → -(CO-(CH2)8-CONH-(CH2)6-NH)n – + n HCl
Dit polymeervormende proces waarbij een kleine molecuul verloren gaat, staat bekend als condensatiepolymerisatie.
Nylon-6,6
Dit polymeer wordt gemaakt door condensatie van twee zes-koolstofmoleculen, hexaandizuur en 1,6-diaminohexaan. In de industrie wordt cyclohexaan gebruikt om beide monomeren te maken. Als cyclohexaan wordt geoxideerd, gaat de ring open en krijgen beide uiteinden van de keten een zuurgroep – hexaandizuur wordt gevormd. Als dit zuur met ammoniak wordt geneutraliseerd, ontstaat het diammoniumzout (NH4 OOCCH2 CH2 CH2 COONH4) dat kan worden gedehydrateerd (door verhitting tot 350°C) en gereduceerd (met H2/Ni) tot 1,6-diaminohexaan. Condensatiepolymerisatie van de diacide en de diamine treedt op met verlies van water:
n HOOC-(CH2)4 -COOH + n H2 N-(CH2)6 -NH2 → -(CO-(CH2)4 -CONH-(CH2)6 -NH)n – + n H2 O
Nylon-6
Het is mogelijk nylon te maken uit het enkelvoudige monomeer caprolactam (hexahydro-2H-azepin-2-one, 1).
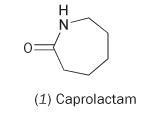
Caprolactam bevat een interne amideverbinding. Polymerisatie van dit molecuul leidt tot ringopening en verbinding tot een continue keten:
-(NH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CO)n –
Nylon heeft een revolutie teweeggebracht in de textielindustrie en was de voorloper van veel van de moderne, synthetische vezels van tegenwoordig. Het blijft een belangrijk en veel gebruikt materiaal in de industrie.