Generieke naam: fluocinonide
Doseringsvorm: Gel
Medisch beoordeeld door Drugs.com. Laatst bijgewerkt op 22 juni 2020.
- Overzicht
- Bijwerkingen
- Dosering
- Professioneel
- Interacties
- Meer
Rx Only
De merknaam Lidex is in de V.S. niet meer verkrijgbaar.S. Als generieke versies van dit product door de FDA zijn goedgekeurd, zijn er mogelijk generieke equivalenten beschikbaar.
- Lidex Beschrijving
- Lidex – Klinische farmacologie
- Farmacokinetiek
- Indicaties en gebruik voor Lidex
- Contra-indicaties
- Voorzorgsmaatregelen
- Algemeen
- Informatie voor de patiënt
- Laboratoriumtesten
- Carcinogenese, mutagenese, en aantasting van de vruchtbaarheid
- Volwassenheid Categorie C
- Nursing Mothers
- Pediatrisch gebruik
- Bijwerkingen
- Overdosering
- Lidex Dosering en Toediening
- Hoe wordt Lidex geleverd
- Veel gestelde vragen
- Meer over Lidex (fluocinonide topisch)
- Consumer resources
- Professionele bronnen
- Gerelateerde behandelingsgidsen
Lidex Beschrijving
Lidex® (fluocinonide) Gel 0,05% is bestemd voor uitwendige toediening. Het werkzame bestanddeel is het corticosteroïde fluocinonide, dat de 21-acetaat ester is van fluocinolone acetonide en de chemische naam pregna-1,4-diene-3,20-dione,21-(acetyloxy)-6,9-difluoro-11-hydroxy-16,17–,(6α,11β,16α)- heeft. Het heeft de volgende chemische structuur:
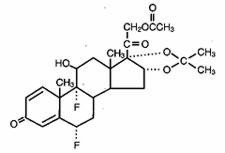
Lidex Gel bevat fluocinonide 0,5 mg/g in een speciaal samengestelde gelbasis bestaande uit carbomer 940, edetaatdinatrium, popylgallaat, propyleenglycol, natriumhydroxide en/of zoutzuur (om de pH aan te passen), en water (gezuiverd). Dit heldere, kleurloze, thixotrope medium is vetvrij, niet vlekkend en volledig mengbaar met water.
In deze formulering is het werkzame bestanddeel volledig in oplossing.
Lidex – Klinische farmacologie
Topische corticosteroïden hebben een ontstekingsremmende, anti-pruritische en vasoconstrictieve werking.
Het mechanisme van de ontstekingsremmende werking van de topische corticosteroïden is onduidelijk. Verschillende laboratoriummethoden, waaronder vasoconstrictor assays, worden gebruikt om de potenties en/of klinische werkzaamheid van de topische corticosteroïden te vergelijken en te voorspellen. Er zijn aanwijzingen dat er een herkenbare correlatie bestaat tussen de vasoconstrictorpotentie en de therapeutische werkzaamheid bij de mens.
Farmacokinetiek
De mate van percutane absorptie van topische corticosteroïden wordt bepaald door vele factoren, waaronder het medium, de integriteit van de epidermale barrière, en het gebruik van occlusieve verbanden.
Topische corticosteroïden kunnen worden geabsorbeerd uit de normale intacte huid. Ontsteking en/of andere ziekteprocessen in de huid verhogen de percutane absorptie. Occlusieve verbanden verhogen de percutane absorptie van topische corticosteroïden aanzienlijk. Derhalve kunnen occlusieve verbanden een waardevol therapeutisch hulpmiddel zijn bij de behandeling van resistente dermatosen (zie BIJSLUITING EN TOEDIENING).
Eenmaal door de huid geabsorbeerd, worden topische corticosteroïden verwerkt via farmacokinetische routes die vergelijkbaar zijn met systemisch toegediende corticosteroïden. Corticosteroïden worden in verschillende mate gebonden aan plasma-eiwitten. Corticosteroïden worden voornamelijk in de lever gemetaboliseerd en vervolgens door de nieren uitgescheiden. Sommige topische corticosteroïden en hun metabolieten worden ook in de gal uitgescheiden.
Indicaties en gebruik voor Lidex
Lidex Gel is geïndiceerd voor de verlichting van de inflammatoire en pruritic manifestaties van corticosteroïd-responsieve dermatosen.
Contra-indicaties
Topische corticosteroïden zijn gecontra-indiceerd bij patiënten met een voorgeschiedenis van overgevoeligheid voor één van de bestanddelen van het preparaat.
Voorzorgsmaatregelen
Algemeen
Systemische absorptie van topische corticosteroïden heeft bij sommige patiënten reversibele onderdrukking van de hypothalamus-hypofyse-bijnieras (HPA-as), manifestaties van het syndroom van Cushing, hyperglykemie en glucosurie veroorzaakt.
Omstandigheden die de systemische absorptie verhogen zijn onder meer het aanbrengen van de sterkere steroïden, gebruik op grote oppervlakken, langdurig gebruik, en het aanbrengen van occlusief verband.
Patiënten die een grote dosis van een sterk lokaal steroïd krijgen, aangebracht op een groot oppervlak of onder een occlusief verband, moeten daarom periodiek worden geëvalueerd op aanwijzingen voor onderdrukking van de HPA-as met behulp van de urinaire vrije cortisol- en ACTH-stimulatietest. Als onderdrukking van de HPA-as wordt waargenomen, moet worden geprobeerd het geneesmiddel te staken, de toepassingsfrequentie te verlagen of een minder krachtig steroïd te vervangen.
Herstel van de HPA-asfunctie treedt in het algemeen snel en volledig op na het staken van het geneesmiddel. In zeldzame gevallen kunnen tekenen en symptomen van steroïdontwenning optreden, waarbij aanvullende systemische corticosteroïden nodig zijn.
Kinderen kunnen verhoudingsgewijs grotere hoeveelheden topische corticosteroïden absorberen en daardoor gevoeliger zijn voor systemische toxiciteit (zie VOORZORGSMAATREGELEN-Pediatrisch gebruik). Indien irritatie ontstaat, dienen topische corticosteroïden te worden gestaakt en dient een geschikte therapie te worden ingesteld.
Zoals bij elk topisch corticosteroïd product, kan langdurig gebruik atrofie van de huid en de onderhuidse weefsels veroorzaken. Bij gebruik op intertrigineuze of flexorzones, of op het gezicht, kan dit zelfs bij kortdurend gebruik optreden.
In aanwezigheid van dermatologische infecties dient het gebruik van een geschikt antischimmel- of antibacterieel middel te worden ingesteld. Als er niet onmiddellijk een gunstige reactie optreedt, moet het corticosteroïd worden gestaakt totdat de infectie voldoende onder controle is.
Informatie voor de patiënt
Patiënten die topische corticosteroïden gebruiken, dienen de volgende informatie en instructies te krijgen:
- Dit geneesmiddel dient te worden gebruikt zoals voorgeschreven door de arts. Het is uitsluitend bestemd voor uitwendig gebruik. Vermijd contact met de ogen.
- Patiënten moet worden geadviseerd dit geneesmiddel niet te gebruiken voor een andere aandoening dan die waarvoor het is voorgeschreven.
- Het behandelde huidgebied mag niet worden ingezwachteld of anderszins bedekt of ingepakt om occlusief te zijn, tenzij op aanwijzing van de arts.
- Patiënten moeten alle tekenen van lokale bijwerkingen melden, vooral onder occlusief verband.
- Voeders van pediatrische patiënten moeten worden geadviseerd geen nauwsluitende luiers of plastic broekjes te gebruiken bij een kind dat in het luiergebied wordt behandeld, aangezien deze kledingstukken occlusief verband kunnen vormen.
Laboratoriumtesten
De volgende testen kunnen nuttig zijn bij het evalueren van de onderdrukking van de HPA-as:
Urinaire vrije cortisoltest
ACTH-stimulatietest
Carcinogenese, mutagenese, en aantasting van de vruchtbaarheid
Langetermijnstudies bij dieren zijn niet uitgevoerd om het carcinogene potentieel of het effect op de vruchtbaarheid van topische corticosteroïden te evalueren.
Studies ter bepaling van de mutageniteit met prednisolon en hydrocortison hebben negatieve resultaten opgeleverd.
Volwassenheid Categorie C
Corticosteroïden zijn in het algemeen teratogeen bij proefdieren wanneer ze systemisch worden toegediend in relatief lage doseringsniveaus. Van de krachtigere corticosteroïden is aangetoond dat ze teratogeen zijn na toepassing op de huid bij laboratoriumdieren. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen naar teratogene effecten van topisch aangebrachte corticosteroïden. Daarom mogen topische corticosteroïden alleen tijdens de zwangerschap worden gebruikt als het potentiële voordeel opweegt tegen het potentiële risico voor de foetus. Geneesmiddelen van deze klasse mogen niet op grote schaal, in grote hoeveelheden of gedurende langere perioden worden gebruikt bij zwangere patiënten.
Nursing Mothers
Het is niet bekend of topische toediening van corticosteroïden kan resulteren in voldoende systemische absorptie om detecteerbare hoeveelheden in de moedermelk te produceren. Systemisch toegediende corticosteroïden worden in de moedermelk uitgescheiden in hoeveelheden waarvan het niet waarschijnlijk is dat ze een schadelijk effect hebben op de zuigeling. Niettemin is voorzichtigheid geboden wanneer topische corticosteroïden worden toegediend aan een zogende vrouw.
Pediatrisch gebruik
Pediatrische patiënten kunnen een grotere gevoeligheid vertonen voor topische corticosteroïd-geïnduceerde HPA-as onderdrukking en het syndroom van Cushing dan volwassen patiënten vanwege een grotere verhouding tussen huidoppervlak en lichaamsgewicht.
Suppressie van de hypothalamus-hypofyse-bijnieras (HPA), het syndroom van Cushing en intracraniële hypertensie zijn gemeld bij kinderen die topische corticosteroïden krijgen. Manifestaties van bijnsuppressie bij kinderen zijn onder andere lineaire groeiachterstand, vertraagde gewichtstoename, lage cortisolspiegels in plasma en geen respons op ACTH-stimulatie. Manifestaties van intracraniële hypertensie zijn uitpuilende fontanellen, hoofdpijn en bilateraal papilledema.
Toediening van topische corticosteroïden aan kinderen moet worden beperkt tot de kleinste hoeveelheid die verenigbaar is met een effectief therapeutisch regime. Chronische corticosteroïdtherapie kan de groei en ontwikkeling van kinderen verstoren.
Bijwerkingen
De volgende lokale bijwerkingen worden zelden gemeld met topische corticosteroïden, maar kunnen vaker voorkomen bij het gebruik van occlusieve verbanden. Deze reacties zijn gerangschikt in afnemende volgorde van voorkomen:
| Branderigheid | Periorale dermatitis |
| Jeuk | Allergische contactdermatitis |
| Irritatie | Maceratie van de huid |
| Droogheid | Secondaire infectie |
| Folliculitis | Huidatrofie |
| Hypertrichosis | Striae |
| Acneiforme erupties | Miliaria |
| Hypopigmentatie |
Overdosering
Topisch aangebrachte corticosteroïden kunnen in voldoende hoeveelheden worden geabsorbeerd om systemische effecten te veroorzaken (zie VOORZORGSMAATREGELEN).
Lidex Dosering en Toediening
Lidex Gel wordt in het algemeen twee tot vier maal daags als een dunne film op het aangedane gebied aangebracht, afhankelijk van de ernst van de aandoening.
Occlusief verband kan worden gebruikt voor de behandeling van psoriasis of recalcitrante aandoeningen.
Als zich een infectie ontwikkelt, moet het gebruik van occlusieve verbanden worden gestaakt en moet een geschikte antimicrobiële therapie worden ingesteld.
Hoe wordt Lidex geleverd
Lidex® (fluocinonide) Gel 0.05% wordt geleverd in
tube van 15 g – NDC 99207-507-13
tube van 30 g – NDC 99207-507-14
tube van 60 g – NDC 99207-507-17
bewaren bij kamertemperatuur 15°-30°C (59°-86°F).
Vervaardigd voor:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
April 2001
IN-5071/S
| Lidex fluocinonide gel |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
Etiketteraar – MEDICIS
Veel gestelde vragen
- Wordt het gebruikt tegen haaruitval?
- Wat is een vervanger voor fluocinonide crème?
- Is fluocinonide een antischimmel crème?
- Hoe lang moet u fluocinonide gebruiken?
- Waar is fluocinonide crème goed voor?
- Kan fluocinonide gebruikt worden om een poison ivy uitslag te behandelen?
- Is het een steroïde?
- Is dit een antibioticum?
Meer over Lidex (fluocinonide topisch)
- Bijwerkingen
- Tijdens zwangerschap of borstvoeding
- Doseringsinformatie
- Gedragsinteracties
- 8 Reviews
- Generieke beschikbaarheid
- Gedragsklasse: topische steroïden
Consumer resources
- Verbeterde lezing
- Lidex Mild (gevorderde lezing)
- Lidex Regular (gevorderde lezing)
Professionele bronnen
- Voorschrijfinformatie
- Lidex Topical Solution (FDA)
- Lidex Ointment (FDA)
Andere merken Vanos, Lidex-E
Gerelateerde behandelingsgidsen
- Atopic Dermatitis
- Eczema
- Dermatitis
- Psoriasis
Medische disclaimer