Het gebruik en het belang van cellen en batterijen zijn onbetwistbaar. In ons dagelijks leven maken we op zo veel verschillende manieren gebruik van cellen. In de afgelopen concepten hebben wij u al kennis laten maken met batterijen in het algemeen. Maar hier geven we u een diepgaande analyse van galvanische cellen. Dus, laten we beginnen.
Suggested Videos
Galvanische cellen
Een galvanische cel is onder andere een soort elektrochemische cel. Hij wordt gebruikt om elektrische stroom te leveren door de overdracht van elektronen via een redoxreactie. Een galvanische cel is een voorbeeld van hoe energie kan worden benut met behulp van eenvoudige reacties tussen een paar gegeven elementen. Het is verbazingwekkend te bestuderen hoe een galvanische cel kan worden opgezet en gebruikt om energie te verkrijgen.
In de meest eenvoudige bewoordingen uitgelegd, fungeert een galvanische cel als een apparaat waarin gelijktijdige oxidatie- en reductiereacties plaatsvinden. Deze reacties worden gebruikt om de chemische energie in elektrische energie om te zetten, die voor om het even welke commerciële doeleinden kan worden gebruikt.
Bekijk meer onderwerpen onder Elektrochemie
- Batterijen
- Geleidbaarheid van elektrolytische oplossingen
- Corrosie
- Elektrochemische Cellen
- Elektrolytische Cellen en Elektrolyse
- brandstofcellen
- Nernstvergelijking
- Variatie van geleidbaarheid en molaire geleidbaarheid met concentratie
Werking van Galvanische Cellen

De werking van een galvanische cel is vrij eenvoudig. Het gaat om een chemische reactie die als eindresultaat elektrische energie oplevert. Tijdens een redox-reactie maakt een galvanische cel gebruik van de energieoverdracht tussen elektronen om chemische energie om te zetten in elektrische energie.
Galvanische cel maakt gebruik van het vermogen om de stroom elektronen in het proces van oxidatie en reductie te scheiden, waarbij een halfreactie wordt veroorzaakt en elk met een draad wordt verbonden, zodat een pad kan worden gevormd voor de stroom elektronen door deze draad. Deze stroom van elektronen wordt in wezen stroom genoemd. Dergelijke stroom kan worden gemaakt om door een draad te stromen om een circuit te voltooien en zijn output in om het even welk apparaat zoals een televisie of een horloge te verkrijgen.
Een galvanische cel kan van om het even welke twee metalen worden gemaakt. Deze twee metalen kunnen de anode en de kathode vormen als ze met elkaar in contact worden gebracht. Deze combinatie maakt de galvanische corrosie mogelijk van dat metaal dat meer anodisch is. Er is een verbindingscircuit nodig om deze corrosie te laten plaatsvinden.
Opstelling van een Galvanische Cel
Om een galvanische cel te maken, zou men de volgende opstelling moeten doorlopen. De cel zou idealiter twee elektroden omvatten. Een van deze elektroden, de kathode, moet een positief geladen elektrode zijn, terwijl de andere, de anode, de negatief geladen elektrode moet zijn.
Deze twee elektroden vormen de twee essentiële onderdelen van de galvanische cel. De chemische reactie met betrekking tot de reductie zal plaatsvinden aan de kathode, terwijl de oxidatiehalfreactie zal plaatsvinden aan de anode. Zoals reeds gezegd, kunnen om het even welke twee metalen worden gebruikt om de chemische reactie tot stand te brengen.
Inzicht in de Galvanische cel met een voorbeeld
Laten we een voorbeeld nemen waarbij de twee metalen die bij de chemische reactie betrokken zijn zink en koper zijn. Als de chemische reactie plaatsvindt, zou het zink twee elektronen verliezen. Dit zal door koper worden opgenomen om elementair koper te worden. Aangezien deze twee metalen in twee afzonderlijke recipiënten worden geplaatst en door een geleidende draad worden verbonden, zou een elektrische stroom worden gevormd, die alle elektronen van het ene metaal naar het andere zou overbrengen.
Op hetzelfde ogenblik zullen de twee metalen in een zoutoplossing worden ondergedompeld, zeg, zinksulfaat en kopersulfaat in dit geval. In dit geval worden de twee oplossingen niet rechtstreeks met elkaar vermengd, maar kunnen zij worden samengevoegd met behulp van een brug of een medium. Dit medium is verantwoordelijk voor de overdracht van ionen, maar zorgt er ook voor dat de twee oplossingen niet met elkaar vermengd raken.
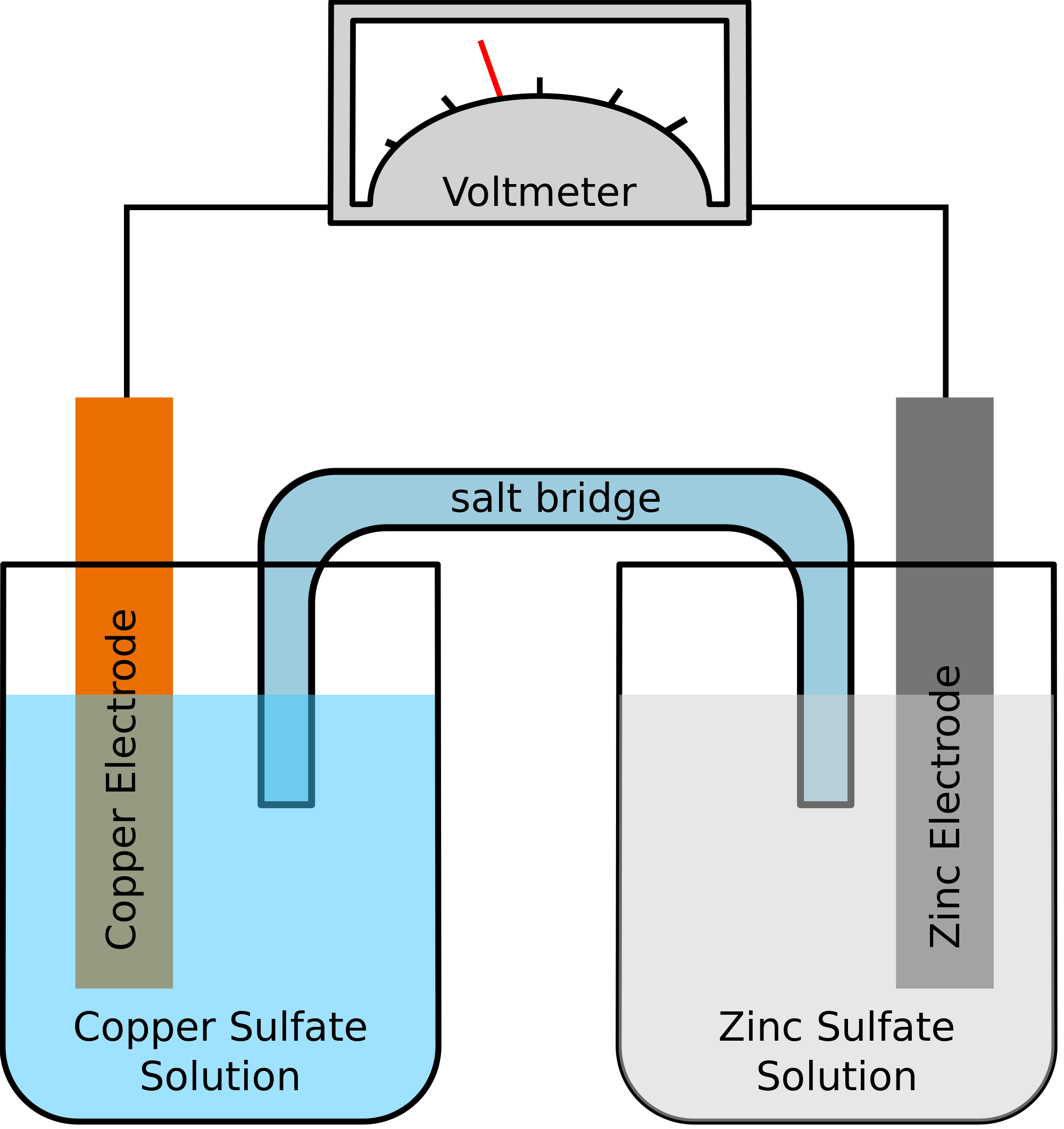
Zo’n brug helpt bij het voltooien van de stroomkring voor het overbrengen van de elektrische lading en zorgt er ook voor dat de oplossingen in de recipiënten met de metalen neutraal blijven en niet met elkaar vermengen. Zolang de zoutbrug niet interfereert met de redoxreactie, waarbij oxidatie en reductie plaatsvinden, maakt het niet uit welke zoutbrug in de chemische reactie wordt gebruikt.
Enkele belangrijke termen
Enkele belangrijke termen die in een galvanische cel in gebruik worden genomen, worden hieronder opgesomd:
- Phase grenzen: Het verwijst naar de twee metalen die als kathode en anode fungeren.
- Zoutbrug: De verbindingsbrug of het medium dat een redoxreactie mogelijk maakt.
- Oxidatie en reductie: De chemische processen die de elektrische stroom laten vormen en stromen door een galvanische cel.
Oplossingsvoorbeelden voor jou
Vraag: Wat zou er in een galvanische cel gebeuren als er geen zoutbrug wordt gebruikt terwijl de redoxreactie plaatsvindt?
Oplossing: Bij afwezigheid van een zoutbrug binnen elk vat dat de metalen bevat, zou de redoxreactie op vrijwel dezelfde wijze beginnen. Maar bij afwezigheid van de zoutbrug zou deze tamelijk abrupt tot een einde komen. De respectieve oplossingen zullen niet in staat zijn hun elektrische neutraliteit te behouden. Afgezien hiervan zal er geen verandering optreden in de chemische reactie of enige verandering van welke aard dan ook als gevolg van de afwezigheid van de zoutbrug of het medium.