General Overview
Een groot deel van de micro-organismen bevindt zich niet alleen in ons, maar leeft ook op ons. De menselijke huid herbergt namelijk een heterogene mix van meestal niet-pathogene bacteriën, schimmels en virussen die waarschijnlijk bijdragen tot de gezondheid van het huidoppervlak (figuur 1). Propionibacterium acnes (P. acnes) is een alomtegenwoordige, langzaam groeiende, staafvormige, niet-sporevormende, Gram-positieve anaerobe (figuur 2) die op verschillende plaatsen op het lichaam wordt aangetroffen, waaronder talgklieren van het gezicht en de hals (Funke et al., 1997; Grice en Segre, 2011; Findley en Grice, 2014). Het wordt vaak beschouwd als onderdeel van onze commensale microbiota op barrièreplaatsen (Cogen et al., 2008) die tot stand komt via mechanismen van adaptieve immuuntolerantie tijdens de vroege neonaatperiode (Scharschmidt et al., 2015). Hoewel de topografische verdeling van de anaerobe in talgklierplaatsen significant is, is de ruimtelijke en persoonlijke verdeling van P. acnes meer individu-specifiek dan plaats-specifiek (Oh et al., 2014). Bovendien is de biogeografie en individualiteit van P. acnes zeer dynamisch, omdat veranderingen in gezondheid of veranderingen in pH, temperatuur, vocht en/of talggehalte ook van invloed kunnen zijn op het bereik van de niches die door het micro-organisme worden bezet (Grice et al., 2009). Vergelijkbaar met de verspreiding van huidmicroben, kunnen huidcondities ook de functie van P. acnes bepalen in termen van uitbreiding van ziekteverwekkers bij ziekte. Zo is P. acnes in verband gebracht met huidaandoeningen zoals acne vulgaris in het gezicht en de hals, en progressieve maculaire hypermelanose op de rug (Bojar en Holland, 2004; Kurokawa et al., 2009; Barnard et al., 2016). Bovendien hebben bepaalde ziekte-geassocieerde fylotypen van P. acnes het vermogen om te persisteren op lichaamsimplantaten en chirurgische hulpmiddelen die een breed scala aan postoperatieve infectieuze aandoeningen veroorzaken, zoals endocarditis, endophthalmitis en intravasculaire infecties van het zenuwstelsel (Perry en Lambert, 2011; Portillo et al., 2013). De ongewenste kenmerken van P. acnes breiden zich ook uit tot de prostaatklier, waar weefselinvasie en intracellulaire afzetting van de bacterie vaak is waargenomen in klierepitheelcellen en circulerende macrofagen; een fenomeen waarvan wordt aangenomen dat het indirect bijdraagt aan goedaardige prostaathyperplasie (BPH) en prostaatkanker (Tanabe et al., 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016). Het is echter niet duidelijk wat de onderliggende mechanismen zijn die door P. acnes worden gebruikt om infectie, ontsteking en/of metastase buiten de huid te induceren. Wat wel met enige zekerheid bekend is, is dat door bacteriën geïnfecteerde keratinocyten, sebocyten en/of adipocyten verschillende pro-inflammatoire chemokines en cytokines afscheiden, evenals anti-microbiële factoren (bijv, cathelicidine) die wijzen op specifieke ziektemechanismen (Graham et al., 2004; Nagy et al., 2006; Lee et al., 2010; Zhou et al., 2015; Sanford et al., 2016; Yu et al., 2016).
Figuur 1. Schematische weergave van veel voorkomende microben die worden aangetroffen op barrièreplaatsen bij de mens, waaronder P. acnes. Hoewel P. acnes aanwezig is op alle externe en interne oppervlakken (d.w.z. orale en gastro-intestinale epithelia, bindvlies), komt het het meest voor op de menselijke huid. Daar bevindt het zich in de haarfollikels van het gezicht en de rug, waar het in verband wordt gebracht met de veel voorkomende huidziekte acne vulgaris. Door de meesten wordt P acnes nog steeds beschouwd als een meestal goedaardig en commensaal micro-organisme, maar de berichten over zijn kwaadaardige opportunistische kant nemen toe. Aangepast en met vriendelijke toestemming van Bryan Christie Design (http://bryanchristiedesign.com/).
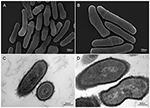
Figuur 2. Scanning- en transmissie-elektronenmicroscopische (SEM en TEM) beelden van P. acnes stam KPA (A, B = SEM; C, D = TEM). Recente vooruitgang in isolatie- en kweektechnieken onthullen dat P. acnes infecties schromelijk onderschat zijn en werpen een nieuw licht op deze opportunistische bacteriële soort. Microscopie door Volker Brinkmann, Max Planck Instituut voor Infectie Biologie, Berlijn, Duitsland. Schaalbalk = 200/300nm.
Sarcoïdose
Sarcoïdose is een ziekte van onbekende etiologie die leidt tot ontstekingen in uiteenlopende organen als longen, lever, huid en lymfevaten. Een vermeend verband tussen sarcoïdose en P. acnes werd voor het eerst voorgesteld toen de bacterie werd geïsoleerd uit sarcoïde laesies van de huid en lymfeklieren (Eishi et al., 2002; Yamada et al., 2002). Deze bevindingen zijn in belangrijke mate bevestigd (de Brouwer et al., 2015), en verder uitgebreid door verschillende in vitro experimenten die de invasiecapaciteit van P. acnes in HEK293T (menselijke embryonale nier) en A549 (humaan alveolair epitheliaal carcinoom) cellijnen aantoonden (Tanabe et al., 2006). Het meest recente werk in sarcoïde broncho-alveolaire lavage (BAL) vloeistof en cellen toonde significante upregulatie van een P. acnes-specifieke immuunrespons (Schupp et al., 2015). Daarnaast hebben experimenten in muizen aangetoond dat levensvatbare P. acnes longgranulomen kan induceren die vergelijkbaar zijn met de granulomen die worden waargenomen bij sarcoïdosepatiënten (Werner et al., 2017). Een algemeen overzicht waarin het verband tussen sarcoïdose en P. acnes wordt gedetailleerd, wordt verder gegeven door Eishi (2013).
Studies die probeerden de signaalwegen te karakteriseren die door P. acnes tijdens infectie worden geactiveerd, toonden aan dat nucleaire factor-kappaB , een transcriptiefactor die de expressie reguleert van genen die betrokken zijn bij immuun- en ontstekingscascades, door P. acnes wordt geactiveerd (Kim et al., 2002). Meer in het algemeen werd aangetoond dat toll-like receptor 2 (TLR2) een cruciale receptor is voor de NF-κB-afhankelijke respons op P. acnes, wat het vermogen van deze bacterie onthult om de selectieve activering van aangeboren immuniteitsgenen uit te lokken (Inohara en Nuñez, 2001; Chamaillard et al., 2003; Moreira en Zamboni, 2012). Verder werd de rol van gastheergenetica onderzocht in sarcoïdose gevallen die geassocieerd werden met P. acnes infectie. Enkelvoudige nucleotide polymorfismen (SNPs) in het nucleotide-bindende oligomerisatie domein (NOD) van de eiwitten NOD1 en NOD2 werden gecorreleerd met P. acnes infectie onder 73 sarcoïdose patiënten met 52 interstitiële pneumonie en 215 gezonde controles (Tanabe et al., 2006). NOD1 en NOD2 zijn intracellulaire patroonherkenningsreceptoren die bacteriële moleculen zoals peptidoglycaanmoleculen kunnen waarnemen. In dezelfde lijn hebben in vitro experimenten aangetoond dat internalisatie van P. acnes in HEK293T cellen kan resulteren in activatie van NOD1 en NOD2, wat een ziektemechanisme suggereert dat gebaseerd is op chronische ontsteking of lokale immuunsuppressie (Tanabe et al., 2006). Deze bevindingen suggereren ook dat invasieve P. acnes kunnen fungeren als bacteriële liganden om afwijkende NOD receptor activatie te veroorzaken bij bepaalde individuen met langdurige gevoeligheid voor sarcoïdose. Toekomstige experimenten moeten echter de precieze mechanistische chronologie verduidelijken van of en hoe P. acnes-gemedieerde afwijkende NF-κB activatie granuloomvorming kan induceren op een NOD1/NOD2-afhankelijke manier.
Hoewel invasieve P. acnes een mogelijke etiologie van sarcoïdose en misschien andere ziekten zou kunnen zijn, is het ophelderen van het oorzakelijk verband en de correlatie tussen P. acnes-infectie en pathologie is onduidelijk omdat heterogeniteit van bacteriestammen, genetica van de gastheer en de omgeving van de gastheer moeten worden overwogen wanneer een studie een verband legt tussen een microbioom en een ziektetoestand.
Benigne prostaathyperplasie (BPH) en prostaatkanker
Chronische of terugkerende ontstekingsprocessen worden al lang genoemd bij de progressie van BPH en prostaatkanker (De Marzo et al., 1999; Nelson et al., 2004; Sfanos et al., 2014). Ontsteking wordt toegeschreven aan de aanwezigheid van specifieke biomarkers zoals verhoogd interleukine (IL)-6, tumornecrosefactor alfa (TNFα) en het acute-fase-eiwit, C-reactief eiwit (Mechergui et al., 2009; Menschikowski et al., 2013; Yu et al., 2015). Recent werk op urologische vloeistoffen (d.w.z. urine, zaadvocht, prostaatafscheidingen) evenals prostaatbiopten suggereert een significante voorwaardelijke verschuiving naar bepaalde microbiële soorten die als diagnostische index kunnen worden gebruikt (Yu et al., 2015; Ni et al, 2016).
Een goede hoeveelheid werk suggereert dat de specifieke associatie van P. acnes met de prostaat en de invasie van prostaatepitheelcellen in het bijzonder (figuur 3) kan bijdragen aan de pathologie van BPH of prostaatkanker met een ontstekingscomponent (Sfanos et al., 2013; Davidsson et al., 2016). Het is momenteel echter onduidelijk of P. acnes een echt infectieus agens van de prostaat vertegenwoordigt, een commensaal of een toevallig prostaatmicrobion. Het is aannemelijk dat prostaat-gelokaliseerde P. acnes afkomstig zijn van de huid die per ongeluk worden ingebracht, bijvoorbeeld tijdens een prostaatbiopsie-een gezichtspunt dat bezorgdheid zou moeten wekken bij bepaalde diagnostische workup scenario’s.
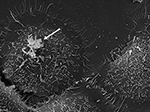
Figuur 3. SEM van P. acnes stam P6 (pijl) in vitro op gekweekte prostaatepitheelcellen RWPE1. Het prostaatepitheelcel-invasieve gedrag van P. acnes is goed gedocumenteerd in zowel in vivo als cel-gebaseerde studies waarbij een vimentine-gemedieerd invasieproces waarschijnlijk lijkt (Mak et al., 2012). Microscopie door Volker Brinkmann, Max Planck Instituut voor Infectie Biologie, Berlijn, Duitsland.
Wat ook de route van binnendringing of het pathogeen potentieel is, een aanzienlijk aantal prostaatweefsels verkregen via transurethrale resectie voor BPH, of radicale prostatectomie voor kanker, werden eerder positief getest op P. acnes aggregaten die zich blijkbaar binnen rondzwervende macrofagen ophielden (Alexeyev et al., 2007; Bae et al., 2014). Aanvullende rapporten op basis van menselijke monsters hebben verder bewijs geleverd voor een verband tussen BPH of prostaatkanker en P. acnes met behulp van verschillende technische benaderingen, waaronder kweek, confocale microscopie voor visualisatie van de bacterie en in situ hybridisatie, immunohistochemie (figuur 4) en PCR-gebaseerde profilering van bacterieel 16S rRNA (Hochreiter et al., 2000; Cohen et al., 2005; Sfanos et al., 2008; Fassi-Fehri et al., 2011; Bae et al., 2014; Davidsson et al., 2016). Verder bewijs komt uit dierstudies die aangeven dat inoculatie van P. acnes in de muizen- of rattenprostaat en -blaas leidt tot een openlijke, langdurige ontstekingsreactie en een breed scala aan cellulaire verstoringen binnen de prostaatklier (Olsson et al., 2012; Shinohara et al., 2013).
Figuur 4. Immunohistochemie van menselijke prostaatweefselmonsters gekleurd met P. acnes-antilichaam (rood). Aangepast met toestemming van Fassi-Fehri et al., 2011 (Supplementary Figure 2B). Aanwezigheid van P. acnes in menselijke prostaat weefselmonsters met goedaardige prostaathyperplasie (A,B); of adenocarcinoom (C,D). Uitgebreide bacteriële belasting werd gedetecteerd in beide gevallen.
Pogingen om ziekte-geassocieerde P. acnes-stammen van kanker prostaatklieren fylogenetisch te analyseren, hebben aangetoond dat de meeste prostaatisolaten behoren tot fylogenetische clades die zeldzaam zijn op de menselijke huid, wat aangeeft dat een huid-afgeleide besmetting tijdens de bemonstering onwaarschijnlijk is (Mak et al., 2013; Davidsson et al., 2016). Langs dezelfde lijnen blijken vergelijkbare ontstekingsroutes als die beschreven zijn voor sarcoïdose, waaronder NF-κB, IL-6, STAT3 en COX2, geactiveerd te worden door P. acnes zowel onder in situ als in vitro omstandigheden (Drott et al., 2010; Fassi-Fehri et al., 2011; Mak et al., 2013; Tsai et al., 2013; Bae et al., 2014). Hoewel de precieze etiologie voor deze ontstekingsveranderingen nog niet duidelijk is, zijn verschillende membraangebonden patroonherkenningsreceptorpaden breed verspreid in het urine- en genitale systeem van zoogdieren die gretig bacteriële en virale componenten herkennen (Jorgensen en Seed, 2012; Gambara et al., 2013). Deze gastheercelreceptoren, bijvoorbeeld TLR’s, bevorderen de cytokineproductie die een kernkenmerk is van aangeboren immuniteit tegen microbiële pathogenen. Samen suggereren deze bevindingen dat binnendringende P. acnes door hun vermogen om verschillende aspecten van immuniteit te triggeren, kunnen fungeren als primaire aanjager en/of versterker van de ernst van de ziekte.
Spondylodiscitis en rugpijn
Eén van de verschillende post-operatieve complicaties waarbij P. acnes betrokken is, is ontsteking van de tussenwervelschijf en de omliggende intervertebrale ruimte (diskitis) na discectomie (Harris et al., 2005). Concomitante degeneratieve infectie van aangrenzende wervels (spondylodiscitis) kan een veel voorkomend kenmerk zijn en de hoofdoorzaak voor ernstige neurologische schade en pijn indien behandeling wordt uitgesteld (Uçkay et al., 2010). Naast onbedoelde chirurgische introductie direct in de wervelkolom, kunnen ziekteverwekkers ook binnenkomen via de arteriële en veneuze spinale bloedtoevoer (hematogene verspreiding). Hoewel Staphylococcus aureus, Escherichia coli en Proteus het vaakst worden geïsoleerd, is P. acnes de meest voorkomende anaerobe ziekteverwekker in deze context en wordt deze waarschijnlijk ondergerapporteerd vanwege de problemen met de kweek. Er is enig klinisch bewijs dat patiënten met hernia (nucleus pulposus) schijfmateriaal dat is geïnfecteerd met anaerobe pathogenen in het algemeen, en P. acnes in het bijzonder, een grotere kans hebben op het ontwikkelen van ontsteking en oedeem van de aangrenzende wervels (Modic veranderingen type I) en rugpijn (Albert et al., 2013; Urquhart et al., 2015). Klinische en diergebaseerde follow-ups bevestigen nu de eerste bevindingen die aantonen dat lokale P. acnes proliferatie upregulatie van ontstekingsmarkers en schijfdegeneratie veroorzaakt, consistent met Modic veranderingen (Aghazadeh et al., 2016; Dudli et al., 2016). Er is nu zelfs eerste klinisch bewijs dat suggereert dat bacteriële infectie van de tussenwervelschijf met P. acnes en/of Staphylococcus epidermidis eigenlijk aan alle andere problemen vooraf kan gaan als de hoofdoorzaak van schijfherniatie en bijbehorende pathologische veranderingen (Rajasekaran et al., 2017).
De ziekte van Parkinson (PD)
De degenererende hersenen worden gekenmerkt door schade aan het neurale systeem die kan worden toegeschreven aan atypische aggregatie en afzetting van gemuteerde of verkeerd gevouwen eiwitten (bijv. Lewy-lichaampjes en Lewy-neurieten), zoals duidelijk gedocumenteerd in idiopathische PD (Taylor et al., 2002). Wat over het algemeen niet op prijs wordt gesteld, is dat de hersenen ook vatbaar zijn voor binnendringende ziekteverwekkers, variërend van virussen en bacteriën tot schimmels. Deze pathogenen, of meer specifiek hun endogene componenten en/of metabolieten, kunnen centrale neurologische stoornissen veroorzaken, variërend van subtiele tekenen van dementie en dystonie, die het gevolg zijn van chronische, terugkerende infectie (De Chiara et al., 2012; Bibi et al., 2014), tot ernstigere motorneuronziekte zoals bijvoorbeeld waargenomen met het humane endogene retrovirus K (Li et al., 2015). Het is dus duidelijk dat de mens een enorm zware systemische last van microben heeft (Potgieter et al., 2015; Spadoni et al., 2015) die incidenteel kunnen bijdragen aan de pathologie van progressieve neurodegeneratieve ziekten met een atypische eiwitcomponent. Zeker, deze werkhypothese krijgt aanzienlijke steun aangezien cognitief, emotioneel of pathologisch gedrag indirect lijken te worden beïnvloed door de ruimtelijke en persoonlijke verdeling van microben die via de darm-hersenas werken (figuur 5) (Collins et al., 2012; Dinan et al., 2013; Mayer et al., 2014; Burokas et al., 2015). Een recente case-control studie toonde inderdaad aan dat microbiële variatie in het maagdarmkanaal, zowel tussen als binnen individuen; het meest significant correspondeert met fenotypische variaties in PD (Scheperjans et al., 2015; Vizcarra et al., 2015). Hoewel de onderliggende mechanismen die microbiotasamenstelling koppelen aan verschillen in PD niet duidelijk zijn, zou bovenstaande bevinding op zijn minst een verklaring kunnen zijn voor de hoge prevalentie van gastro-intestinale afwijkingen die bij PD-patiënten worden gezien (Dobbs et al., 2016). Verder verband leggend tussen de microbiota en de ernst van PD, toonden sigmoïd mucosale biopten en fecaal materiaal verzameld bij PD patiënten de aanwezigheid van opportunistische en pro-inflammatoire bacteriesoorten die vaak chronische constipatie, prikkelbaar darmsyndroom en ulceratieve colitis veroorzaken (Keshavarzian et al., 2015). Collectief suggereren deze eerste resultaten dat relaties tussen verschillende microbiële gemeenschappen in de darm een veel voorkomende comorbiditeit zijn bij PD, en dat unieke individuele signaturen van het darmecosysteem de klassieke motorische stoornissen van PD kunnen versterken.
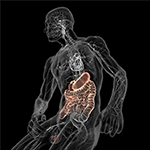
Figuur 5. Schematische weergave van de darm-hersenas (gekleurd) met aan de ene kant het met microben gevulde spijsverteringsstelsel en aan de andere kant de hersenen met hun homeostasecentra (hypothalamus en hypofyse). Beide zijn verbonden via het cardiovasculaire en autonome zenuwstelsel met inbegrip van de nervus vagus (nervus cranialis X) die microbiële overgang naar het centrale zenuwstelsel (CZS) zou kunnen vergemakkelijken. Met toestemming van Bryan Christie Design (http://bryanchristiedesign.com/).
Tegen deze achtergrond moet de vraag worden gesteld of er enig bewijs is dat P. acnes een rol speelt in de pathofysiologie van PD. Voor deze mogelijkheid moet aan twee voorwaarden zijn voldaan: (1) P. acnes infectie moet voorafgaan aan het optreden van klassieke symptomen van de ziekte zoals schudden, motorische initiatie en traagheid van beweging; en (2) P. acnes inoculatie moet voldoende symptomen van PD induceren en/of leiden tot het verlies van dopamine projectie neuronen in de midbrain nucleus bekend als substantia nigra pars compacta. Tot nu toe heeft ons laboratorium clusters van P. acnes ontdekt gelokaliseerd op neuronen van de middenhersenen en nabijgelegen corticale structuren van autopsie PD hersenen (figuur 6). Deze onverwachte bevinding voegt verder bewijs toe dat P. acnes indirect bijdraagt aan lokale vlagen van ontsteking, vergelijkbaar met die gezien in sarcoïdose en BPH. Een open vraag is in hoeverre P. acnes indirect bepaalde pathologische kenmerken van PD kan versterken. Aangezien PD een zeer heterogene aandoening is, is het onwaarschijnlijk dat één ziektemechanisme van toepassing is op alle PD fenotypen. Toch is het intrigerend om te speculeren dat residente huidmicroben de progressie van PD zouden kunnen initiëren of versterken via ontstekings- en/of genetische predispositiefactoren.

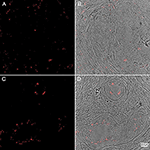
Figuur 6. Immunohistochemie van menselijke PD middenhersenen weefselmonsters gekleurd voor P. acnes (groen; A+B), neuronale microtubuli (MAP2; rood; A) en kernen (DAPI; blauw; A+B). Ouderdomsgebonden lipofuscine auto-fluorescentie werd gedoofd met Sudan Black B. Aanwezigheid van P. acnes (pijl) in de periplasmatische ruimte van een menselijk neuron (A) tussen kern (n) en cytoskelet; of neutrofiel (B) met zijn karakteristieke meerlobbige kern binnen een midbrain capillair (Cap). Deze bevindingen zijn typisch voor PD en afwezig in de meeste controlegedeelten. Retrograde bewegingen langs craniale zenuwen, trauma-geïnduceerde microbloedingen evenals het nieuw ontdekte glymfatische systeem vertegenwoordigen potentiële microbiële routes naar het CZS.
Als P. acnes toegang kan krijgen tot dopaminecellen in de middenhersenen, wat is dan de meest waarschijnlijke route van inoculatie en infectie? Hoewel de huid fysiek gescheiden is van de hersenen, blijft kruisbesmetting een risicofactor. Bijvoorbeeld, de neusholte kan een potentiële haven zijn voor pathogene P. acnes stammen die vervolgens naar de hersenparenchym kunnen transloceren om lokale macrofagen, microglia genaamd, te hyper-activeren; een fenomeen dat een consistent kenmerk is van PD pathologie (besproken door Chao et al., 2014). Onderzoek naar nosocomiale infecties toont aan dat bacteriesoorten zo divers als Pneumococcus sp. (Zwijnenburg et al., 2001) en Salmonella sp. (Bollen et al., 2008) gemakkelijk langs de reukzenuw (hersenzenuw 1; CN 1) en uiteindelijk in de bulbus olfactorius zwerven. Een andere mogelijke toegangsweg voor schadelijke microben of gevaarlijke verkeerd gevouwen eiwitten is de nervus vagus (nervus cranialis 10; CN 10). Onder bepaalde omstandigheden blijken verkeerd gevouwen aggregaten in de vorm van Lewy lichaampjes en Lewy neurieten inderdaad van de nervus vagus naar de hersenen te migreren, wat verder bewijs levert voor pathogene bacteriën die in combinatie met toxische eiwitten mogelijk bijdragen aan selectieve neuronale kwetsbaarheid (Holmqvist et al., 2014). Interessant is dat de hersenkernen van CN 1 en CN 10 tot de eerste plaatsen behoren waar bij voorkeur Lewy lichaampjes en Lewy neurieten worden afgezet in de loop van de progressie van PD (Braak et al., 2004). Deze specifieke observatie wijst niet alleen op een waarschijnlijke route waarlangs bacteriën de hersenen binnendringen, maar biedt ook een mogelijk mechanisme voor de observatie dat truncal vagotomie het risico op PD aanzienlijk vermindert (Svensson et al., 2015). Het verband tussen hoofdtrauma en PD (Harris et al., 2013; Jafari et al., 2013; Pearce et al., 2015), samen met de notie van een divers bloedmicrobioom (Potgieter et al., 2015), impliceert een enorm potentieel voor pathogeen opportunisme wanneer traumatische breuken in de bloed-hersenbarrière optreden. Met de recente ontdekking van een lymfatisch (glymfatisch) systeem in de hersenen (Iliff et al., 2012; Hitscherich et al., 2016) moet een andere potentiële route van herseninfectie worden overwogen.
Alles bij elkaar is er preklinisch en enig klinisch bewijs om P. acnes indirect te impliceren als een onafhankelijke variabele die de incidentie of ernst van PD beïnvloedt. Dit bewijs wordt aangevuld door rapporten die een ernstige huidaandoening, acne inversa, in verband brengen met de ziekte van Alzheimer (Wang et al., 2010). Vanuit een therapeutisch perspectief is de mogelijkheid dat P. acnes kernkenmerken van de ziekte van Alzheimer veroorzaakt of versterkt, een belangrijke bron voor antibiotische benaderingen van neurodegeneratieve ziekten. En vanuit een onderzoeksperspectief zou het de moeite waard zijn om patiënten met huidaandoeningen nauwkeuriger te onderzoeken op aanwijzingen voor neuropathologie met een vroeger begin en een ernstiger ziektefenotype.
Toekomstverwachting
Het overzicht dat in dit artikel wordt gepresenteerd, schetst een onverwachte donkere kant van P. acnes met betrekking tot pathologie. Intracellulaire persistentie van P. acnes is betrokken bij ziekten van de longen en de prostaatklier en mogelijk de hersenen. Dit is een duidelijke getuigenis voor de pathogeniciteit van van de huid afkomstige bacteriën bij bepaalde ziektefenotypes. Verder onderzoek zal zich moeten richten op verschillende opdoemende vragen in de biologie van P. acnes: (1) wat zijn de cruciale P. acnes interacties in ziektegevoeligheid? (2) Welke mechanismen worden door P. acnes gebruikt om ziekteprogressie te beïnvloeden? (3) Als bepaalde populaties van P. acnes de vatbaarheid voor de ernst van de ziekte kunnen verhogen, zijn er dan andere configuraties van P. acnes die beschermend zijn? (4) Bewijs van concept dat P. acnes infectie direct geassocieerd is met ziekte pathologie, of meer specifiek, toont de studie van concept causaliteit of slechts correlatie aan? En tenslotte (5) Kan P. acnes-gedreven ziekte pathologie behandeld worden met conventionele antibiotica therapie en diagnostische toepassingen?
Author Contributions
JL, KER, JC, KR, CH, AM, HB, en GT stelden het manuscript op. JL en MS hebben de figuren voorbereid.
Funding
Intramurale financiering aan JL werd verstrekt door NYIT College of Osteopathic Medicine.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.