Acetylering verwijst naar een reactie die een acetyl-functiegroep introduceert in een chemische verbinding, waarbij het waterstofatoom van een hydroxylgroep wordt vervangen door een acetylgroep (CH3 CO) om een specifieke ester, het acetaat, op te leveren. Eiwitacetylatie kent gewoonlijk twee verschillende vormen. Bij de mens worden bijna (80%-90%) eiwitten co-translationeel geacetyleerd aan hun Nα-termini van de nascente polypeptideketens. Een ander type wordt meestal geacetyleerd op lysineresten.
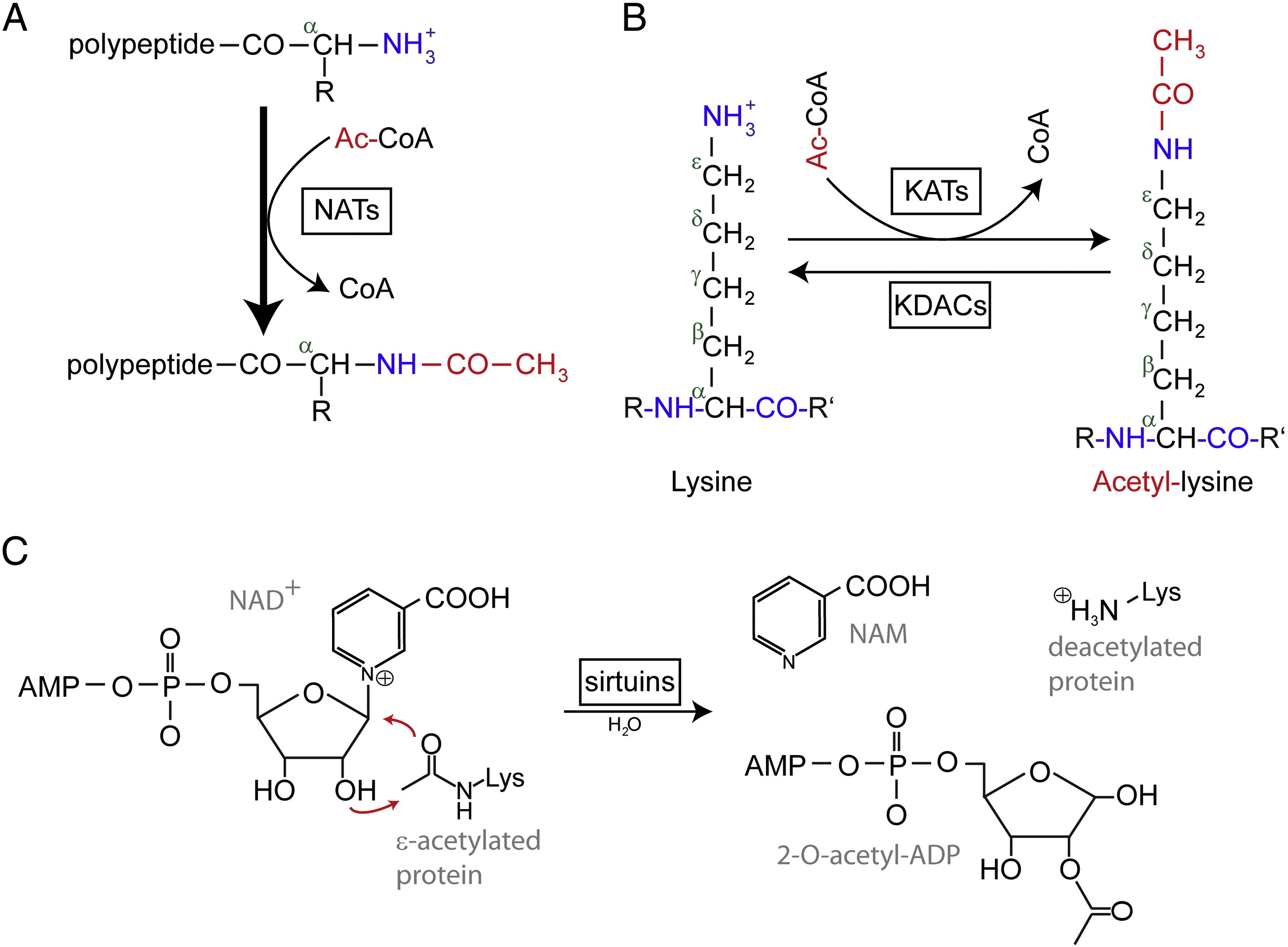
N-terminale (Nt) acetylering wordt gekatalyseerd door Nt-acetyltransferases (NAT’s) en is tot dusverre onomkeerbaar gebleken. NATs, mono- of multisubunit-enzymen bestaande uit een katalytische subeenheid en tot twee hulpsubunits, kunnen een acetylgroep van acetyl-co-enzym A (Ac-CoA) overbrengen naar de α-aminogroep van het eerste aminozuurresidu van het eiwit. Bij NAT’s moduleert de belangrijkste hulpsubeenheid de activiteit en de substraatspecificiteit van de katalytische subeenheid. Verschillende NATs zijn verantwoordelijk voor de acetylering van Nt. Bij de mens zijn er tot dusver zes NATs gevonden, waaronder NatA, NatB, NatC, NatD, NatE, en NatF. Naast het verschil in samenstelling van de subeenheden, verschillen de verschillende NATs in hun substraatspecificiteiten.
Nt-acetylering speelt verschillende rollen in moleculaire effecten. Ten eerste bepaalt Nt-acetylering de subcellulaire lokalisatie voor bepaalde eiwitten. Bijvoorbeeld, Arl3 en Grh1, twee Golgi-geassocieerde eiwitten, kunnen niet associëren met het Golgi-apparaat wanneer de Nt-acetylgroep ontbreekt. Ten tweede wordt gerapporteerd dat Nt-acetylering eiwitten in het cytosol houdt en een post-translationele translocatie migratie naar het endoplasmatisch reticulum (ER) en de secretorische route remt. Bovendien kan Nt acetylatie de eigenschappen van de N-terminus veranderen waardoor eiwit-eiwit interacties gemoduleerd worden. Voor verschillende eiwitten werd aangetoond dat de affiniteit met hun bindingspartners toeneemt nadat ze Nt-geacetyleerd zijn. Zo ondergaat het E2 ubiquitine-conjugerende enzym Ubc12 Nt-acetylering door NatC waardoor de affiniteit met zijn interactiepartner, het E3 ubiquitine ligase Dcn1, toeneemt. Bovendien controleert Nt-acetylatie de eiwitkwaliteit en -levensduur, en regelt het de eiwitstichiometrie via de N-end rule pathway.
N-terminale acetylatie heeft vele functies in de fysiologie. NATs zijn essentieel voor normale ontwikkeling, bot- en bloedvatontwikkeling. N-terminale acetylering kan de bloeddruk, proteasoom lokalisatie, hormoon, alsmede organel structuur en functie reguleren. Bij menselijke ziekten houdt het verband met neurodegeneratieve ziekten (zoals de ziekte van Alzheimer, de ziekte van Parkinson, en Lewy body dementie) en kanker (zoals longkanker, borstkanker, colorectale kanker).
Lysine acetylering
Geacetyleerde lysineresiduen werden voor het eerst ontdekt in histonen die de gentranscriptie regelen. Maar lysine acetylering is niet beperkt tot histonen. In tegenstelling tot Nt acetylering, is lysine acetylering omkeerbaar. De acetylering wordt gekatalyseerd door lysine acetyltransferasen (KAT’s) en de deacetylering van lysineresiduen wordt gekatalyseerd door lysine deacetylasen (KDAC’s).
Er is gemeld dat 17-22 genen KAT’s zijn geïdentificeerd in het menselijk genoom (Het exacte aantal KAT’s is omstreden), die kunnen worden ingedeeld in drie verschillende families, waaronder GCN5 (general control non-derepressible 5)-gerelateerde acetyltransferase (GNAT) familie, de MYST familie, en p300/CBP (CREB-bindend eiwit) familie. Tot de bekende substraten van KAT-complexen behoren niet alleen histon-eiwitten, maar ook een aantal verschillende transcriptiefactoren, transcriptionele co-regulatoren, en een aantal eiwitten van specifieke cellulaire signaalwegen zoals p53, β-catenine, NF-κB, MyoD of Rb. En zelfs sommige RNA-moleculen kunnen geacetyleerd worden. Er zijn vier verschillende soorten KDAC’s, namelijk klasse I, II, III en IV. Klasse I, II en IV zijn Zn2 +-afhankelijke amidohydrolases, terwijl klasse III (ook sirtuïnes genoemd) NAD+ gebruikt als co-substraat voor zijn katalytische activiteit zijn Zn2 +-afhankelijke amidohydrolases.
De histonen zijn de eerste ontdekte geacetyleerde eiwitten. De histonmoleculen worden gemodificeerd door verschillende PTM’s, waaronder fosforylering, methylering en acetylering. histonacetylering, bepaalt de histonassemblage evenals de vouwing en compactheid van de DNA-histoninteractie en stelt daarom een schakelaar voor tussen permissieve en repressieve chromatinestructuur. Naast histonen kunnen KAT’s ook cytoskelet-eiwitten katalyseren. Er zijn enkele nieuwe geïdentificeerde acetylatieplaatsen in andere eiwitten, waaronder HMG eiwitten, c-Myc, oestrogeen- en androgeenreceptoren, E2F/Rb enzovoort.
De fysiologische rollen van lysine acetylering zijn gerapporteerd. De histon-eiwitten zijn geassocieerd met een strakke regulatie van in wezen alle soorten DNA-getemperde processen zoals transcriptie, replicatie, recombinatie, reparatie, evenals vertaling en vorming van gespecialiseerde chromatine structuren. Daarom beïnvloedt lysineacetylering van eiwitten een reeks van cellulaire signaalwegen, evenals metabolisme, stressreacties, apoptose en membraantransport.
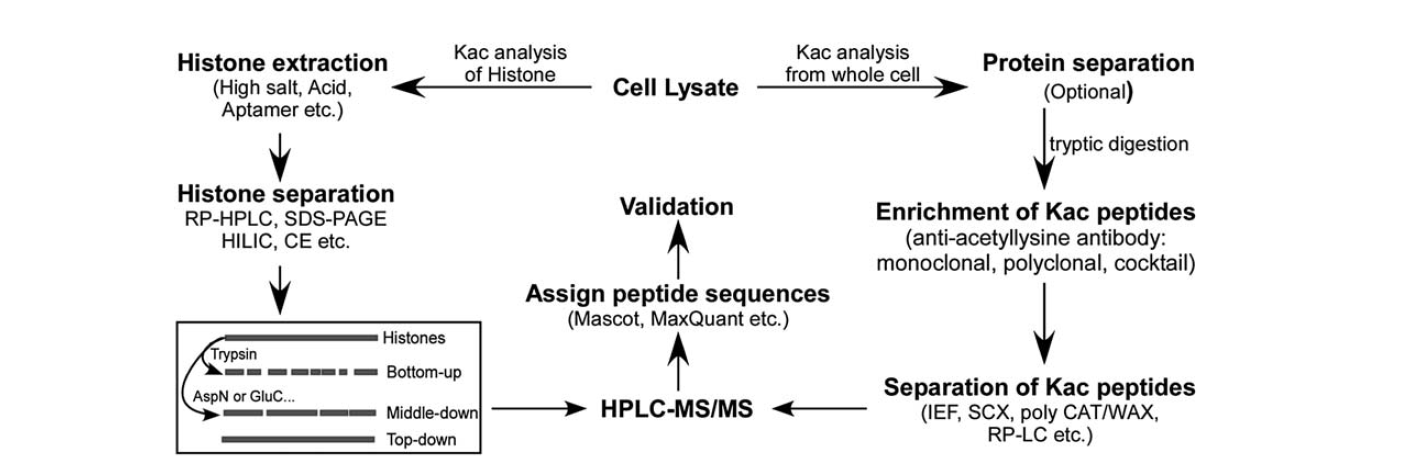
Er zijn relatief minder hulpmiddelen beschikbaar voor het identificeren van lysineacetylering. Met de ontwikkeling van massaspectrometrie is dit een belangrijk hulpmiddel geworden voor de identificatie en kwantificering van lysineacetylering. Voor de analyse van histon lysine acetylering zijn er verschillende stappen, waaronder cellysaat, histon extractie, histon scheiding, massaspectrometrie, en data-analyse. De stappen voor de analyse van lysineacetylering van eiwitten uit de hele cel omvatten cellysaat, eiwitscheiding, verrijking van lysineacetyleringspeptiden, scheiding van lysineacetyleringspeptiden, massaspectrometrie, en gegevensanalyse.