
Wanneer chloorgas door een cilinder tomatensap wordt geblazen, wordt het chloor/tomatensapmengsel binnen vijf minuten bijna helemaal wit. Deze spectaculaire verandering is het gevolg van de chemische inwerking van chloor, als oxiderend bleekmiddel, op de pigmenten in tomatensap. Wanneer oude krantenknipsels, die door veroudering en blootstelling aan licht zijn verkleurd, worden behandeld met een 1% waterige natriumborohydride-oplossing, wordt het papier binnen twintig minuten dramatisch witter. In dit geval, is het papier hersteld aan zijn originele witte kleur door de actie van natriumborohydride die als verminderende blekenagent dienst doet.
Een bleekmiddel is een stof die andere stoffen witter kan maken of kan ontkleuren. Gekleurde stoffen bevatten over het algemeen groepen atomen, chromoforen genaamd, die zichtbaar licht met specifieke, karakteristieke golflengten kunnen absorberen en het deel van het licht dat niet wordt geabsorbeerd, kunnen reflecteren of uitzenden. Als een chromofoor bijvoorbeeld blauw licht absorbeert, zal hij licht van de complementaire kleur weerkaatsen en zal de stof die chromoforen bevat geel lijken. Bleekmiddelen vernietigen in wezen chromoforen (waardoor de kleur wordt verwijderd), via de oxidatie of reductie van deze absorberende groepen. Bleekmiddelen kunnen dus worden ingedeeld in oxiderende of reducerende middelen.
Enkele van de toepassingen van bleekmiddelen zijn:
- Het bleken van textiel en weefsels
- Het bleken van houtpulp
- Het verwijderen van vlekken
- Commercieel en huishoudelijk witwassen en reinigen
- Als bestanddeel van schuurmiddelen en vaatwasmiddelen
- Het bleken van haar
Oxiderende bleekmiddelen
Een groot aantal oxiderende bleekmiddelen werd door Jules A. Szilard in Bleaching Agents and Techniques (1973). De oxiderende bleekmiddelen (en bleekmiddelen) die tegenwoordig algemeen worden gebruikt zijn: chloor, chloordioxide, alkalische hypochlorieten, waterstofperoxide, peroxygeenverbindingen, en zonlicht en kunstlicht.
Chloor (Cl 2 ). De ontdekking van chloor door de Zweedse scheikundige Carl Wilhelm Scheele in 1774 markeerde het begin van het moderne tijdperk van het bleken. Volgens Sidney M. Edelstein in een artikel uit 1948 getiteld “The Role of Chemistry in the Development of Dyeing and Bleaching,” was de Franse scheikundige Claude-Louis Berthollet de eerste die chloor gebruikte om katoen en linnen stoffen te bleken.
Chloor is gebruikt voor het bleken van houtpulp. Veel pulpfabrieken die gebruik maken van het Kraft pulp proces bereiden ter plekke natriumhydroxide (nodig om houtsnippers te verteren) via de elektrolyse van pekel , een geconcentreerde waterige oplossing van natriumchloride.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Chloor is een nevenproduct. Het daaropvolgende bleken met chloor van de bruine pulp geeft een product dat kan worden gebruikt voor de vervaardiging van schrijf- en drukpapier. Helaas worden organische verbindingen in de pulp zowel geoxideerd als gechloreerd, waardoor kleine hoeveelheden organochloorverbindingen ontstaan, waaronder
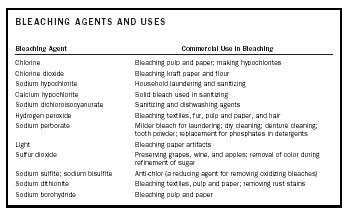
| BLEEKMIDDELEN EN GEBRUIK | |
| Bleekmiddel | Commercieel gebruik bij het bleken |
| Chloor | Bleken van pulp en papier; maken van hypochlorieten |
| chloordioxide | bleken van kraftpapier en meel |
| natriumhypochloriet | witwassen en ontsmetten van huishoudens |
| calcium hypochloriet | Vast bleekmiddel voor ontsmetting |
| Natriumdichloorisocyanuraat | Reinigings- en afwasmiddelen |
| Waterstofperoxide | Bleken van textiel, bont, pulp en papier, en haar |
| Natriumperboraat | Milder bleekmiddel voor het witwassen; chemisch reinigen; reinigen van gebitten; tandpoeder; vervanging van fosfaten in wasmiddelen |
| Licht | Bleken van papieren artefacten |
| Zwaveldioxide | Conservering van druiven, wijn en appels; verwijdering van kleur tijdens raffinage van suiker |
| Natriumsulfiet; natriumbisulfiet | Anti-chlor (een reductiemiddel voor het verwijderen van oxiderende bleekmiddelen) |
| Natriumdithioniet | Bleken van textiel, pulp en papier; het verwijderen van roestvlekken |
| Natriumborohydride | het bleken van pulp en papier |
dioxines. In feite is de meest voorkomende dioxine die door het pulp- en bleekproces wordt geproduceerd, 2,3,7,8-tetrachloordibenzo- p -dioxine (2,3,7,8-TCDD), zowel een carcinogeen als een dodelijk toxine gebleken. Daarom wordt chloor als bleekmiddel vervangen door de veiliger bleekmiddelen chloordioxide en waterstofperoxide. In de pulp- en papierindustrie is er zelfs een trend naar volledig chloorvrij bleken (TCF). Chloor wordt nu in de bleekindustrie voornamelijk gebruikt voor de bereiding van hypochlorietoplossingen en droge bleekmiddelen zoals calciumhypochloriet.
Chloordioxide (ClO 2 ). Chloordioxide is als bleekmiddel zowel in gasfase als in waterige oplossing gebruikt. Vanwege zijn explosieve aard wordt chloordioxide in de gasfase vaak verdund met stikstof of kooldioxide. Bij opslag of vervoer wordt chloordioxide door koud water geleid en onder koeling bewaard.
Chloordioxide wordt industrieel bereid via de reductie van natriumchloraat door zwaveldioxide in een waterige oplossing.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
Een betrekkelijk veilige methode voor de bereiding van ClO 2 is de reactie tussen natriumchloriet (NaClO 2 ) en formaldehyde (H 2 CO).
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
Naarmate reactie 3 vordert, daalt de pH van de oplossing (door de productie van mierenzuur ). De verhoogde zuurgraad van de oplossing bevordert de vorming van ClO 2 , weergegeven in vergelijking 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
In een zure oplossing gedraagt chloordioxide zich als een oxidatiemiddel. De volledige reductie van ClO 2 is weergegeven in vergelijking 5.
ClO 2 + 4H + + 5 e – → Cl – + 2H 2 O (5)
De afzonderlijke stappen van deze totale reductiereactie leveren HClO 2 , HOCl, en Cl 2 op, die zich alle als oxidatiemiddelen gedragen. Een zuur medium is vereist, omdat ClO 2 disproportioneert in een alkalische oplossing, zoals weergegeven in vergelijking 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Chloordioxide wordt voornamelijk gebruikt voor het bleken van pulp.
Hypochlorieten (OCl – ). Hypochlorietbleekoplossingen worden gemaakt van NaOCl en, in mindere mate, Ca(OCl) 2 . Hypochlorieten worden gebruikt bij het wassen, als desinfecteermiddel, bij het bleken van pulp en textiel, en bij het verwijderen van inkt uit gerecycleerd papier. Commerciële bleekoplossingen worden verkregen door chloorgas door koud, verdund, waterig natriumhydroxide te laten lopen, zoals weergegeven in vergelijking 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Als alternatief kan het hypochloriet-ion worden gegenereerd door hydrolyse van organische stikstof-chlorietverbindingen. Enkele van de belangrijkste stikstof-chloorverbindingen die op deze wijze worden gebruikt, zijn de gechloreerde isocyanuraten. Deze worden gebruikt in reinigings- en vaatwasmiddelen.
Om een doeltreffend bleekmiddel te zijn, moet de hypochlorietoplossing alkalisch worden gehouden (pH > 9,0), om de hydrolyse van OCl – (zie vergelijking 8) te onderdrukken en de vorming van onstabiel HOCl te voorkomen.
OCl – + H 2 O → HOCl + OH – (8)
In zure oplossingen wordt HOCl gevormd en ontleed.
3HOCl → HClO 3 + 2HCl (9)
HOCl zal ook reageren met HCl, een van de ontledingsproducten.
HOCl + HCl → H 2 O + Cl 2 (10)
Hypochlorietbleekoplossingen mogen geen kationen van zware metalen bevatten, omdat deze kationen (net als licht of warmte) de ontleding van HOCl bevorderen, zoals uit vergelijking 11 blijkt.
2HOCl → 2HCl + O 2 (11)
De actieve bestanddelen in hypochlorietbleekmiddelen variëren met de pH. Bij pH < 2 is Cl 2 de belangrijkste component in oplossing; bij pH 4 tot 6 is HOCl de dominante soort; bij pH > 9 is OCl – de enige aanwezige component. Het hypochloriet-ion in basische oplossing is het actieve bestanddeel in huishoudbleekmiddel, dat gewoonlijk ongeveer 5 tot 6 procent NaOCl bevat. Het OCl – ion oxideert chromoforen in gekleurde materialen, en wordt zelf gereduceerd tot chloride- en hydroxide-ionen.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Het bleekproces dat door commercieel hypochloriet bleekmiddel wordt bewerkstelligd, wordt vaak versterkt door het gebruik van optische witmakers, verbindingen die invallend ultraviolet licht absorberen en zichtbaar licht uitstralen, waardoor het weefsel helderder en witter lijkt.
Waterstofperoxide (H 2 O 2 ) . Waterstofperoxide kan worden bereid door de reactie van bariumperoxide en zwavelzuur (zie vergelijking 13). Omdat bariumsulfaat neerslaat, kan waterstofperoxide gemakkelijk worden afgescheiden.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Waterstofperoxide, als bleekmiddel gebruikt in de pulp- en papierindustrie, heeft het voordeel dat het niet vervuilend is. Vanwege de instabiliteit van zuiver waterstofperoxide worden voor het bleken waterige oplossingen gebruikt. Bij kamertemperatuur ontleedt waterstofperoxide zeer langzaam tot water en zuurstof.
2H 2 O 2 → H 2 O + O 2 (14)
De aanwezigheid van kationen van overgangsmetalen (met name Fe 3+ , Mn 2+ , en Cu 2+ ) en andere katalysatoren versnelt deze reactie echter aanzienlijk. Dientengevolge moet waterig waterstofperoxide worden gestabiliseerd met complexvormers die de kationen van overgangsmetalen sekwestreren.
De actieve blekende soort in waterstofperoxide is het perhydroxyl anion , OOH – , gevormd door de ionisatie van H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
De zure ionisatieconstante van waterstofperoxide is zeer laag ( K a = 2 × 10 -12 ) met als gevolg dat oplossingen van H 2 O 2 alkalisch moeten worden gemaakt om

om de concentratie van OOH te verhogen – Bij afwezigheid van een alkalisch medium is waterstofperoxide niet langer doeltreffend als bleekmiddel. Zo wordt bij het bleken van het haar vaak gebruik gemaakt van waterstofperoxide (5-6%), maar ook van ammoniak om een alkalisch medium te verkrijgen.
Tegelijkertijd mag de pH niet boven 11 stijgen, omdat op dat punt de afbraak van OOH – begint.
2OOH – → O 2 + 2OH – (16)
Zuurstofverbindingen. Er bestaan een aantal vaste peroxygeenverbindingen die waterstofperoxide afgeven als ze in water worden opgelost. Hiertoe behoren natriumperboraat (NaBO 3 z 4H 2 O of NaBO 2 z H 2 O 2 z 3H 2 O) en natriumcarbonaat-peroxyhydraat (2Na 2 CO 3 z 3H 2 O 2 ). De structuur van natriumperboraat bevat het peroxoanion B 2 (O 2 ) 2 (OH) 4 2- , dat twee O-O-bindingen bevat die twee tetrahedrale BO 2 (OH) 2-groepen verbinden. Deze peroxygeenverbindingen worden gebruikt in detergenten, reinigingsmiddelen voor gebitten en tandpoeders.
Bleken met licht. Bleken met behulp van natuurlijk zonlicht of kunstlicht is gebruikt om vlekken van papieren artefacten te verwijderen en om textiel te behandelen. Het te bleken materiaal wordt eerst ondergedompeld in een alkalische oplossing van calcium- of magnesiumbicarbonaat, en vervolgens beschermd tegen ultraviolette straling door het af te dekken met plexiglas, Lexan of Mylar. Blootstelling aan licht vindt dan plaats gedurende twee tot vier uur, voor natuurlijk zonlicht, en twee tot twaalf uur, voor kunstlicht.
Reducerende bleekmiddelen
Reducerende middelen gebruikt bij het bleken omvatten sulfieten, bisulfieten, dithionieten, en natriumborohydride, die alle worden gebruikt bij het bleken van pulp en textiel.
Sulfieten (SO 3 2- ) en bisulfieten (HSO 3 – ). De oxidatietoestand van zwavel in zowel SO 3 2- als HSO 3 – is +4, en oxidatie tot +6 treedt gemakkelijk op, met de vorming van respectievelijk SO 4 2- en HSO 4 – , waardoor sulfieten en bisulfieten goede reductiemiddelen zijn.
Dithionieten (S 2 O 4 2- ) . Zowel natrium- als zinkdithioniet worden gebruikt bij het bleken van mechanische pulp en textiel. De bereiding van het dithioniet-ion wordt bereikt via de reductie van het bisulfiet-ion en zwaveldioxide met Zn-stof.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
Het dithioniet-ion, S 2 O 4 2- , dat zwavel in de oxidatietoestand +3 heeft, gedraagt zich in alkalische oplossing als een sterk reductiemiddel.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
Bij verlaging van de pH neemt het reducerend vermogen van het dithioniet-ion af, zoals voorspeld door het principe van LeChatelier.
Dithionieten zijn nuttig bij het verwijderen van roestvlekken, en neutrale citraatoplossingen van Na 2 S 2 O 4 werden gebruikt om ijzercorrosieproducten te verwijderen van voorwerpen die werden geborgen van de Titanic.
Natriumborohydride (NaBH 4 ). Natriumborohydride is voornamelijk gebruikt bij het industrieel bleken van mechanische pulp. Het BH 4 – ion is een sterk reductiemiddel in alkalische oplossing.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Een probleem bij het gebruik van natriumboorhydride is dat het BH 4 – ion langzaam ontleedt in een waterige oplossing.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Als alternatieve methode kunnen de BH 4 – zouten worden opgelost in CH 3 OH of het minder giftige C 2 H 5 OH. De ontleding van het BH 4 – ion in alcoholen verloopt veel trager:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Conclusie
Een bleekmiddel kan een stof witter maken of ontkleuren door te reageren met de chromoforen die verantwoordelijk zijn voor de kleur van de stof. Afhankelijk van de aard van de chromoforen zal het bleekmiddel een oxiderende of een reducerende stof zijn. Dat wil zeggen dat de chromofoor wordt geoxideerd of gereduceerd om een kleurloze of wittere stof te produceren. De bleekmiddelen en hun commerciële toepassingen zijn samengevat in tabel 1.