Trend 2: Voor oxozuren met een bepaald centraal atoom neemt de zuurgraad toe met de oxidatietoestand van het centrale element of, met andere woorden, met het aantal oxygenen dat aan het centrale atoom gebonden is.
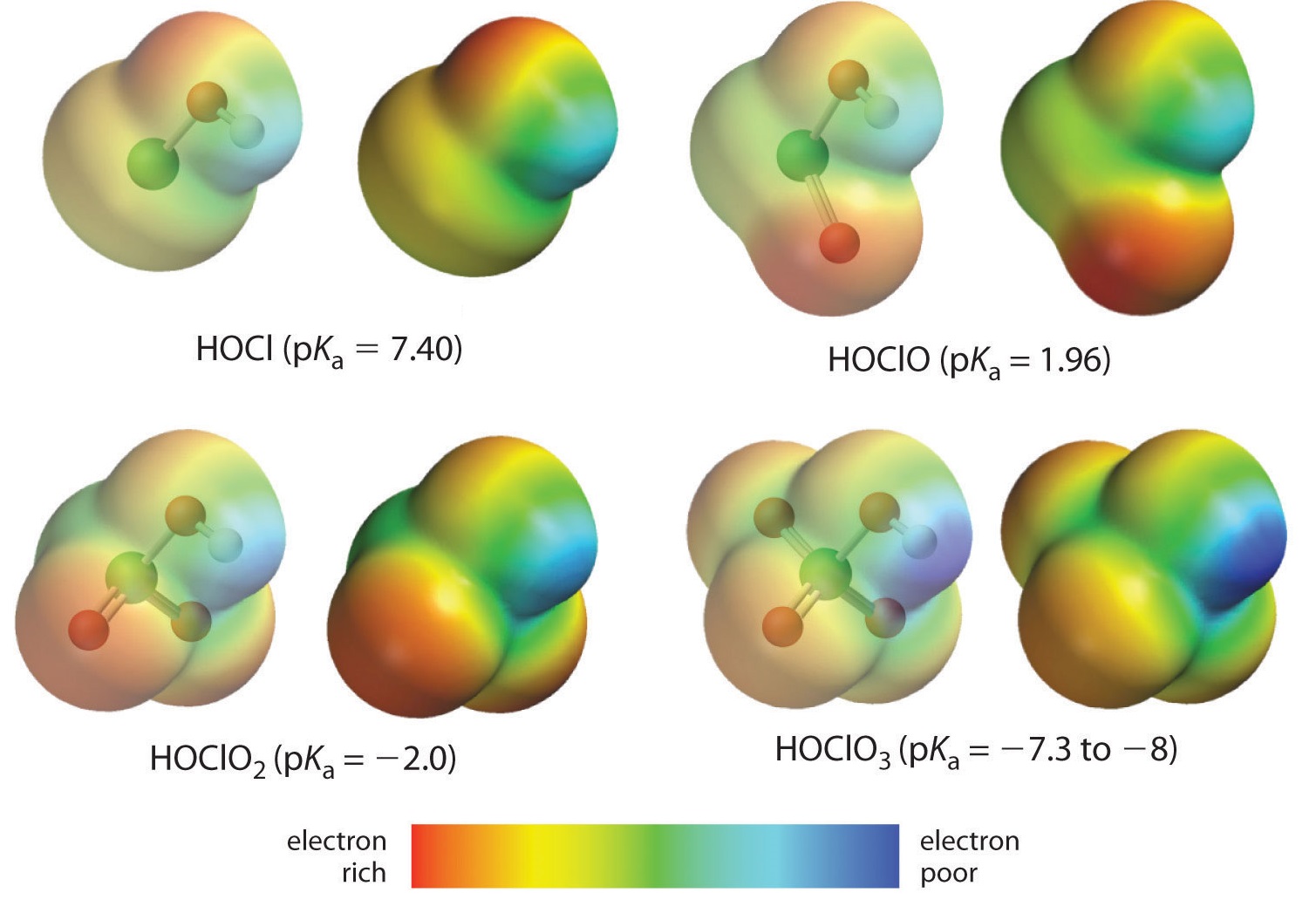
Hier kijken we naar de trend voor zuren waarin er variabele aantallen zuurstof aan een bepaald centraal atoom gebonden zijn. Een voorbeeld zijn de reeksen perchloorzuren (\ce{ClO_4^{-}}), chloorzuren (\ce{ClO_3^{-}}), chloorzuren (\ce{ClO_2^{-}})), en hypochloorzuren (\ce{ClO^{-}})). In deze reeksen geldt: hoe groter het aantal oxygenen, hoe sterker het zuur. Dit kan op verschillende manieren worden verklaard. Vanuit het standpunt van het zuur zelf is de sleutelfactor opnieuw het inductieve effect, in dit geval het vermogen van de oxygenen die aan het centrale atoom zijn verbonden om de elektronendichtheid over de OH-binding te trekken. Dit blijkt uit het ladingsdichtheidsdiagram voor de chlooroxozuren in figuur 1, waarin de partiële positieve lading van de zure waterstof toeneemt met het aantal aanwezige oxygenen.
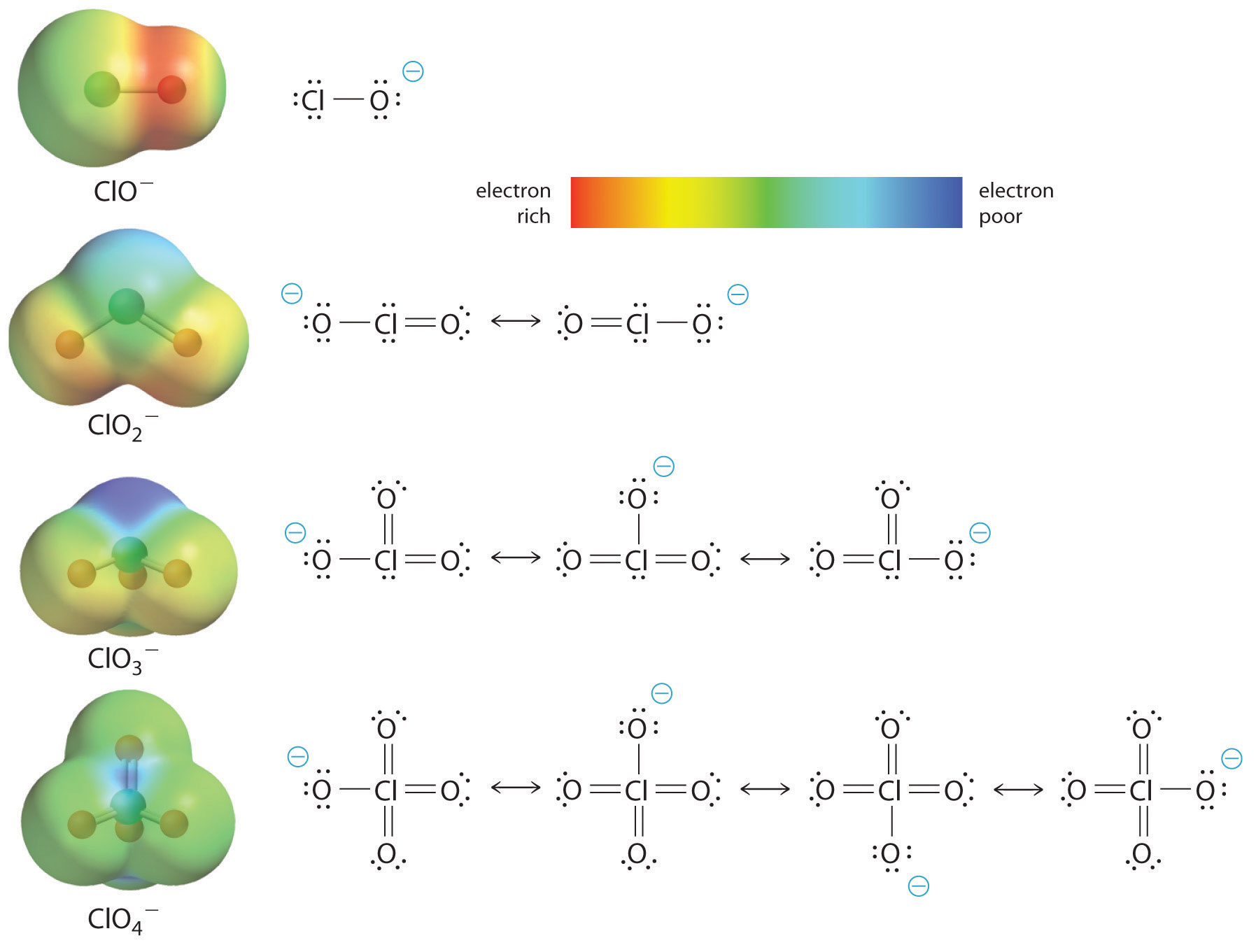
De toename van de zuurgraad van oxozuren met het aantal oxygenen dat aan het centrale atoom is gebonden, kan ook worden gezien door te kijken naar de stabiliteit van het geconjugeerde oxyanion. Dat de stabiliteit van de geconjugeerde base toeneemt met het aantal oxygenen blijkt uit de ladingsdistributiediagrammen en Lewisbindingsmodellen voor de chlooroxanionen die in figuur (PaginaIndex{2}) zijn afgebeeld. Naarmate de negatieve lading over meer zuurstofatomen wordt verdeeld, wordt ze steeds diffuser.
Oefening \(\PageIndex{1}})
Zwavel en seleen vormen beide oxozuren met de formule \(\ce{H_2EO_4}) waarbij E S of Se is. Deze worden respectievelijk zwavelzuur en seleenzuur genoemd. Welk oxozuur zou je zuurder verwachten: seleenzuur of zwaveligzuur?
Antwoord
Zwavelig zuur zou zuurder moeten zijn. Omdat zwavel elektronegatiever is dan selenium zal zwavel de OH bindingen in sterkere mate polariseren, waardoor ze zuurder worden. Deze voorspelling wordt bevestigd door een vergelijking van de pK_a waarden van de zuren:
| Zuur | (pK_{a1}) | (pK_{a2}) |
|---|---|---|
| zwavelig zuur, \(H_2SO_3}) | 1.85 | 7.2 |
| zwavelig zuur, \(H_2SeO_3) | 2.62 | 8.32 |