Nome genérico: fluocinonida
Formulário de dosagem: Gel
Revisado medicamente por Drugs.com. Última atualização em 22 de junho de 2020.
- Visão geral
- Efeitos colaterais
- Dosagem
- Profissional
- Interações
- Mais
Rx Somente
A marca Lidex foi descontinuada no U.S. Se versões genéricas deste produto foram aprovadas pela FDA, pode haver equivalentes genéricos disponíveis.
- Lidex Description
- Lidex – Farmacologia Clínica
- Farmacocinética
- Indicações e Uso para Lidex
- Contraindicações
- Precauções
- Geral
- Informação para o paciente
- Testes Laboratoriais
- Carcinogénese, Mutagénese e Imparidade da Fertilidade
- Gravidez Categoria C
- Mães amamentadoras
- O uso pediátrico
- Reações adversas
- Oversidade
- Dose e administração de lidex
- Como é fornecido o Lidex
- Perguntas frequentes
- Mais sobre Lidex (fluocinonida tópica)
- Recursos de consumo
- Recursos profissionais
- Guias de tratamento relacionadas
Lidex Description
Lidex® (fluocinonida) O Gel 0,05% destina-se à administração tópica. O componente ativo é o fluocinononida corticosteróide, que é o éster 21-acetate do acetonida fluocinolona e tem o nome químico pregna-1,4-diene-3,20-diona,21-(acetiloxi)-6,9-difluoro-11-hidroxi-16,17–,(6α,11β,16α)-. Possui a seguinte estrutura química:
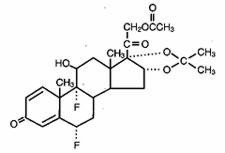
Lidex Gel contém fluocinonida 0,5 mg/g em uma base de gel especialmente formulada, composta de carbômero 940, edetate dissódico, galato de popila, propilenoglicol, hidróxido de sódio e/ou ácido clorídrico (para ajustar o pH), e água (purificada). Este veículo transparente, incolor, tixotrópico é sem gordura, sem manchas e completamente miscível em água.
Nesta formulação, o ingrediente ativo é totalmente em solução.
Lidex – Farmacologia Clínica
Os corticosteróides tópicos partilham acções anti-inflamatórias, anti-pruríticas e vasoconstritoras.
O mecanismo da actividade anti-inflamatória dos corticosteróides tópicos não é claro. Vários métodos laboratoriais, incluindo ensaios vasoconstritores, são usados para comparar e prever as potências e/ou eficácias clínicas dos corticosteróides tópicos. Há algumas evidências que sugerem que existe uma correlação reconhecível entre a potência vasoconstritora e a eficácia terapêutica no homem.
Farmacocinética
A extensão da absorção percutânea dos corticosteróides tópicos é determinada por muitos fatores, incluindo o veículo, a integridade da barreira epidérmica, e o uso de curativos oclusivos.
Os corticosteróides tópicos podem ser absorvidos da pele normal intacta. Inflamação e/ou outros processos de doenças na pele aumentam a absorção percutânea. Os pensos oclusivos aumentam substancialmente a absorção percutânea dos corticosteróides tópicos. Assim, os curativos oclusivos podem ser um valioso coadjuvante terapêutico para o tratamento de dermatoses resistentes (ver DOSAGEM E ADMINISTRAÇÃO).
Após serem absorvidos através da pele, os corticosteróides tópicos são manipulados através de vias farmacocinéticas semelhantes aos corticosteróides administrados sistemicamente. Os corticosteróides estão ligados a proteínas plasmáticas em diferentes graus. Os corticosteróides são metabolizados principalmente no fígado e são depois excretados pelos rins. Alguns dos corticosteróides tópicos e seus metabólitos também são excretados na bílis.
Indicações e Uso para Lidex
Gelidex é indicado para o alívio das manifestações inflamatórias e pruriginosas das dermatoses corticosteróides-responsivas.
Contraindicações
Os corticosteróides tópicos estão contra-indicados naqueles pacientes com histórico de hipersensibilidade a qualquer um dos componentes do preparo.
Precauções
Geral
A absorção sistêmica de corticosteróides tópicos tem produzido supressão hipotálamo-hipófise-adrenal (HPA) reversível, manifestações da síndrome de Cushing, hiperglicemia e glucosúria em alguns pacientes.
Condições que aumentam a absorção sistêmica incluem a aplicação dos esteróides mais potentes, uso sobre grandes áreas superficiais, uso prolongado e a adição de curativos oclusivos.
Por isso, pacientes que recebem uma grande dose de um esteróide tópico potente aplicado sobre uma grande área superficial ou sob um curativo oclusivo devem ser avaliados periodicamente para evidência de supressão do eixo HPA usando os testes de estimulação do cortisol urinário livre e ACTH. Se a supressão do eixo HPA for observada, deve-se tentar retirar a droga, reduzir a frequência de aplicação ou substituir um esteróide menos potente.
A recuperação da função do eixo HPA é geralmente rápida e completa após a descontinuação da droga. Poucas vezes, sinais e sintomas de retirada de esteróides podem ocorrer, exigindo corticosteróides sistêmicos suplementares.
As crianças podem absorver quantidades proporcionalmente maiores de corticosteróides tópicos e, portanto, serem mais suscetíveis à toxicidade sistêmica (ver PRECAUÇÕES- Uso Pediátrico). Se ocorrer irritação, os corticosteroides tópicos devem ser descontinuados e instituída terapia apropriada.
Como com qualquer produto corticosteroide tópico, o uso prolongado pode produzir atrofia da pele e tecidos subcutâneos. Quando usado em áreas intertriginosas ou flexoras, ou na face, isto pode ocorrer mesmo com uso a curto prazo.
Na presença de infecções dermatológicas, deve ser instituído o uso de um agente antifúngico ou antibacteriano apropriado. Se uma resposta favorável não ocorrer prontamente, o corticosteróide deve ser descontinuado até que a infecção tenha sido adequadamente controlada.
Informação para o paciente
As pacientes que usam corticosteróides tópicos devem receber as seguintes informações e instruções:
- Esta medicação deve ser usada conforme orientação do médico. É apenas para uso externo. Evite o contato com os olhos.
- As pacientes devem ser aconselhadas a não usar este medicamento para qualquer distúrbio que não aquele para o qual foi prescrito.
- A área da pele tratada não deve ser enfaixada ou coberta de outra forma ou embrulhada como sendo oclusiva, a menos que seja indicado pelo médico.
- As pacientes devem relatar quaisquer sinais de reacções adversas locais, especialmente sob curativos oclusivos.
- As pacientes pediátricas devem ser aconselhadas a não usar fraldas justas ou calças de plástico numa criança a ser tratada na área das fraldas, uma vez que estas peças de vestuário podem constituir curativos oclusivos.
Testes Laboratoriais
Os seguintes testes podem ser úteis na avaliação da supressão do eixo HPA:
Teste de cortisol urinário livre
Teste de estimulação ACTH
Carcinogénese, Mutagénese e Imparidade da Fertilidade
Não foram realizados estudos a longo prazo com animais para avaliar o potencial carcinogénico ou o efeito sobre a fertilidade dos corticosteróides tópicos.
Estudos para determinar a mutagenicidade com prednisolona e hidrocortisona revelaram resultados negativos.
Gravidez Categoria C
Corticosteróides são geralmente teratogênicos em animais de laboratório quando administrados sistemicamente em níveis relativamente baixos de dosagem. Os corticosteróides mais potentes demonstraram ser teratogênicos após a aplicação dérmica em animais de laboratório. Não há estudos adequados e bem controlados em mulheres grávidas sobre os efeitos teratogênicos dos corticosteróides aplicados topicamente. Portanto, os corticosteróides tópicos só devem ser usados durante a gravidez se o benefício potencial justificar o risco potencial para o feto. Drogas desta classe não devem ser usadas extensivamente em pacientes grávidas, em grandes quantidades, ou por períodos prolongados de tempo.
Mães amamentadoras
Não se sabe se a administração tópica de corticosteroides poderia resultar em absorção sistêmica suficiente para produzir quantidades detectáveis no leite materno. Os corticosteróides administrados sistematicamente são secretados no leite materno em quantidades não susceptíveis de ter um efeito deletério no lactente. Entretanto, deve-se ter cuidado quando corticosteroides tópicos são administrados a uma mulher lactante.
O uso pediátrico
As pacientes pediátricas podem demonstrar maior suscetibilidade à supressão do eixo HPA e síndrome de Cushing induzidos por corticosteroides tópicos do que as pacientes maduras devido a uma maior área de superfície da pele em relação ao peso corporal.
Supressão do eixo HPA, síndrome de Cushing e hipertensão intracraniana foram relatadas em crianças que receberam corticosteróides tópicos. Manifestações de supressão adrenal em crianças incluem retardo linear de crescimento, atraso no ganho de peso, baixos níveis plasmáticos de cortisol e ausência de resposta à estimulação do ACTH. Manifestações de hipertensão intracraniana incluem fontanelas salientes, dores de cabeça e papiledema bilateral.
Administração de corticosteroides tópicos em crianças deve ser limitada à menor quantidade compatível com um regime terapêutico eficaz. A terapia com corticosteroides crônicos pode interferir no crescimento e desenvolvimento da criança.
Reações adversas
As seguintes reações adversas locais são relatadas raramente com corticosteroides tópicos, mas podem ocorrer com maior freqüência com o uso de curativos oclusivos. Essas reações são listadas em ordem decrescente aproximada de ocorrência:
| Queimadura | Dermatite inferior |
| Incetração | Dermatite de contacto alérgica |
| Irritação | Maceração da pele |
| Secura | Infecção secundária |
| Folliculitis | Atrofia da pele |
| Hipertrichosis | Striae |
| Erupções uniformes | Miliaria |
| Hipopigmentação |
Oversidade
Os corticosteróides aplicados ciclicamente podem ser absorvidos em quantidades suficientes para produzir efeitos sistémicos (ver PRECAUÇÕES).
Dose e administração de lidex
O gel de lidex é geralmente aplicado na área afetada como uma película fina de duas a quatro vezes ao dia, dependendo da gravidade da condição.
O curativo exclusivo pode ser usado para o tratamento da psoríase ou condições recalcitrantes.
Se uma infecção se desenvolver, o uso de curativos oclusivos deve ser descontinuado e instituída terapia antimicrobiana apropriada.
Como é fornecido o Lidex
Lidex® (fluocinonida) Gel 0.05% é fornecido em
15 g Tubo – NDC 99207-507-13
30 g Tubo – NDC 99207-507-14
60 g Tubo – NDC 99207-507-17
Armazenar à temperatura ambiente 15°-30°C (59°-86°F).
Fabricado para:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
Abril 2001
IN-5071/S
| Lidex Gel de fluocinonida |
||||||||||||||||
> |
||||||||||||||||
|
||||||||||||||||
|
>
|
||||||||||||||||
> |
||||||||||||||||
| > | ||||||||||||||||
>
>
rotulador – MEDICIS
Perguntas frequentes
- É usado para a queda de cabelo?
- O que é um substituto para o creme de fluocinonida?
- O fluocinoneto é um creme antifúngico?
- Por quanto tempo deve usar o fluocinoneto?
- Para que serve o creme de fluocinonida?
- Pode o fluocinonida ser usado para tratar uma erupção cutânea venenosa?
- É um esteróide?
- É um antibiótico?
Mais sobre Lidex (fluocinonida tópica)
- Efeitos secundários
- Durante a gravidez ou amamentação
- Informação da dosagem
- Interacções com o drogado
- 8 Revisões
- Disponibilidade genérica
- Classe de drogados: esteróides tópicos
Recursos de consumo
- Leitura Avançada
- Lidex Mild (Leitura Avançada)
- Lidex Regular (Leitura Avançada)
Recursos profissionais
- Informação sobre a impressão
- Solução tópicaidex (FDA)
- Pomadaidex (FDA)
Outras marcas Vanos, Lidex-E
Guias de tratamento relacionadas
- Dermatite atópica
- Eczema
- Dermatite
- Psoríase
Relatação de responsabilidade médica