General Overview
Uma grande fração de microorganismos não só residem dentro de nós, mas também vivem em nós. De fato, a pele humana abriga uma mistura heterogênea de bactérias, fungos e vírus, a maioria não patogênicos, que provavelmente contribuem para a saúde da superfície da pele (Figura 1). A Propionibacterium acnes (P. acnes) é uma bactéria ubíqua, de crescimento lento, em forma de bastão, que não forma esporos, aneróbio Gram-positivo (Figura 2) encontrada em todos os locais do corpo, incluindo os folículos sebáceos da face e pescoço (Funke et al., 1997; Grice and Segre, 2011; Findley and Grice, 2014). É frequentemente considerada parte da nossa microbiota comensal em locais de barreira (Cogen et al., 2008) que é estabelecida através de mecanismos de tolerância imunológica adaptativa durante o período inicial do neonato (Scharschmidt et al., 2015). Embora a distribuição topográfica do anaeróbio em sítios sebáceos seja significativa, a distribuição espacial e pessoal do P. acnes é mais específica para cada indivíduo do que para cada sítio (Oh et al., 2014). Além disso, a biogeografia e a individualidade do P. acnes é altamente dinâmica, pois alterações na saúde ou no pH, temperatura, umidade e/ou conteúdo sebáceo também podem afetar a gama de nichos ocupados pelo microorganismo (Grice et al., 2009). Semelhante à distribuição dos micróbios cutâneos, as condições cutâneas também podem moldar a função do P. acnes em termos de expansão patogénica na doença. Por exemplo, o P. acnes tem sido ligado a insultos cutâneos como acne vulgar na face e pescoço, e hipermelanose macular progressiva nas costas (Bojar e Holanda, 2004; Kurokawa et al., 2009; Barnard et al., 2016). Além disso, certos fitotipos associados à doença de P. acnes têm a capacidade de persistir em implantes corporais e dispositivos cirúrgicos causando uma ampla gama de condições infecciosas pós-operatórias, tais como endocardite, endoftalmite e infecções do sistema nervoso intravascular (Perry e Lambert, 2011; Portillo et al., 2013). As características desfavoráveis do P. acnes também se estendem à glândula prostática, onde a invasão tecidual e a deposição intracelular da bactéria tem sido frequentemente observada em células epiteliais glandulares e macrófagos circulantes; um fenômeno que se pensa contribuir indiretamente para a hiperplasia benigna da próstata (HBP) e o câncer de próstata (Tanabe et al, 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016). No entanto, não é claro quais são os mecanismos subjacentes utilizados por P. acnes para induzir infecção, inflamação e/ou metástase fora da pele. O que se sabe com alguma certeza é que queratinócitos, sebócitos e/ou adipócitos infectados por bactérias secretam várias quimiocinas e citocinas pró-inflamatórias, bem como factores anti-microbianos (por exemplo cathelicidina) sugerindo mecanismos específicos da doença (Graham et al., 2004; Nagy et al., 2006; Lee et al., 2010; Zhou et al., 2015; Sanford et al., 2016; Yu et al., 2016).
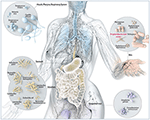
Figura 1. Ilustração esquemática de micróbios comuns encontrados em locais de barreira em humanos, incluindo P. acnes. Enquanto o P. acnes está presente em todas as superfícies externas e internas (ou seja, epitélio oral e gastrintestinal, conjuntiva), ele é mais prevalente na pele humana. Aí reside nos folículos pilosos da face e das costas onde está associado à doença de pele comum acne vulgaris. Pela maioria, o P acnes ainda é considerado um microorganismo benigno e comensal, no entanto, os relatos sobre o seu lado malicioso e oportunista estão aumentando. Adaptado e com a gentil permissão de Bryan Christie Design (http://bryanchristiedesign.com/).
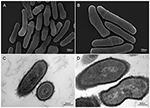
Figura 2. Imagens de varredura e transmissão microscópica eletrônica (SEM e TEM) de P. acnes strain KPA (A, B = SEM; C, D = TEM). Os recentes avanços nas técnicas de isolamento e culto estão revelando que as infecções por P. acnes têm sido grosseiramente subestimadas, lançando uma nova luz sobre esta espécie bacteriana oportunista. Microscopia por Volker Brinkmann, Max Planck Institute for Infection Biology, Berlim, Alemanha. Barra de escala = 200/300nm.
Sarcoidose
Sarcoidose é uma doença de etiologia desconhecida que leva à inflamação em órgãos tão diversos como pulmões, fígado, pele e linfáticos. Uma suposta ligação de sarcoidose com P. acnes foi proposta pela primeira vez quando a bactéria foi isolada de lesões sarcóides da pele e linfonodos (Eishi et al., 2002; Yamada et al., 2002). Estas descobertas foram significativamente corroboradas (de Brouwer et al., 2015), e expandidas por várias experiências in vitro demonstrando a capacidade de invasão de P. acnes nas linhas celulares HEK293T (rim embrionário humano) e A549 (carcinoma epitelial alveolar humano) (Tanabe et al., 2006). Os trabalhos mais recentes em lavado bronco-alveolar sarcóide (BAL) fluido e células mostraram significativa upregulação de uma resposta imunológica específica de P. acnes (Schupp et al., 2015). Além disso, experiências em ratos mostraram que o P. acnes viável pode induzir granulomas pulmonares semelhantes aos observados em pacientes com sarcoidose (Werner et al., 2017). Uma visão geral detalhando a ligação entre sarcoidose e P. acnes é ainda dada por Eishi (2013).
Estudos tentando caracterizar as vias de sinalização ativadas por P. acnes durante a infecção mostraram que o fator nuclear-kappaB , um fator transcripcional que regula a expressão dos genes envolvidos nas cascatas imunes e inflamatórias é ativado por P. acnes (Kim et al., 2002). Mais amplamente, o receptor de toll-like receptor 2 (TLR2) demonstrou ser um receptor crítico para a resposta dependente de NF-κB ao P. acnes, revelando a capacidade desta bactéria de provocar a ativação seletiva de genes de imunidade inata (Inohara e Nuñez, 2001; Chamaillard et al., 2003; Moreira e Zamboni, 2012). Além disso, o papel da genética do hospedeiro foi examinado em casos de sarcoidose que estavam associados à infecção por P. acnes. Polimorfismos de nucleotídeos únicos (SNPs) no domínio da oligomerização de nucleotídeos (NOD) das proteínas NOD1 e NOD2 foram correlacionados com infecção por P. acnes entre 73 pacientes com sarcoidose com 52 pneumonia intersticial e 215 controles saudáveis (Tanabe et al., 2006). NOD1 e NOD2 são receptores de reconhecimento de padrão intracelular que podem detectar moléculas bacterianas como peptidoglicanos moieties. Na mesma linha, experimentos in vitro mostraram que a internalização de P. acnes em células HEK293T pode resultar na ativação de NOD1 e NOD2, sugerindo um mecanismo de doença baseado em inflamação crônica ou imunossupressão local (Tanabe et al., 2006). Estes achados também sugerem que a acnes invasiva de P. acnes pode agir como ligantes bacterianos para causar ativação aberrante do receptor de NOD em certos indivíduos com suscetibilidade de longa duração à sarcoidose. Entretanto, experimentos futuros têm que esclarecer a cronologia mecânica exata de se ou como a ativação aberrante de P. acnes-mediada por NF-κB pode induzir a formação de granuloma de forma dependente de NOD1/NOD2.
Embora a P. acnes invasiva possa ser uma possível etiologia de sarcoidose e talvez de outras doenças, elucidando a causa e correlação entre P. acnes e a patologia é obscura como heterogeneidade da estirpe bacteriana, a genética do hospedeiro, bem como os ambientes do hospedeiro, devem ser considerados sempre que um estudo associa um microbioma a um estado de doença.
Benigno Hiperplasia da Próstata (HBP) e Câncer de Próstata
Processos inflamatórios crônicos ou recorrentes há muito tempo têm sido implicados na progressão da HBP e do câncer de próstata (De Marzo et al, 1999; Nelson et al., 2004; Sfanos et al., 2014). A inflamação é atribuída à presença de biomarcadores específicos como a interleucina (IL)-6 elevada, o fator de necrose tumoral alfa (TNFα) e a proteína da fase aguda, proteína C reativa (Mechergui et al., 2009; Menschikowski et al., 2013; Yu et al., 2015). Trabalhos recentes sobre líquidos urológicos (ou seja, urina, líquido seminal, secreções prostáticas) bem como biópsias prostáticas sugerem uma mudança condicional significativa para certas espécies microbianas que podem ser usadas como índice diagnóstico (Yu et al., 2015; Ni et al, 2016).
Uma boa quantidade de trabalho sugere que a associação específica de P. acnes com a próstata e a invasão de células epiteliais da próstata em particular (Figura 3) pode contribuir para a patologia da HBP ou cancro da próstata com um componente inflamatório (Sfanos et al., 2013; Davidsson et al., 2016). Contudo, não está actualmente claro se o P. acnes representa um verdadeiro agente infeccioso da próstata, um microbião comensal ou acidental da próstata. É plausível que o P. acnes localizado na próstata seja derivado da pele que é introduzida acidentalmente, por exemplo, durante uma biopsia prostática – um ponto de vista que deve levantar preocupações com certos cenários de trabalho de diagnóstico.
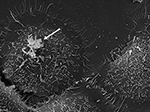
Figura 3. SEM da estirpe P. acnes P6 (seta) in vitro em células epiteliais da próstata cultivadas RWPE1. O comportamento epitelial das células epiteliais da próstata de P. acnes está bem documentado em estudos in vivo e baseados em células, onde um processo de invasão mediado por vimentina parece provável (Mak et al., 2012). Microscopia por Volker Brinkmann, Max Planck Institute for Infection Biology, Berlim, Alemanha. Barra de escala = 2 μm.
Seja qual for a rota de entrada ou o potencial patogénico, um número significativo de tecidos prostáticos obtidos através da ressecção transuretral para BPH, ou prostatectomia radical para o cancro, foram previamente testados positivos para agregados de P. acnes aparentemente residentes dentro de macrófagos roving (Alexeyev et al., 2007; Bae et al., 2014). Relatórios adicionais baseados em amostras humanas forneceram mais evidências de uma ligação entre BPH ou cancro da próstata e P. acnes usando várias abordagens técnicas, incluindo cultivo, microscopia confocal para visualização da bactéria e hibridação in situ, imuno-histoquímica (Figura 4) e perfil de 16S rRNA baseado em PCR (Hochreiter et al., 2000; Cohen et al., 2005; Sfanos et al., 2008; Fassi-Fehri et al., 2011; Bae et al., 2014; Davidsson et al., 2016). Outras evidências vêm de estudos com animais indicando que a inoculação de P. acnes na próstata murina ou na bexiga de rato leva a uma resposta inflamatória explícita a longo prazo e a uma ampla gama de distúrbios celulares dentro da glândula prostática (Olsson et al., 2012; Shinohara et al., 2013).
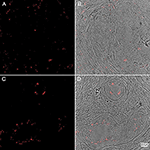
Figure 4. Imuno-histoquímica de amostras de tecido prostático humano coradas com anticorpo P. acnes (vermelho). Adaptado com permissão de Fassi-Fehri et al., 2011 (Figura Complementar 2B). Presença de P. acnes em amostras de tecido prostático humano com hiperplasia benigna da próstata (A,B); ou adenocarcinoma (C,D). Extensa carga bacteriana foi detectada em ambos os casos.
Attempts to phylogenetically analyze diseaseassociated P. acnes strains from cancerous prostate glands have revealed that most prostate isolates belong to phylogenetic clades that are rare on human skin, indicating that a skin-derived contamination during sampling is unlikely (Mak et al., 2013; Davidsson et al., 2016). Na mesma linha, vias inflamatórias semelhantes às descritas para sarcoidose, incluindo NF-κB, IL-6, STAT3 e COX2, parecem ser ativadas por P. acnes tanto em condições in situ como in vitro (Drott et al., 2010; Fassi-Fehri et al., 2011; Mak et al., 2013; Tsai et al., 2013; Bae et al., 2014). Embora a etiologia precisa para estas alterações inflamatórias ainda não esteja clara, várias vias receptoras de reconhecimento de padrões de membrana estão amplamente distribuídas nos sistemas urinário e genital de mamíferos que reconhecem avidamente componentes bacterianos e virais (Jorgensen e Seed, 2012; Gambara et al., 2013). Estes receptores de células hospedeiras, por exemplo TLRs, promovem a produção de citocinas que é uma característica central da imunidade inata contra patógenos microbianos. Coletivamente, estes achados sugerem que através da sua capacidade de desencadear vários aspectos da imunidade, a invasão de P. acnes pode agir como principal condutor e/ou amplificador da gravidade da doença.
Spondilodiscite e dor nas costas
Uma das várias complicações pós-operatórias envolvendo P. acnes é a inflamação do disco intervertebral e do espaço intervertebral circundante (diskitis) após a discectomia (Harris et al., 2005). A infecção degenerativa concomitante das vértebras adjacentes (espondilodiscite) pode ser uma característica comum e a causa raiz de graves danos neurológicos e dor se o tratamento for retardado (Uçkay et al., 2010). Além da introdução cirúrgica involuntária na coluna vertebral, os patógenos também podem chegar através do suprimento de sangue arterial e venoso da coluna vertebral (disseminação hematogênica). Enquanto as espécies Staphylococcus aureus, Escherichia coli, e Proteus são mais comumente isoladas, P. acnes é o patógeno anaeróbico mais abundante neste contexto e provavelmente subreportado devido a desafios de culto. Tem havido algumas evidências clínicas de que pacientes com hérnia nuclear (nucleus pulposus) material disco infectado com patógenos anaeróbicos em geral, e P. acnes em particular, são mais prováveis de desenvolver inflamação e edema das vértebras adjacentes (Modic changes type I) e dor nas costas (Albert et al., 2013; Urquhart et al., 2015). O acompanhamento clínico e animal está agora corroborando os achados iniciais mostrando que a proliferação local de P. acnes causa upregulação de marcadores inflamatórios e degeneração discal consistente com mudanças modicas (Aghazadeh et al., 2016; Dudli et al., 2016). Existem agora até primeiras evidências clínicas que sugerem que a infecção bacteriana do disco intervertebral com P. acnes e/ou Staphylococcus epidermidis pode, na verdade, preceder todos os outros problemas como causa raiz da hérnia discal e das alterações patológicas associadas (Rajasekaran et al, 2017).
Doença de Parkinson (DP)
O cérebro degenerado é caracterizado por danos no sistema neural que podem ser atribuídos à agregação atípica e deposição de proteínas mutantes ou desdobradas (por exemplo, corpos Lewy e neurites Lewy) como claramente documentado na DP idiopática (Taylor et al., 2002). O que geralmente não é apreciado é que o cérebro também é suscetível a invadir patógenos que vão desde vírus e bactérias até fungos. Esses patógenos, ou mais especificamente seus componentes endógenos e/ou metabólitos, podem produzir déficits neurológicos centrais que vão desde sinais sutis de demência e distonia, que resultam de infecção crônica e recorrente (De Chiara et al., 2012; Bibi et al., 2014), até doenças motoras mais graves dos neurônios, como por exemplo observado com o retrovírus endógeno humano K (Li et al., 2015). Assim, é claro que os humanos têm uma carga sistêmica tremendamente pesada de micróbios (Potgieter et al., 2015; Spadoni et al., 2015) que pode contribuir incidentalmente para a patologia de doenças neurodegenerativas progressivas com componente proteico atípico. Certamente, esta hipótese de trabalho está ganhando apoio considerável à medida que o comportamento cognitivo, emocional ou patológico parece ser afetado indiretamente pela distribuição espacial e pessoal dos micróbios agindo através do eixo intestinal-cérebro (Figura 5) (Collins et al., 2012; Dinan et al., 2013; Mayer et al., 2014; Burokas et al., 2015). De fato, um estudo recente de caso-controle demonstrou que a variação microbiana no trato gastrointestinal, tanto entre os indivíduos quanto dentro deles, corresponde mais significativamente às variações fenotípicas na DP (Scheperjans et al., 2015; Vizcarra et al., 2015). Embora os mecanismos subjacentes que ligam a composição da microbiota às diferenças na DP não sejam claros, o achado acima pode pelo menos explicar a alta prevalência de anormalidades gastrointestinais observadas em pacientes com DP (Dobbs et al., 2016). Além disso, a ligação da microbiota à gravidade da DP, biópsias de mucosa sigmóide e material fecal coletado de pacientes com DP mostrou a presença de espécies bacterianas oportunistas e pró-inflamatórias que frequentemente causam constipação crônica, síndrome do intestino irritável e colite ulcerativa (Keshavarzian et al., 2015). Coletivamente, estes resultados iniciais sugerem que as relações entre diferentes comunidades microbianas no intestino são uma comorbidade comum na DP, e que assinaturas individuais únicas do ecossistema intestinal podem reforçar as deficiências motoras clássicas da DP.
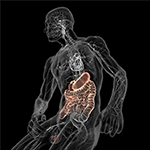
Figura 5. Ilustração esquemática do eixo intestinal (colorido) com o sistema digestivo cheio de micróbios em uma extremidade e o cérebro com seus centros de homeostasia (hipotálamo e hipófise) na outra. Ambos estão conectados através do sistema nervoso cardiovascular e autônomo, incluindo o nervo vago (nervo craniano X), o que poderia facilitar a transição microbiana para o sistema nervoso central (SNC). Por favor, com permissão de Bryan Christie Design (http://bryanchristiedesign.com/).
Against this background, a pergunta a ser feita é se existe alguma evidência de que P. acnes tem algum papel na fisiopatologia da DP. Para que esta possibilidade ocorra, duas condições devem ser satisfeitas: (1) A infecção por P. acnes deve preceder a ocorrência de sintomas clássicos da doença como tremores, iniciação motora e lentidão de movimento; e (2) A inoculação de P. acnes deve induzir suficientemente sintomas de DP e/ou levar à perda de neurônios de projeção de dopamina no núcleo do cérebro médio conhecidos como substantia nigra pars compacta. Até agora, nosso laboratório detectou grupos de P. acnes localizados em neurônios do cérebro médio e estruturas corticais próximas de cérebros autopsiados de PD (Figura 6). Esta descoberta inesperada acrescenta mais credenciais de P. acnes contribuindo indiretamente para surtos locais de inflamação semelhantes aos observados na sarcoidose e na HBP. Uma questão em aberto é a medida em que o P. acnes pode indiretamente melhorar certas características patológicas da DP. Como a DP é uma desordem altamente heterogênea, é improvável que um mecanismo da doença se aplique a todos os fenótipos da DP. Entretanto, é intrigante especular que micróbios da pele residentes poderiam iniciar ou ampliar a progressão da DP através de fatores inflamatórios e/ou predisposição genética.

Figura 6. Imuno-histoquímica de amostras de tecido cerebral médio de PD humano coradas para P. acnes (verde; A+B), microtubos neuronais (MAP2; vermelho; A) e núcleos (DAPI; azul; A+B). A autofluorescência de lipofuscina ligada à idade foi extinta com Sudan Black B. Presença de P. acnes (seta) no espaço periplasmático de um neurônio humano (A) entre o núcleo (n) e o citoesqueleto; ou neutrophil (B) com seu característico núcleo multi-lobado dentro de um capilar médio do cérebro (Cap). Estes achados são típicos da DP e ausentes na maioria das secções de controlo. Movimentos retrógrados ao longo dos nervos cranianos, micro hemorragias induzidas por trauma, bem como o sistema linfático recém-descoberto representam potenciais vias microbianas para o SNC.
Se P. acnes pode ter acesso a células dopaminérgicas no cérebro médio, qual é a via mais provável de inoculação e infecção? Embora a pele seja fisicamente compartimentada a partir do cérebro, a inoculação cruzada continua a ser um factor de risco. Por exemplo, os nares podem potencialmente abrigar estirpes patogênicas de P. acnes, que então translocariam para o parênquima cerebral para hiper-ativar macrófagos locais chamados microglia; um fenômeno que é uma característica consistente da patologia da DP (revisado por Chao et al., 2014). Pesquisas sobre infecções nosocomiais demonstram espécies bacterianas tão diversas como Pneumococcus sp. (Zwijnenburg et al., 2001) e Salmonella sp. (Bollen et al., 2008) a vaguear rapidamente ao longo do nervo olfactivo (nervo craniano 1; CN 1) e eventualmente para o bolbo olfactivo. Outra via potencial de entrada de micróbios nocivos ou de proteínas perigosas desdobradas é o nervo vago (nervo craniano 10; CN 10). De fato, sob algumas circunstâncias, agregados desdobrados na forma de corpos Lewy e neurites Lewy parecem migrar do nervo vago para o cérebro, fornecendo mais evidências de bactérias patogênicas em associação com proteínas tóxicas para potencialmente contribuir para a vulnerabilidade neuronal seletiva (Holmqvist et al., 2014). De interesse, os núcleos cerebrais do CN 1 e CN 10 estão entre os primeiros locais a mostrar preferencialmente deposição de corpos Lewy e neurites Lewy durante o curso da progressão da DP (Braak et al., 2004). Esta observação particular não apenas destaca uma provável rota de entrada de bactérias no cérebro, mas também fornece um mecanismo potencial para a observação de que a vagotomia truncal diminui significativamente o risco de DP (Svensson et al., 2015). A ligação entre traumatismo craniano e DP (Harris et al., 2013; Jafari et al., 2013; Pearce et al., 2015), juntamente com a noção de um microbioma sanguíneo diverso (Potgieter et al., 2015), implica um vasto potencial de oportunismo patogênico à medida que ocorrem brechas traumáticas na barreira cerebral do sangue. Com a recente descoberta de um sistema linfático cerebral (glymphatic) (Iliff et al., 2012; Hitscherich et al., 2016) outra rota potencial de infecção cerebral deve ser considerada.
Junto, há evidências pré-clínicas e algumas evidências clínicas para implicar indiretamente P. acnes como uma variável independente que afeta a incidência ou severidade da DP. Esta evidência é complementada por relatos que associam uma doença cutânea grave, acne inversa, à doença de Alzheimer (Wang et al., 2010). De uma perspectiva terapêutica, a possibilidade de P. acnes conduzir ou amplificar características centrais da DP representa um importante recurso para abordagens antibióticas a doenças neurodegenerativas. E de uma perspectiva de pesquisa, seria digno de se examinar mais de perto os pacientes com distúrbios cutâneos para evidências de neuropatologia com início mais precoce e um fenótipo de doença mais grave.
Future Outlook
A revisão apresentada neste artigo esboça um lado escuro inesperado do P. acnes com respeito à patologia. A persistência intracelular do P. acnes está implicada em doenças dos pulmões e da glândula prostática e possivelmente do cérebro. Este é um testemunho claro da patogenicidade das bactérias derivadas da pele em certos fenótipos da doença. Mais investigação terá de se concentrar em várias questões que se aproximam na biologia do P. acnes: (1) quais são as interacções cruciais do P. acnes na susceptibilidade a doenças? (2) Quais são os mecanismos utilizados pelo P. acnes para influenciar a progressão da doença? (3) Se certas populações de P. acnes podem aumentar a susceptibilidade à gravidade da doença, existem outras configurações de P. acnes que são protetoras? (4) Prova de conceito que a infecção pelo P. acnes se associa diretamente à patologia da doença, ou mais especificamente, o estudo do conceito mostra a causa ou apenas a correlação? E finalmente (5) A P. acnes-driven disease pathology pode ser tratada com antibióticos convencionais e aplicações diagnósticas?
Author Contributions
JL, KER, JC, KR, CH, AM, HB, e GT prepararam o manuscrito. JL e MS prepararam as figuras.
Financiamento
Financiamento intramural para JL foi fornecido pelo NYIT College of Osteopathic Medicine.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.