Lassen Sie uns zunächst die Grundlagen der Durchflusszytometrie erörtern
Was ist Durchflusszytometrie?
Die Durchflusszytometrie ist eine Technik zum Nachweis und zur Messung physikalischer und chemischer Merkmale einer Population von Zellen oder Partikeln. Bei diesem Verfahren wird eine Probe, die Zellen oder Partikel enthält, in einer Flüssigkeit suspendiert und in das Durchflusszytometergerät injiziert.
Was ist der Zweck der Durchflusszytometrie?
Die Durchflusszytometrie ist eine bewährte Methode zur Identifizierung von Zellen in Lösung und wird am häufigsten zur Untersuchung von peripherem Blut, Knochenmark und anderen Körperflüssigkeiten eingesetzt. Durchflusszytometrische Untersuchungen werden zur Identifizierung und Quantifizierung von Immunzellen und zur Charakterisierung von hämatologischen Malignomen eingesetzt.1 Sie können messen:
- Zellgröße
- Zellgranularität
- Gesamt-DNA
- neusynthetisierte
- DNA-Genexpression
- Oberflächenrezeptoren
- intrazelluläre Proteine
- Transientes Signal
Die Fähigkeit, diese Messungen in einer sehr kurzen Zeitspanne durchzuführen, ist einer der Hauptvorteile des durchflusszytometrischen Verfahrens. Sie können bis zu drei bis sechs Eigenschaften oder Komponenten in einer einzigen Probe, Zelle für Zelle, für etwa 10.000 Zellen, in weniger als einer Minute quantifizieren.
Instrumentierung und Methodik der Durchflusszytometrie
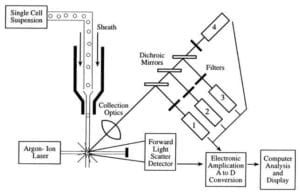 Durchflusszytometer nehmen eine Suspension monodisperser, einzelner, nicht verklumpter Zellen auf und führen sie einzeln (in einer Reihe) an einem Laserstrahl vorbei, wobei jede Zelle den Laserstrahl, das Streulicht und das Fluoreszenzlicht passiert und dann gezählt und sortiert oder weiter charakterisiert wird.
Durchflusszytometer nehmen eine Suspension monodisperser, einzelner, nicht verklumpter Zellen auf und führen sie einzeln (in einer Reihe) an einem Laserstrahl vorbei, wobei jede Zelle den Laserstrahl, das Streulicht und das Fluoreszenzlicht passiert und dann gezählt und sortiert oder weiter charakterisiert wird.
Die drei Hauptkomponenten eines Durchflusszytometers sind die Fluidik, die Optik und die Elektronik.
- Das Fluidiksystem eines Durchflusszytometers ist für den Transport der Proben vom Probenröhrchen zur Durchflusszelle, am Laser vorbei, sortiert und/oder verworfen verantwortlich.
- Die Komponenten des optischen Systems umfassen Anregungslichtquellen, Linsen und optische Filter, die verwendet werden, um die Wellenlängen des Lichts zu sammeln und im Gerät zu bewegen, sowie das Detektionssystem, das den Fotostrom erzeugt. Der Unterschied der Wellenlängenreaktion in den Daten hilft bei der Analyse des Zelltyps.
- Die Elektronik oder die Durchflusszytometer-Instrumentierung.
Eines der Hauptprinzipien bei der Verwendung der Durchflusszytometrie ist die Fähigkeit, den gesamten Zellzyklus zu analysieren und den DNA-Gehalt in verschiedenen Phasen zu untersuchen. Die Überwachung der natürlichen Ereignisse des Zellzyklus kann Informationen für die Krankheitsdiagnose und Therapieprognose liefern. Die verschiedenen Phasen des Zellzyklus können einen veränderten DNA-Gehalt und andere Anomalien aufzeigen, die auf das Vorhandensein eines Tumors oder Anzeichen eines fortgeschrittenen Zelltods hinweisen. Die Datenausdrücke werden über eine spezielle Durchflusszytometrie-Software, die mit dem gewählten Gerät verbunden ist, während der Analyse in einem Computer gespeichert. Durchflusszytometriedaten werden in der Regel auf zwei verschiedene Arten dargestellt: als Histogramm und/oder als Punktdiagramm2.
| G1 Phase: | RNA, Ribosomen und Proteine werden synthetisiert |
| S Phase: | DNA wird repliziert |
| G2 Phase: | Stellt die Phase zwischen der DNA-Synthese und der Mitose dar |
| M-Phase: | Zellen teilen sich in zwei Tochterzellen |
FACS
Fluoreszenz-aktivierte Zellsortierung (FACS) ist eine spezielle Art der Durchflusszytometrie. Es handelt sich um eine Methode zur Sortierung einer heterogenen Mischung biologischer Zellen in zwei oder mehr Behälter, eine Zelle nach der anderen, basierend auf den spezifischen Lichtstreuungs- und Fluoreszenzeigenschaften der einzelnen Zellen. Sie unterscheidet sich von der Durchflusszytometrie dadurch, dass sie eine eindeutige Charakterisierung im Gegensatz zum bloßen Zählen und Sortieren von Zellen liefert. Es ist üblich, dass die beiden Prinzipien in einem Co-Charakterisierungsprozess zusammenarbeiten, um einen vollständigen qualitativen und quantitativen Ansatz für die durchflusszytometrische Analyse zu bieten.
Der durchflusszytometrische Prozess:
Die Zellsuspension wird in der Mitte eines engen, schnell fließenden Flüssigkeitsstroms mitgerissen. Der Strom ist so angeordnet, dass ein großer Abstand zwischen den Zellen im Verhältnis zu ihrem Durchmesser besteht. Ein Vibrationsmechanismus zwingt den Zellstrom, in einzelne Tröpfchen zu zerfallen. Das System ist so eingestellt, dass die Wahrscheinlichkeit, dass mehr als eine Zelle pro Tröpfchen vorhanden ist, gering ist. Unmittelbar vor dem Aufbrechen des Stroms in Tröpfchen durchläuft der Strom eine Fluoreszenzmessstation, in der die interessierende Fluoreszenzeigenschaft der einzelnen Zellen gemessen wird.
Ein elektrischer Aufladungsring wird genau an der Stelle platziert, an der der Strom in Tröpfchen aufbricht. Auf der Grundlage der unmittelbar vorhergehenden Messung der Fluoreszenzintensität wird eine Ladung auf den Ring aufgebracht, und die entgegengesetzte Ladung wird auf dem Tröpfchen eingefangen, wenn es sich vom Strom löst. Die geladenen Tröpfchen fallen dann durch ein elektrostatisches Ablenksystem, das die Tröpfchen entsprechend ihrer Ladung in Behälter umleitet. Bei einigen Systemen wird die Ladung direkt auf den Strahl aufgebracht, und das abbrechende Tröpfchen behält eine Ladung mit demselben Vorzeichen wie der Strahl. Nach dem Abreißen des Tröpfchens wird der Strom wieder neutralisiert.
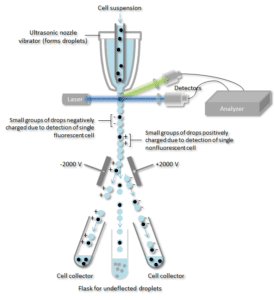
Ein für ein bestimmtes Zelloberflächenprotein spezifischer Antikörper wird mit einem fluoreszierenden Molekül assoziiert und dann zu einer Zellmischung gegeben. Der nächste Schritt ist der Fluoreszenzprozess, wobei die spezifischen Zellen durch einen Laserstrahl hindurchgehen und überwacht werden. Tröpfchen, die eine einzelne Zelle enthalten, werden positiv oder negativ geladen, je nachdem, ob die Zelle einen fluoreszenzmarkierten Antikörper trägt. Tröpfchen, die eine einzelne Zelle enthalten, werden dann durch ein elektrisches Feld detektiert und entsprechend ihrer Ladung in separate Sammelröhrchen umgeleitet, was eine einfache Trennung der mit dem fluoreszierenden Antikörper markierten Zellen ermöglicht.
Multicolor-Durchflusszytometrie
Die Multicolor-Durchflusszytometrie ist eine nützliche Technik zur Untersuchung gemischter Zellpopulationen, wie Blut- und Gewebezellen in menschlichen und tierischen Proben. Im Allgemeinen wird ein bestimmter Zelltyp mit einem Fluoreszenzfarbstoff (Marker) wie Fluorophor oder Propidiumiodid markiert. Die Möglichkeit, mehrere Fluoreszenzmarker gleichzeitig zu verwenden, ermöglicht die Identifizierung mehrerer Zelltypen sowie funktioneller Marker, die jede Probe weiter charakterisieren. Es gibt spezielle Geräte, die mehr als 12 Farben messen können 3,4 . Diese Fluoreszenzfarbstoffe und Marker werden durch verschiedene Wellenlängen des vom Laser emittierten Lichts gemessen, um die einzelnen Zelltypen zu unterscheiden. Jeder Marker wird bei einer bestimmten Wellenlänge des Lichts angeregt, um sie bei der Verwendung mehrerer Marker zu unterscheiden.
Die Anpassung eines typischen Färbepanels von 4 bis 6 Farben auf mehr als 12 Farben ist nicht einfach eine Frage von „Plug and Play“, sondern muss systematisch angegangen werden, um erfolgreiche Parameter in einem Färbepanel zu erreichen. Die Grundprinzipien der Plattengestaltung funktionieren am besten auf der Grundlage von Voruntersuchungen. Mit anderen Worten, die Vorbereitung ist der Schlüssel, sogar von Beginn an, wenn es darum geht, den Stain-Index im Hinblick auf eine effektive Abstimmung der Fluorochrome nach Helligkeit zu bestimmen5.
Flow Cytometry Tip:
Nehmen Sie sich etwas Zeit, um die feinen Nuancen Ihres Durchflusszytometers zu verstehen, bevor Sie Ihr primäres Antikörperpanel entwerfen. Konzentrieren Sie sich darauf, wo die empfindlichsten Messungen mit dem System durchgeführt werden können. Es geht um mehr als nur um die Fluoreszenzintensität.
Erwägen Sie, ein weniger helles Fluorochrom zu verwenden, um Kanalfehler zu vermeiden.
Gängige Anwendungen der Durchflusszytometrie-Methodik
Die Durchflusszytometrie ist ein integraler Bestandteil in verschiedenen klinischen Bereichen, einschließlich der Diagnose, der Behandlungspläne und der systemischen Erkrankungen, ob statisch oder fortschreitend. In dem Maße, wie wir mehr über die praktischen Anwendungen der Durchflusszytometrie erfahren, wird die Wissensbasis weiter ausgebaut. Die Forscher sind heute mehr denn je davon begeistert, dass sie mehr über die Komplexität bestimmter Krankheiten und Zustände erfahren können. Dies hat zu einem raschen Wandel bei der Diagnose von Mustern und zu drastisch veränderten medizinischen Ansätzen zur Behandlung von Krankheiten wie Krebs geführt6.
Die Methodik der Durchflusszytometrie wird häufig mit anderen umfassenden Testverfahren wie der morphologischen Untersuchung kombiniert. In vielen Fällen weisen hämatologische Neoplasmen spezifische morphologische Veränderungen auf, und die Durchflusszytometrie bietet eine größere Spezifität und hilft den Pathologen, Gewebeanomalien oder andere fortgeschrittene Krankheiten näher zu bestimmen. In einigen Fällen kann die Durchflusszytometrie das Wiederauftreten von Krebs vorhersagen, bevor morphologische Veränderungen festgestellt werden7.
Einige der wichtigsten Anwendungen, die in modernen klinischen Umgebungen sowohl therapeutisch als auch forschungsorientiert eingesetzt werden, sind:
- Proteinexpression – in der gesamten Zelle, sogar im Zellkern
- Proteinmodifikationen nach der Translation – einschließlich gespaltener und phosphorylierter Proteine
- RNA – einschließlich miRNA, und mRNA-Transkripte
- Zellgesundheitsstatus – Nachweis apoptotischer Zellen oder des Zelltods
- Zellzyklusstatus – ein leistungsfähiges Instrument zur Bewertung von Zellen in der G0/G1-Phase gegenüber der S-Phase, G2 oder Polyploidie, einschließlich der Analyse von Zellproliferation und -aktivierung
- Identifizierung und Charakterisierung verschiedener Zelluntergruppen in einer heterogenen Probe – einschließlich der Unterscheidung zentraler Effektor-Gedächtniszellen von erschöpften T-Zellen oder regulatorischen T-Zellen
Zusammenfassend
Die Grundprinzipien der Durchflusszytometrie haben sich in den letzten zehn Jahren kaum verändert, aber die Anwendungen dieser Technologie haben sich stark weiterentwickelt. Die Grundlagen der Durchflusszytometrie entsprechen ihrer Hauptfunktion, nämlich der Abfrage einzelner Zellen oder Partikel in einem Strom mit einem Laser, während sich die Zellen an einer Reihe von stationären Detektoren vorbeibewegen. Zunehmend werden mehr Fluoreszenzfarben von Zytometern detektiert, zusammen mit Hochgeschwindigkeitssortierung und analytischen Funktionen8.
Die Durchflusszytometrie spielt eine wesentliche Rolle in der molekularwissenschaftlichen Forschung und entwickelt sich in rasantem Tempo weiter. Es gibt mehrere kommerzielle Durchflusszytometer auf dem Markt. Sie arbeiten in der Regel nach dem gleichen Grundprinzip, aber es gibt wichtige Unterschiede im Design und in den Konzepten zur Ausrichtung und Integration anderer Komponenten.
In Kürze wird ein 3D-Instrumentarium eingeführt und in ein hybrides, von NanoCellect Biomedical hergestelltes Gerät, den WOLF Cell Sorter, integriert. Auch die Entwicklung von Fluoreszenzsonden mit schmalem Spektrum, die Integration molekularbiologischer Techniken in die Durchflusszytometrie und die Auswertung zellfreier Marker wie Zytokine werden Schlüsselkomponenten in der weiteren Entwicklung der Durchflusszytometrie-Analyse und der Zellassay-Technologie sein.
Quellen:
1 http://clinchem.aaccjnls.org/content/46/8/1221
2 https://pubmed.ncbi.nlm.nih.gov/18615596-flow-cytometry-histograms-transformations-resolution-and-display/
3 https://onlinelibrary.wiley.com/doi/full/10.1002/cyto.a.20959
4 https://currentprotocols.onlinelibrary.wiley.com/doi/abs/10.1002/cpim.26
5 https://www.nature.com/articles/nprot.2006.250
6 https://pubmed.ncbi.nlm.nih.gov/19967915-immunophenotypic-analysis-of-bone-marrow-b-lymphocyte-precursors-hematogones-by-flow-cytometry/
7 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4803461/
8 https://link.springer.com/protocol/10.1385/0-89603-150-0:543