Generischer Name: Fluocinonid
Dosierungsform: Gel
Medizinisch überprüft von Drugs.com. Zuletzt aktualisiert am 22. Juni 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professional
- Interaktionen
- Mehr
Rx Only
Der Markenname Lidex wurde in den U.Wenn generische Versionen dieses Produkts von der FDA zugelassen wurden, können generische Äquivalente verfügbar sein.
- Lidex Beschreibung
- Lidex – Klinische Pharmakologie
- Pharmakokinetik
- Indikationen und Anwendung von Lidex
- Kontraindikationen
- Vorsichtsmaßnahmen
- Allgemein
- Informationen für den Patienten
- Labortests
- Karzinogenese, Mutagenese und Beeinträchtigung der Fertilität
- Schwangerschaftskategorie C
- Stillende Mütter
- Anwendung in der Pädiatrie
- Nebenwirkungen
- Überdosierung
- Lidex Dosierung und Anwendung
- Wie wird Lidex geliefert
- Häufig gestellte Fragen
- Mehr über Lidex (Fluocinonid topisch)
- Verbraucherinformationen
- Fachinformationen
- Verwandte Behandlungsleitfäden
Lidex Beschreibung
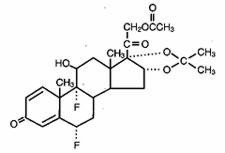
Lidex® (Fluocinonid) Gel 0,05% ist für die topische Anwendung bestimmt. Der Wirkstoff ist das Kortikosteroid Fluocinonid, das der 21-Acetat-Ester von Fluocinolonacetonid ist und die chemische Bezeichnung Pregna-1,4-dien-3,20-dion,21-(Acetyloxy)-6,9-difluor-11-hydroxy-16,17–,(6α,11β,16α)- trägt. Es hat die folgende chemische Struktur:
Lidex Gel enthält Fluocinonid 0,5 mg/g in einer speziell formulierten Gelgrundlage, die aus Carbomer 940, Edetat-Dinatrium, Popylgallat, Propylenglykol, Natriumhydroxid und/oder Salzsäure (zur Einstellung des pH-Werts) und Wasser (gereinigt) besteht. Dieses klare, farblose, thixotrope Vehikel ist fettfrei, nicht färbend und vollständig mit Wasser mischbar.
In dieser Formulierung liegt der Wirkstoff vollständig in Lösung vor.
Lidex – Klinische Pharmakologie
Topische Kortikosteroide haben eine entzündungshemmende, juckreizstillende und gefäßverengende Wirkung.
Der Mechanismus der entzündungshemmenden Wirkung der topischen Kortikosteroide ist unklar. Zum Vergleich und zur Vorhersage der Wirksamkeit und/oder der klinischen Wirksamkeit der topischen Kortikosteroide werden verschiedene Labormethoden, einschließlich Vasokonstriktor-Tests, eingesetzt. Es gibt einige Hinweise darauf, dass eine erkennbare Korrelation zwischen der vasokonstriktorischen Potenz und der therapeutischen Wirksamkeit beim Menschen besteht.
Pharmakokinetik
Das Ausmaß der perkutanen Absorption topischer Kortikosteroide wird von vielen Faktoren bestimmt, einschließlich des Vehikels, der Unversehrtheit der epidermalen Barriere und der Verwendung von Okklusivverbänden.
Topische Kortikosteroide können von normaler intakter Haut absorbiert werden. Entzündungen und/oder andere Krankheitsprozesse in der Haut erhöhen die perkutane Absorption. Okklusivverbände erhöhen die perkutane Absorption von topischen Kortikosteroiden erheblich. Daher können Okklusivverbände eine wertvolle therapeutische Ergänzung zur Behandlung resistenter Dermatosen sein (siehe DOSIERUNG UND ANWENDUNG).
Nach der Absorption durch die Haut werden topische Kortikosteroide über ähnliche pharmakokinetische Wege wie systemisch verabreichte Kortikosteroide verarbeitet. Kortikosteroide sind in unterschiedlichem Maße an Plasmaproteine gebunden. Kortikosteroide werden hauptsächlich in der Leber metabolisiert und dann über die Nieren ausgeschieden. Einige der topischen Kortikosteroide und ihre Metaboliten werden auch über die Galle ausgeschieden.
Indikationen und Anwendung von Lidex
Lidex Gel ist indiziert zur Linderung der entzündlichen und juckenden Manifestationen von Kortikosteroid-responsiven Dermatosen.
Kontraindikationen
Topische Kortikosteroide sind kontraindiziert bei Patienten mit einer Überempfindlichkeit gegen einen der Bestandteile des Präparates.
Vorsichtsmaßnahmen
Allgemein
Die systemische Absorption von topischen Kortikosteroiden hat bei einigen Patienten zu einer reversiblen Unterdrückung der Hypothalamus-Hypophysen-Nebennieren-Achse (HPA), Manifestationen des Cushing-Syndroms, Hyperglykämie und Glukosurie geführt.
Zu den Bedingungen, die die systemische Absorption verstärken, gehören die Anwendung stärker wirksamer Steroide, die großflächige Anwendung, die verlängerte Anwendung und das Anbringen von Okklusivverbänden.
Daher sollten Patienten, die eine hohe Dosis eines wirksamen topischen Steroids erhalten, das großflächig oder unter einem Okklusivverband angewendet wird, in regelmäßigen Abständen auf Anzeichen einer Unterdrückung der HPA-Achse untersucht werden, indem das freie Cortisol im Urin und der ACTH-Stimulationstest verwendet werden. Wird eine Suppression der HPA-Achse festgestellt, sollte versucht werden, das Medikament abzusetzen, die Häufigkeit der Anwendung zu verringern oder ein weniger starkes Steroid zu verwenden.
Die Funktion der HPA-Achse erholt sich in der Regel sofort und vollständig, wenn das Medikament abgesetzt wird. In seltenen Fällen können Anzeichen und Symptome eines Steroidentzugs auftreten, die zusätzliche systemische Kortikosteroide erfordern.
Kinder können proportional größere Mengen an topischen Kortikosteroiden aufnehmen und sind daher anfälliger für systemische Toxizität (siehe VORSICHTSMASSNAHMEN – Anwendung bei Kindern). Wenn eine Reizung auftritt, sollten die topischen Kortikosteroide abgesetzt und eine geeignete Therapie eingeleitet werden.
Wie bei jedem topischen Kortikosteroidprodukt kann es bei längerer Anwendung zu einer Atrophie der Haut und des Unterhautgewebes kommen. Bei Anwendung auf intertriginösen oder beugenden Bereichen oder im Gesicht kann dies auch bei kurzzeitiger Anwendung auftreten.
Beim Auftreten von dermatologischen Infektionen sollte die Anwendung eines geeigneten antimykotischen oder antibakteriellen Mittels eingeleitet werden. Wenn eine günstige Reaktion nicht sofort eintritt, sollte das Kortikosteroid abgesetzt werden, bis die Infektion ausreichend kontrolliert ist.
Informationen für den Patienten
Patienten, die topische Kortikosteroide anwenden, sollten die folgenden Informationen und Anweisungen erhalten:
- Dieses Medikament ist nach Anweisung des Arztes zu verwenden. Es ist nur zur äußerlichen Anwendung bestimmt. Vermeiden Sie den Kontakt mit den Augen.
- Die Patienten sollten darauf hingewiesen werden, dieses Medikament nicht für andere Erkrankungen als die, für die es verschrieben wurde, zu verwenden.
- Die behandelte Hautpartie sollte nicht bandagiert oder anderweitig abgedeckt oder eingewickelt werden, um okklusiv zu sein, es sei denn, der Arzt weist sie an.
- Patienten sollten alle Anzeichen lokaler unerwünschter Reaktionen melden, insbesondere unter Okklusivverbänden.
- Eltern pädiatrischer Patienten sollten darauf hingewiesen werden, keine eng anliegenden Windeln oder Plastikhosen an einem Kind zu verwenden, das im Windelbereich behandelt wird, da diese Kleidungsstücke Okklusivverbände darstellen können.
Labortests
Die folgenden Tests können bei der Beurteilung der HPA-Achsen-Suppression hilfreich sein:
Test auf freies Cortisol im Urin
ACTH-Stimulationstest
Karzinogenese, Mutagenese und Beeinträchtigung der Fertilität
Langzeitstudien an Tieren wurden nicht durchgeführt, um das karzinogene Potenzial oder die Auswirkungen auf die Fertilität von topischen Kortikosteroiden zu bewerten.
Studien zur Bestimmung der Mutagenität von Prednisolon und Hydrocortison haben negative Ergebnisse erbracht.
Schwangerschaftskategorie C
Kortikosteroide sind im Allgemeinen teratogen bei Labortieren, wenn sie in relativ niedrigen Dosierungen systemisch verabreicht werden. Die stärkeren Kortikosteroide haben sich nach dermaler Anwendung bei Labortieren als teratogen erwiesen. Es gibt keine angemessenen und gut kontrollierten Studien an schwangeren Frauen über teratogene Wirkungen von topisch angewendeten Kortikosteroiden. Daher sollten topische Kortikosteroide während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt. Arzneimittel dieser Klasse sollten bei schwangeren Patientinnen nicht extensiv, in großen Mengen oder über längere Zeiträume angewendet werden.
Stillende Mütter
Es ist nicht bekannt, ob die topische Verabreichung von Kortikosteroiden zu einer ausreichenden systemischen Absorption führen könnte, um nachweisbare Mengen in der Muttermilch zu erzeugen. Systemisch verabreichte Kortikosteroide werden in Mengen in die Muttermilch ausgeschieden, die wahrscheinlich keine schädliche Wirkung auf den Säugling haben. Dennoch ist Vorsicht geboten, wenn einer stillenden Frau topische Kortikosteroide verabreicht werden.
Anwendung in der Pädiatrie
Pädiatrische Patienten können eine größere Anfälligkeit für eine durch topische Kortikosteroide induzierte Unterdrückung der HPA-Achse und das Cushing-Syndrom aufweisen als erwachsene Patienten, da sie eine größere Hautoberfläche im Verhältnis zum Körpergewicht haben.
Suppression der Hypothalamus-Hypophysen-Nebennieren-Achse (HPA-Achse), Cushing-Syndrom und intrakranielle Hypertonie sind bei Kindern, die topische Kortikosteroide erhalten, berichtet worden. Zu den Manifestationen einer Nebennierensuppression bei Kindern gehören eine lineare Wachstumsretardierung, eine verzögerte Gewichtszunahme, niedrige Plasmakortisolspiegel und ein Ausbleiben der Reaktion auf eine ACTH-Stimulation. Zu den Manifestationen einer intrakraniellen Hypertonie gehören vorgewölbte Fontanellen, Kopfschmerzen und beidseitiges Papillenödem.
Die Verabreichung von topischen Kortikosteroiden an Kinder sollte auf die geringste Menge beschränkt werden, die mit einem wirksamen Therapieschema vereinbar ist. Eine chronische Kortikosteroidtherapie kann das Wachstum und die Entwicklung von Kindern beeinträchtigen.
Nebenwirkungen
Die folgenden lokalen Nebenwirkungen werden bei topischen Kortikosteroiden selten berichtet, können aber bei der Verwendung von Okklusivverbänden häufiger auftreten. Diese Reaktionen sind in einer ungefähren absteigenden Reihenfolge ihres Auftretens aufgeführt:
| Brennen | Periorale Dermatitis |
| Juckreiz | Allergische Kontaktdermatitis |
| Reizung | Mazeration der Haut |
| Trockenheit | Sekundärinfektion |
| Follikulitis | Hautatrophie |
| Hypertrichose | Striae |
| Akneiforme Eruptionen | Miliaria |
| Hypopigmentation |
Überdosierung
Topisch applizierte Kortikosteroide können in ausreichenden Mengen absorbiert werden, um systemische Wirkungen zu erzeugen (siehe VORSICHTSMASSNAHMEN).
Lidex Dosierung und Anwendung
Lidex Gel wird im Allgemeinen als dünner Film zwei- bis viermal täglich auf die betroffene Stelle aufgetragen, je nach Schwere der Erkrankung.
Okklusivverbände können zur Behandlung von Psoriasis oder rezidivierenden Zuständen verwendet werden.
Wenn sich eine Infektion entwickelt, sollte die Verwendung von Okklusivverbänden eingestellt und eine geeignete antimikrobielle Therapie eingeleitet werden.
Wie wird Lidex geliefert
Lidex® (Fluocinonid) Gel 0.05% wird geliefert in
15 g Tube – NDC 99207-507-13
30 g Tube – NDC 99207-507-14
60 g Tube – NDC 99207-507-17
Bei Raumtemperatur aufbewahren 15°-30°C (59°-86°F).
Hergestellt für:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
April 2001
IN-.5071/S
| Lidex Fluocinonid Gel |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
Etikettierer – MEDICIS
Häufig gestellte Fragen
- Wird es bei Haarausfall verwendet?
- Was ist ein Ersatz für Fluocinonid-Creme?
- Ist Fluocinonid eine antimykotische Creme?
- Wie lange sollten Sie Fluocinonid anwenden?
- Wofür ist Fluocinonid-Creme gut?
- Kann Fluocinonid zur Behandlung eines Giftefeu-Ausschlags verwendet werden?
- Ist es ein Steroid?
- Ist es ein Antibiotikum?
Mehr über Lidex (Fluocinonid topisch)
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungshinweise
- Wechselwirkungen
- 8 Bewertungen
- Verfügbarkeit der Generika
- Medikamentenklasse: Topische Steroide
Verbraucherinformationen
- Erweiterte Lektüre
- Lidex Mild (Erweiterte Lektüre)
- Lidex Regular (Erweiterte Lektüre)
Fachinformationen
- Verschreibungsinformationen
- Lidex Topical Solution (FDA)
- Lidex Salbe (FDA)
Andere Marken Vanos, Lidex-E
Verwandte Behandlungsleitfäden
- Atopische Dermatitis
- Ekzem
- Dermatitis
- Psoriasis
Medizinischer Haftungsausschluss