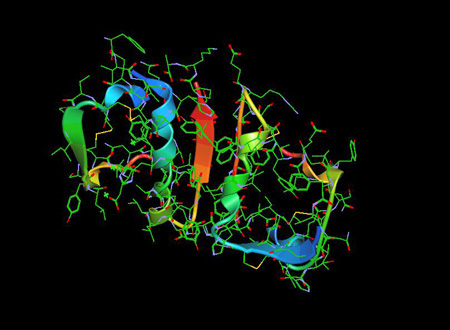
Das Insulinmolekül 1ZNI PDB ist ein Hormon der Bauchspeicheldrüse, das eine wesentliche Rolle bei der Regulierung des Blutzuckerspiegels sowie des Fett- und Kohlenhydratstoffwechsels spielt.
Für die 3D-Struktur des Insulinmoleküls mit Jsmol klicken Sie auf
Überblick
Insulin ist ein Polypeptidhormon, das von den β-Zellen der Bauchspeicheldrüse produziert wird und hauptsächlich für die Regulierung des Blutzuckerspiegels und die Speicherung von Kohlenhydraten und Lipiden verantwortlich ist. Typ-1-Diabetes ist auf eine unzureichende Insulinproduktion zurückzuführen, die durch die Zerstörung und den Verlust der insulinproduzierenden β-Zellen der Bauchspeicheldrüse verursacht wird. Typ-2-Diabetes ist auf eine relative Insulinresistenz zurückzuführen. Es gilt als das wichtigste anabole Hormon des Körpers. (1)
Proteinstruktur
Insulin wurde 1928 als Polypeptid entdeckt und seine Aminosäuresequenz 1952 identifiziert. Es handelt sich um ein Dipeptid, das aus einer A- und einer B-Kette besteht, die durch Disulfidbrücken miteinander verbunden sind. Es enthält 51 Aminosäuren und hat ein Molekulargewicht von 5802. Sein isoelektrischer Punkt liegt bei pH 5,5.5 Die A-Kette umfasst 21 Aminosäuren und die B-Kette 30 Aminosäuren. Die A-Kette hat eine N-terminale Helix, die mit einer antiparallelen C-terminalen Helix verbunden ist; die B-Kette hat ein zentrales helikales Segment. Die beiden Ketten sind durch zwei Disulfidbindungen verbunden, die die N- und C-terminalen Helices der A-Kette mit der zentralen Helix der B-Kette verbinden. Bei Pro-Insulin verbindet ein Verbindungspeptid den N-Terminus der A-Kette mit dem C-Terminus der B-Kette.
In den Wirbeltieren ist die Aminosäuresequenz von Insulin stark konserviert. Rinderinsulin unterscheidet sich vom menschlichen Insulin nur in drei Aminosäureresten, das Schweineinsulin in einem. Selbst das Insulin einiger Fischarten ist dem menschlichen Insulin ähnlich genug, um beim Menschen klinisch wirksam zu sein. Das Insulin einiger wirbelloser Tiere ist dem menschlichen Insulin in seiner Sequenz recht ähnlich und hat ähnliche physiologische Wirkungen. Die starke Homologie in der Insulinsequenz verschiedener Arten deutet darauf hin, dass sie über einen großen Teil der Evolutionsgeschichte der Tiere hinweg erhalten geblieben ist. Das C-Peptid des Proinsulins unterscheidet sich jedoch sehr viel stärker zwischen den Arten; es ist ebenfalls ein Hormon, allerdings ein sekundäres.
Insulin wird im Körper als Hexamer (eine Einheit aus sechs Insulinmolekülen) hergestellt und gespeichert, während die aktive Form das Monomer ist. Das Hexamer ist eine inaktive, langzeitstabile Form, die dazu dient, das hochreaktive Insulin geschützt, aber dennoch leicht verfügbar zu halten. Die Hexamer-Monomer-Umwandlung ist einer der zentralen Aspekte von Insulinformulierungen zur Injektion. Das Hexamer ist weitaus stabiler als das Monomer, was aus praktischen Gründen wünschenswert ist; das Monomer ist jedoch ein viel schneller reagierendes Medikament, da die Diffusionsrate umgekehrt zur Partikelgröße ist.
Mechanismen der Insulinsekretion
Insulin wird in der Bauchspeicheldrüse und im Brockmann-Körper (bei einigen Fischen) produziert und freigesetzt, wenn einer von mehreren Reizen erkannt wird. Zu diesen Reizen gehören aufgenommenes Eiweiß und Glukose im Blut, die aus verdauter Nahrung stammt. Kohlenhydrate können Polymere von Einfachzuckern oder die Einfachzucker selbst sein. Wenn die Kohlenhydrate Glukose enthalten, wird diese Glukose in den Blutkreislauf aufgenommen und der Blutzuckerspiegel beginnt zu steigen. In den Zielzellen löst Insulin eine Signalübertragung aus, die zu einer verstärkten Aufnahme und Speicherung von Glukose führt. Schließlich wird das Insulin abgebaut, wodurch die Reaktion beendet wird.
In Säugetieren wird Insulin in der Bauchspeicheldrüse in den Betazellen synthetisiert. Eine Million bis drei Millionen Pankreasinseln bilden den endokrinen Teil der Bauchspeicheldrüse, die in erster Linie eine exokrine Drüse ist. Der endokrine Teil macht nur 2 % der Gesamtmasse der Bauchspeicheldrüse aus. Innerhalb der Pankreasinseln machen die Betazellen 65-80 % aller Zellen aus.
Insulinfreisetzung
Blutzuckerregulierung Betazellen in den Langerhans-Inseln setzen Insulin in zwei Phasen frei. Die erste Phase wird als Reaktion auf einen erhöhten Blutzuckerspiegel rasch ausgelöst und dauert etwa 10 Minuten. Die zweite Phase ist eine anhaltende, langsame Freisetzung von neu gebildeten Bläschen, die unabhängig vom Zucker ausgelöst wird und in 2 bis 3 Stunden ihren Höhepunkt erreicht. Eine verminderte Insulinausschüttung in der ersten Phase kann der früheste nachweisbare Betazelldefekt sein, der das Auftreten von Typ-2-Diabetes vorhersagt. Die Freisetzung von Insulin in der ersten Phase und die Insulinsensitivität sind unabhängige Prädiktoren für Diabetes.
Blutinsulinspiegel
Der Blutinsulinspiegel kann in internationalen Einheiten wie µIU/mL oder in der molaren Konzentration wie pmol/L gemessen werden, wobei 1 µIU/mL 6,945 pmol/L entspricht. Ein typischer Blutspiegel zwischen den Mahlzeiten liegt bei 8-11 μIU/mL (57-79 pmol/L).
Wirkungsmechanismus – Signaltransduktion von Insulin
Signaltransduktion Die Wirkungen von Insulin werden durch seine Bindung an einen in der Zellmembran vorhandenen Rezeptor ausgelöst. Das Rezeptormolekül enthält eine α- und eine β-Untereinheit. Zwei Moleküle sind zu einem so genannten Homodimer verbunden. Insulin bindet an die α-Untereinheiten des Homodimers, das der extrazellulären Seite der Zellen zugewandt ist. Die β-Untereinheiten haben eine Tyrosinkinase-Enzymaktivität, die durch die Insulinbindung ausgelöst wird. Diese Aktivität provoziert die Autophosphorylierung der β-Untereinheiten und anschließend die Phosphorylierung von Proteinen innerhalb der Zelle, die als Insulinrezeptorsubstrate (IRS) bekannt sind. Die Phosphorylierung des IRS aktiviert eine Signaltransduktionskaskade, die zur Aktivierung anderer Kinasen sowie von Transkriptionsfaktoren führt, die die intrazellulären Wirkungen des Insulins vermitteln.
Wirkung des Insulins auf die Physiologie
Die Wirkungen des Insulins auf der globalen Ebene des menschlichen Stoffwechsels umfassen: Erhöhung der zellulären Aufnahme bestimmter Substanzen, vor allem von Glukose im Muskel- und Fettgewebe (etwa zwei Drittel der Körperzellen) Erhöhung der DNA-Replikation und der Proteinsynthese durch Kontrolle der Aminosäureaufnahme Modifikation der Aktivität zahlreicher Enzyme.
Regulator des Endocannabinoid-Stoffwechsels. Insulin ist ein wichtiger Regulator des Endocannabinoid-(EC)-Stoffwechsels, und es hat sich gezeigt, dass eine Insulinbehandlung zu einer Verringerung der intrazellulären ECs, des 2-Aarachidonylglycerols (2-AG) und des Anandamids (AEA) führt, was mit insulinsensitiven Expressionsänderungen in Enzymen des EC-Stoffwechsels korrespondiert. In insulinresistenten Adipozyten sind die Muster der insulininduzierten Enzymexpression in einer Weise gestört, die mit einer erhöhten EC-Synthese und einem verringerten EC-Abbau übereinstimmt. Die Ergebnisse deuten darauf hin, dass insulinresistente Adipozyten den EC-Stoffwechsel nicht regulieren und die intrazellulären EC-Spiegel als Reaktion auf die Insulinstimulation verringern, wodurch fettleibige insulinresistente Personen erhöhte EC-Konzentrationen aufweisen. Diese Dysregulation trägt zu einer übermäßigen Ansammlung von viszeralem Fett und einer verminderten Adiponektinfreisetzung aus dem Bauchfettgewebe bei, was wiederum zur Entstehung mehrerer kardiometabolischer Risikofaktoren beiträgt, die mit Fettleibigkeit und Typ-2-Diabetes in Verbindung gebracht werden.
1- Voet D, Voet JG (2011). Biochemistry (4th ed.). New York: Wiley.
2-Gisela Wilcox (2005) Insulin and Insulin Resistance, Clin Biochem Rev. 2005 May; 26(2): 19-39.
3- Rhoades RA, Bell DR (2009). Medizinische Physiologie : Grundlagen für die klinische Medizin (3. Aufl.). Philadelphia: Lippincott Williams & Wilkins. pp. 644-47.
4-Gerich JE (February 2002). „Ist eine verminderte Insulinausschüttung in der ersten Phase die früheste nachweisbare Anomalie bei Personen, die einen Typ-2-Diabetes entwickeln werden?“. Diabetes. 51 (Suppl 1): S117–21. doi:10.2337/diabetes.51.2007.s117. PMID 11815469.
5- Lorenzo C, Wagenknecht LE, Rewers MJ, Karter AJ, Bergman RN, Hanley AJ, Haffner SM (September 2010). „Dispositionsindex, Glukosewirksamkeit und Konversion zu Typ-2-Diabetes: die Insulinresistenz-Atherosklerose-Studie (IRAS)“. Diabetes
6- A Dictionary of Units of Measurement Archived 2013-10-28 at the Wayback Machine. Von Russ Rowlett, Universität von North Carolina in Chapel Hill. 13. Juni 2001
7- Iwase H, Kobayashi M, Nakajima M, Takatori T (Januar 2001). „Das Verhältnis von Insulin zu C-Peptid kann für die forensische Diagnose einer exogenen Insulinüberdosierung verwendet werden“. Forensic Science International. 115 (1-2): 123-27. doi:10.1016/S0379-0738(00)00298-X. PMID 11056282.
8- Xiang Z (Juni 2006). „Advances in homology protein structure modeling“. Current Protein & Peptide Science. 7 (3): 217-27. doi:10.2174/138920306777452312. PMC 1839925. PMID 16787261.
9- Zagrovic B, Snow CD, Shirts MR, Pande VS (November 2002). „Simulation of folding of a small alpha-helical protein in atomistic detail using worldwide-distributed computing“. Zeitschrift für Molekularbiologie. 323 (5): 927-37.
10-D’Eon TM, Pierce KA, Roix JJ, Tyler A, Chen H, Teixeira SR (Mai 2008). „The role of adipocyte insulin resistance in the pathogenesis of obesity-related elevations in endocannabinoids“. Diabetes. 57 (5): 1262-68.
11- Di Marzo V (August 2008). „The endocannabinoid system in obesity and type 2 diabetes“. Diabetologia. 51 (8): 1356-67. doi:10.1007/s00125-008-1048-2. PMID 18563385.