In dieser Reihe bietet Colin Baker von der Bedford School spektakuläre Demonstrationen, die die Phantasie der Schüler anregen sollen. Die Demonstrationen sind leicht vorzubereiten, sicher zu entsorgen und sie funktionieren.
Nichts prägt chemische Tatsachen so sehr in das Gedächtnis ein wie die Vorführung interessanter Experimente – Samuel Parkes, 1816
Im September 1931 berichtete der amerikanische Chemiker Wallace Carothers, der in den Laboratorien von DuPont arbeitete, über seine Forschungen zu „Riesenmolekülen“, die als Polymere bezeichnet wurden und auf einem Verständnis der chemischen Struktur von Wolle beruhten. Seine Arbeit konzentrierte sich auf eine Faser, die einfach „66“ genannt wurde, eine Zahl, die sich von ihrer Molekularstruktur ableitet. 1935 war Nylon, die „Wunderfaser“, geboren und ein großer Erfolg auf ihrem ersten Markt, den Damenstrümpfen. Als die USA im Dezember 1941 in den Zweiten Weltkrieg eintraten, wies das War Production Board die gesamte Nylonproduktion für militärische Zwecke zu, darunter Fallschirme und B29-Bomberreifen.

Quelle: Colin Baker
Die Reaktion zwischen Decandioyldichlorid und 1,6-Diaminohexan
Ein Disäurechlorid in einem organischen Lösungsmittel bildet eine nicht mischbare Schicht mit einem aliphatischen Diamin in Wasser. An der Grenzfläche, wo sich die beiden farblosen Lösungen treffen, bildet sich ein weißes, langkettiges Polymer. Dieser Polymerfilm kann von der Grenzfläche abgezogen werden und wird sofort ersetzt, wenn er entfernt wird. Hört man auf zu ziehen, scheint nichts zu passieren – die Reaktion stoppt, wird aber sofort wieder aufgenommen, wenn man erneut zu ziehen beginnt. Die Reaktion kann sich über mehrere Stunden hinziehen.

Quelle: Colin Baker
Kit
- Cyclohexan, 100cm3 (reizend, leicht entzündlich);
- Decandioyldichlorid, 5.0cm3;
- Destilliertes Wasser, 100cm3;
- Wasserfreies Natriumcarbonat, 10g;
- 1,6-Diaminohexan, 5,0g;
- Zwei Bechergläser, 250cm3;
- Becherglas, 5cm3;
- Pinzette;
- Glasstäbe.
Sicherheit
Decandioyl-Dichlorid und 1,6-Diaminohexan sind ätzend. Sie sind gesundheitsschädlich beim Verschlucken oder Einatmen und verursachen bei Berührung mit der Haut Verätzungen. Sie sind starke Reizstoffe. Cyclohexan ist leicht entzündlich und reizend.
Vorgehensweise
Bereiten Sie die folgenden zwei Lösungen vor:
Lösung A: Decandioyldichlorid in Cyclohexan. Gib 100cm3 Cyclohexan in ein 250cm3 Becherglas, füge 5,0cm3 Decandioyldichlorid hinzu und rühre, bis es sich auflöst. Diese Lösung ist etwa vier Wochen haltbar.
Lösung B: 1,6-Diaminohexan in wässrigem Natriumcarbonat. Gib 100cm3 destilliertes Wasser in ein 250cm3 Becherglas, füge 10g wasserfreies Natriumcarbonat hinzu und rühre, bis es sich auflöst. Füge 5,0 g festes 1,6-Diaminohexan hinzu und rühre, bis es sich auflöst.
Gieße 2cm3 Lösung A in ein 5cm3 Becherglas. Füge vorsichtig ein gleiches Volumen von Lösung B hinzu. Lösung A enthält das organische Lösungsmittel, ist dichter als die wässrige Schicht und ist daher die untere Schicht. Greife den Polyamidfilm (ein weißer Feststoff), der sich an der Grenzfläche der beiden Lösungen zu bilden beginnt, mit einer Pinzette und ziehe ihn langsam aus dem Becherglas. Wickle die Faser um einen Glasstab und ziehe weiter. Halte den Vorgang an, wenn einer der Reaktanten verbraucht ist.
Besondere Hinweise
Bei der Zugabe der zweiten Lösung ist Vorsicht geboten, um ein Vermischen zu vermeiden. Demonstrieren Sie, wie die Faser in einem durchgehenden Faden herausgezogen werden kann, und veranstalten Sie dann einen Wettbewerb, um zu sehen, welches Schülerpaar die längste Faser herstellen kann. Sie sollten in der Lage sein, bis zu 5 m zu produzieren, bevor die Faser reißt. Schnell werden sie erkennen, dass sie Hilfe brauchen, um die Faser zu stützen – ich teile die Klasse in zwei große Gruppen auf, die jeweils mit Glasstäben bewaffnet sind. Meine Schüler haben schon Fasern von über 30 m Länge hergestellt und sogar versucht, um Ecken zu gehen. Sie müssen das maximale Volumen jeder Lösung auf 10 cm3 begrenzen. Die Schüler müssen Handschuhe tragen und den Kontakt mit den Fasern vermeiden. Wenn die Faser reißt, sollte sie in saugfähiges Papier eingewickelt werden. Verschüttetes Material sollte mit saugfähigem Papier aufgewischt und in den Abfall gegeben werden.
Lernziele
Polyamide sind Polymere, bei denen die sich wiederholenden Einheiten durch Amidbindungen, -CO-NH-, zusammengehalten werden.
Nylon-6,10
Nylon-6,10 wird aus zwei Monomeren hergestellt, von denen eines sechs Kohlenstoffatome enthält, das andere 10 – daher der Name. Das Monomer mit 10 Kohlenstoffatomen ist Decandioyldichlorid (ClOC(CH2)8 COCl), ein Säurechlorid mit einer -COCl-Gruppe an jedem Ende. Das andere Monomer ist eine Sechs-Kohlenstoff-Kette mit einer Aminogruppe, -NH2, an jedem Ende. Dabei handelt es sich um 1,6-Diaminohexan (H2 N(CH2)6 NH2, auch bekannt als Hexan-1,6-diamin).
Bei der Polymerisation dieser beiden Verbindungen verbinden sich die Amin- und Säuregruppen, wobei jeweils ein Molekül Chlorwasserstoff verloren geht:
n ClOC-(CH2)8-COCl + n H2N-(CH2)6-NH2 → -(CO-(CH2)8-CONH-(CH2)6-NH)n – + n HCl
Dieser polymerbildende Prozess, bei dem ein kleines Molekül verloren geht, wird als Kondensationspolymerisation bezeichnet.
Nylon-6,6
Dieses Polymer wird durch Kondensation zweier Moleküle mit sechs Kohlenstoffatomen, Hexandisäure und 1,6-Diaminohexan, hergestellt. In der Industrie wird Cyclohexan zur Herstellung beider Monomere verwendet. Wenn Cyclohexan oxidiert wird, öffnet sich der Ring und beide Enden der Kette tragen eine Säuregruppe – es entsteht Hexandisäure. Wird diese Säure mit Ammoniak neutralisiert, entsteht das Diammoniumsalz (NH4 OOCCH2 CH2 CH2 CH2 COONH4), das dehydratisiert (durch Erhitzen auf 350°C) und (mit H2/Ni) zu 1,6-Diaminohexan reduziert werden kann. Die Kondensationspolymerisation der Disäure und des Diamins erfolgt unter Wasserverlust:
n HOOC-(CH2)4 -COOH + n H2 N-(CH2)6 -NH2 → -(CO-(CH2)4 -CONH-(CH2)6 -NH)n – + n H2 O
Nylon-6
Aus dem Einzelmonomer Caprolactam (Hexahydro-2H-Azepin-2-on, 1) lässt sich Nylon herstellen.
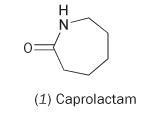
Caprolactam enthält eine interne Amidbindung. Die Polymerisation dieses Moleküls führt zu einer Ringöffnung und einer Verbindung zu einer kontinuierlichen Kette:
-(NH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CO)n –
Nylon hat die Textilindustrie revolutioniert und war der Vorläufer für viele der heutigen modernen Kunstfasern. Es ist nach wie vor ein wichtiges und weit verbreitetes Material in der Fertigung.