Der Nutzen und die Bedeutung von Zellen und Batterien sind unbestreitbar. In unserem alltäglichen Leben verwenden wir Zellen auf so viele verschiedene Arten. In den vergangenen Konzepten haben wir Sie bereits mit Batterien im Allgemeinen bekannt gemacht. Hier werden wir jedoch eine eingehende Analyse der galvanischen Zellen vornehmen. Also, lasst uns anfangen.
Vorgeschlagene Videos
Galvanische Zellen
Eine galvanische Zelle ist eine Art von elektrochemischer Zelle. Sie wird verwendet, um elektrischen Strom zu liefern, indem man den Transfer von Elektronen durch eine Redoxreaktion durchführt. Eine galvanische Zelle ist ein Beispiel dafür, wie Energie durch einfache Reaktionen zwischen einigen wenigen Elementen nutzbar gemacht werden kann. Es ist erstaunlich zu untersuchen, wie eine galvanische Zelle aufgebaut und zur Energiegewinnung genutzt werden kann.
Eine galvanische Zelle ist ein Gerät, in dem gleichzeitig Oxidations- und Reduktionsreaktionen stattfinden. Diese Reaktionen dienen dazu, die chemische Energie in elektrische Energie umzuwandeln, die für beliebige kommerzielle Zwecke genutzt werden kann.
Weitere Themen unter Elektrochemie
- Batterien
- Leitfähigkeit von elektrolytischen Lösungen
- Korrosion
- Elektrochemische Zellen
- Elektrolytische Zellen und Elektrolyse
- Brennstoffzellen
- Nernstsche Gleichung
- Änderung der Leitfähigkeit und der molaren Leitfähigkeit mit der Konzentration
Arbeitsweise von galvanischen Zellen

Die Funktionsweise einer galvanischen Zelle ist recht einfach. Es handelt sich um eine chemische Reaktion, die als Endresultat elektrische Energie zur Verfügung stellt. Während einer Redoxreaktion nutzt eine galvanische Zelle den Energietransfer zwischen Elektronen, um chemische Energie in elektrische Energie umzuwandeln.
Die galvanische Zelle nutzt die Fähigkeit, den Elektronenfluss im Prozess der Oxidation und der Reduktion zu trennen, indem sie eine Halbreaktion hervorruft und beide mit einem Draht verbindet, so dass ein Pfad für den Elektronenfluss durch diesen Draht gebildet werden kann. Dieser Elektronenfluss wird im Wesentlichen als Strom bezeichnet. Ein solcher Strom kann durch einen Draht fließen, um einen Stromkreis zu schließen und seine Leistung in einem Gerät wie einem Fernseher oder einer Uhr zu erhalten.
Eine galvanische Zelle kann aus zwei beliebigen Metallen hergestellt werden. Diese beiden Metalle können die Anode und die Kathode bilden, wenn sie miteinander in Kontakt stehen. Diese Kombination ermöglicht die galvanische Korrosion desjenigen Metalls, das anodischer ist. Damit diese Korrosion stattfinden kann, ist ein Verbindungskreislauf erforderlich.
Aufbau einer galvanischen Zelle
Um eine galvanische Zelle herzustellen, muss man den folgenden Aufbau durchführen. Die Zelle besteht idealerweise aus zwei Elektroden. Eine dieser Elektroden, die Kathode, ist eine positiv geladene Elektrode, während die andere, die Anode, eine negativ geladene Elektrode ist.
Diese beiden Elektroden bilden die beiden wesentlichen Bestandteile der galvanischen Zelle. Die chemische Reaktion, die mit der Reduktion zusammenhängt, findet an der Kathode statt, während die Oxidations-Halbreaktion an der Anode abläuft. Wie bereits erwähnt, können zwei beliebige Metalle für die chemische Reaktion verwendet werden.
Verständnis der galvanischen Zelle anhand eines Beispiels
Lassen Sie uns ein Beispiel nehmen, bei dem die beiden an der chemischen Reaktion beteiligten Metalle Zink und Kupfer sind. Während der chemischen Reaktion würde Zink zwei Elektronen verlieren. Diese werden von Kupfer aufgenommen und werden zu elementarem Kupfer. Da sich die beiden Metalle in zwei getrennten Behältern befinden und durch einen Leitungsdraht verbunden sind, bildet sich ein elektrischer Strom, der alle Elektronen von einem Metall auf das andere überträgt.
Zur gleichen Zeit werden die beiden Metalle in eine Salzlösung getaucht, in diesem Fall Zinksulfat und Kupfersulfat. In diesem Fall werden die beiden Lösungen nicht direkt miteinander vermischt, sondern können durch eine Brücke oder ein Medium verbunden werden. Dieses Medium ist für den Transfer der Ionen verantwortlich, sorgt aber auch dafür, dass sich die beiden Lösungen nicht miteinander vermischen.
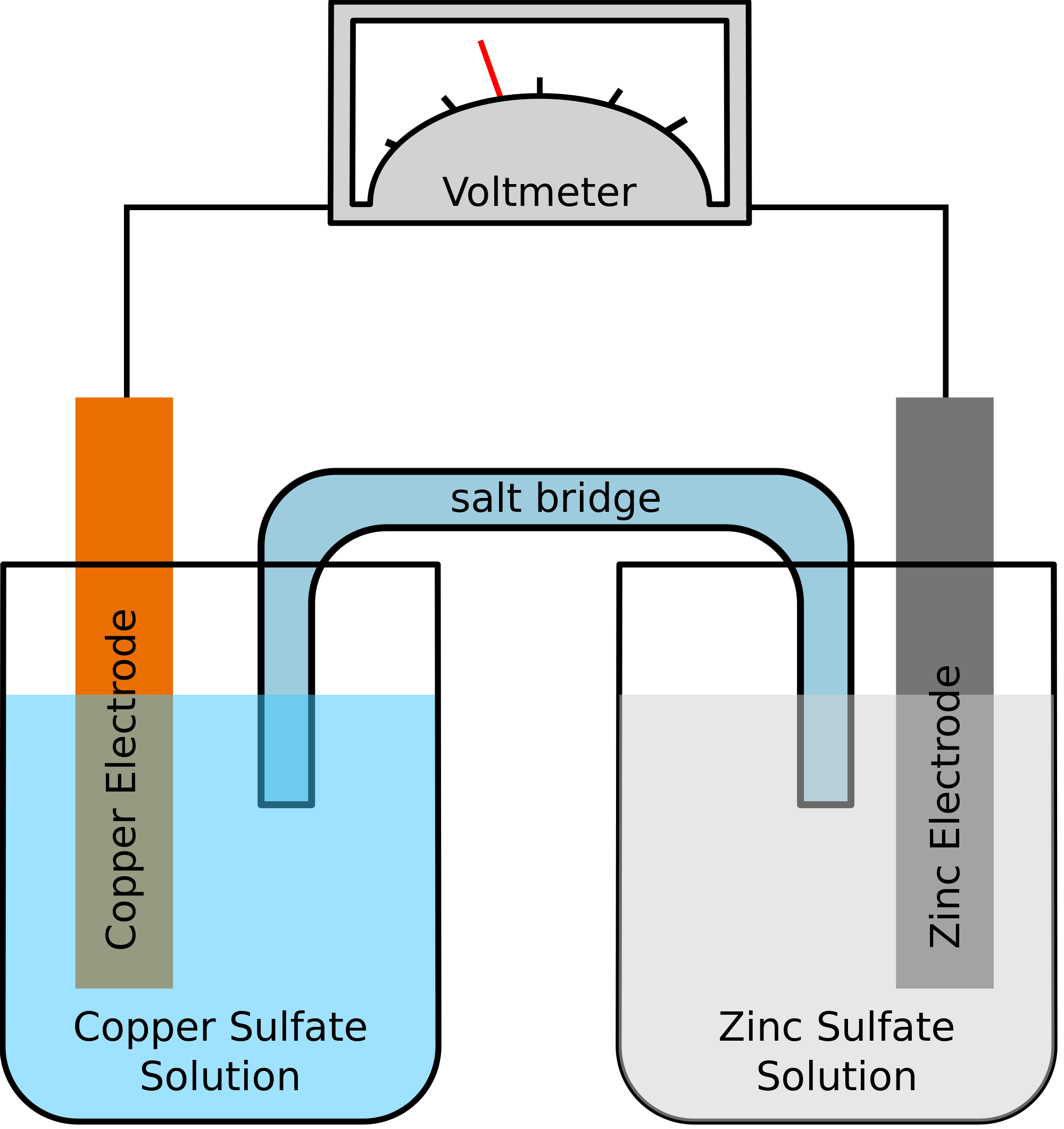
Eine solche Brücke hilft, den Stromkreis für den Transport der elektrischen Ladung zu schließen und sorgt auch dafür, dass die Lösungen in den Behältern mit den Metallen neutral bleiben und sich nicht miteinander vermischen. Solange die Salzbrücke die Redoxreaktion, bei der Oxidation und Reduktion stattfinden, nicht stört, spielt es keine Rolle, welche Salzbrücke bei der chemischen Reaktion verwendet wird.
Einige wichtige Begriffe
Einige der wichtigen Begriffe, die in einer galvanischen Zelle verwendet werden, sind im Folgenden aufgeführt:
- Phasengrenzen: Sie bezieht sich auf die beiden Metalle, die als Kathode und Anode fungieren.
- Salzbrücke: Die Verbindungsbrücke oder das Medium, das eine Redoxreaktion ermöglicht.
- Oxidation und Reduktion: Die chemischen Prozesse, die die Bildung und den Fluss des elektrischen Stroms in einer galvanischen Zelle ermöglichen.
Gelöste Beispiele für Sie
Frage: Was passiert in einer galvanischen Zelle, wenn keine Salzbrücke verwendet wird, während die Redoxreaktion abläuft?
Lösung: Ohne eine Salzbrücke in jedem Behälter, der die Metalle enthält, würde die Redoxreaktion auf die gleiche Weise beginnen. Aber ohne die Salzbrücke würde sie ziemlich abrupt enden. Die jeweiligen Lösungen wären nicht in der Lage, ihre elektrische Neutralität aufrechtzuerhalten. Abgesehen davon gibt es keine Veränderung in der chemischen Reaktion oder irgendeine Art von Veränderung aufgrund des Fehlens der Salzbrücke oder des Mediums.