General Overview
Ein großer Teil der Mikroorganismen befindet sich nicht nur in uns, sondern lebt auch auf uns. Tatsächlich beherbergt die menschliche Haut eine heterogene Mischung aus meist nicht-pathogenen Bakterien, Pilzen und Viren, die wahrscheinlich zur Gesundheit der Hautoberfläche beitragen (Abbildung 1). Propionibacterium acnes (P. acnes) ist eine ubiquitär vorkommende, langsam wachsende, stäbchenförmige, nicht sporenbildende, grampositive Anaerobie (Abbildung 2), die an allen Körperstellen zu finden ist, einschließlich der Talgdrüsenfollikel im Gesicht und am Hals (Funke et al., 1997; Grice und Segre, 2011; Findley und Grice, 2014). Sie wird häufig als Teil unserer kommensalen Mikrobiota an Barrierestellen betrachtet (Cogen et al., 2008), die durch Mechanismen der adaptiven Immuntoleranz während der frühen Neugeborenenperiode etabliert wird (Scharschmidt et al., 2015). Obwohl die topografische Verteilung der Anaerobier in den Talgdrüsen signifikant ist, ist die räumliche und personelle Verteilung von P. acnes eher individual- als ortsspezifisch (Oh et al., 2014). Darüber hinaus ist die Biogeografie und Individualität von P. acnes sehr dynamisch, da Veränderungen des Gesundheitszustands oder Veränderungen des pH-Werts, der Temperatur, der Feuchtigkeit und/oder des Talggehalts auch das Spektrum der von dem Mikroorganismus besetzten Nischen beeinflussen können (Grice et al., 2009). Ähnlich wie die Verteilung der Hautmikroben können auch die Hautbedingungen die Funktion von P. acnes im Hinblick auf die Ausbreitung des Erregers bei Krankheiten beeinflussen. So wurde P. acnes beispielsweise mit Hauterkrankungen wie Akne vulgaris im Gesicht und am Hals sowie progressiver makulärer Hypermelanose auf dem Rücken in Verbindung gebracht (Bojar und Holland, 2004; Kurokawa et al., 2009; Barnard et al., 2016). Darüber hinaus sind bestimmte krankheitsassoziierte Phylotypen von P. acnes in der Lage, auf Körperimplantaten und chirurgischen Geräten zu persistieren und ein breites Spektrum postoperativer Infektionskrankheiten wie Endokarditis, Endophthalmitis und Infektionen des intravaskulären Nervensystems zu verursachen (Perry und Lambert, 2011; Portillo et al., 2013). Die unerwünschten Eigenschaften von P. acnes erstrecken sich auch auf die Prostata, wo häufig eine Gewebsinvasion und intrazelluläre Ablagerung des Bakteriums in Drüsenepithelzellen und zirkulierenden Makrophagen festgestellt wurde; ein Phänomen, von dem man annimmt, dass es indirekt zur gutartigen Prostatahyperplasie (BPH) und zum Prostatakrebs beiträgt (Tanabe et al., 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016). Es ist jedoch nicht klar, welche Mechanismen P. acnes zugrunde liegen, um eine Infektion, Entzündung und/oder Metastasierung außerhalb der Haut auszulösen. Mit einiger Sicherheit ist bekannt, dass bakterieninfizierte Keratinozyten, Sebozyten und/oder Adipozyten mehrere proinflammatorische Chemokine und Zytokine sowie antimikrobielle Faktoren (z. B., Cathelicidin), die auf spezifische Krankheitsmechanismen hinweisen (Graham et al., 2004; Nagy et al., 2006; Lee et al., 2010; Zhou et al., 2015; Sanford et al., 2016; Yu et al., 2016).
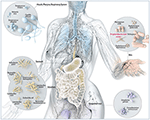
Abbildung 1. Schematische Darstellung häufiger Mikroben, die an Barrierestellen beim Menschen vorkommen, einschließlich P. acnes. Während P. acnes auf allen äußeren und inneren Oberflächen vorkommt (d. h. Mund- und Magen-Darm-Epithelien, Bindehaut), ist es auf der menschlichen Haut am weitesten verbreitet. Dort befindet er sich in den Haarfollikeln von Gesicht und Rücken, wo er mit der weit verbreiteten Hautkrankheit Akne vulgaris in Verbindung gebracht wird. In den meisten Fällen wird P. acnes immer noch als ein meist gutartiger und kommensaler Mikroorganismus angesehen, jedoch mehren sich die Berichte über seine bösartige opportunistische Seite. Angepasst und mit freundlicher Genehmigung von Bryan Christie Design (http://bryanchristiedesign.com/).
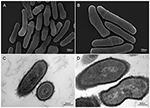
Abbildung 2. Rasterelektronenmikroskopische und Transmissionselektronenmikroskopische (SEM und TEM) Aufnahmen von P. acnes Stamm KPA (A, B = SEM; C, D = TEM). Jüngste Fortschritte bei Isolierungs- und Kultivierungstechniken zeigen, dass P. acnes-Infektionen bisher stark unterschätzt wurden und werfen ein neues Licht auf diese opportunistische Bakterienart. Mikroskopie von Volker Brinkmann, Max-Planck-Institut für Infektionsbiologie, Berlin, Deutschland. Skalenbalken = 200/300nm.
Sarkoidose
Sarkoidose ist eine Krankheit unbekannter Ätiologie, die zu Entzündungen in so unterschiedlichen Organen wie Lunge, Leber, Haut und Lymphgefäßen führt. Ein mutmaßlicher Zusammenhang zwischen Sarkoidose und P. acnes wurde erstmals vorgeschlagen, als das Bakterium aus sarkoidalen Läsionen der Haut und Lymphknoten isoliert wurde (Eishi et al., 2002; Yamada et al., 2002). Diese Ergebnisse wurden in erheblichem Maße bestätigt (de Brouwer et al., 2015) und durch verschiedene In-vitro-Experimente erweitert, die die Invasionsfähigkeit von P. acnes in HEK293T- (humane embryonale Niere) und A549- (humanes alveoläres Epithelkarzinom) Zelllinien zeigten (Tanabe et al., 2006). Jüngste Arbeiten an sarkoidaler broncho-alveolärer Lavageflüssigkeit (BAL) und Zellen zeigten eine signifikante Hochregulierung einer P. acnes-spezifischen Immunantwort (Schupp et al., 2015). Darüber hinaus haben Experimente an Mäusen gezeigt, dass lebensfähige P. acnes Lungengranulome induzieren können, die den bei Sarkoidosepatienten beobachteten Granulomen ähneln (Werner et al., 2017). Einen allgemeinen Überblick über den Zusammenhang zwischen Sarkoidose und P. acnes gibt Eishi (2013).
Studien, die versuchten, die durch P. acnes während der Infektion aktivierten Signalwege zu charakterisieren, zeigten, dass der Nuklearfaktor-kappaB , ein Transkriptionsfaktor, der die Expression von Genen reguliert, die an Immun- und Entzündungskaskaden beteiligt sind, durch P. acnes aktiviert wird (Kim et al., 2002). Im weiteren Sinne hat sich der Toll-like-Rezeptor 2 (TLR2) als kritischer Rezeptor für die NF-κB-abhängige Reaktion auf P. acnes erwiesen und die Fähigkeit dieses Bakteriums aufgezeigt, die selektive Aktivierung von Genen der angeborenen Immunität auszulösen (Inohara und Nuñez, 2001; Chamaillard et al., 2003; Moreira und Zamboni, 2012). Darüber hinaus wurde die Rolle der Wirtsgenetik bei Sarkoidosefällen untersucht, die mit einer P. acnes-Infektion in Verbindung gebracht wurden. Einzelnukleotid-Polymorphismen (SNPs) in der Nukleotid-bindenden Oligomerisierungsdomäne (NOD) der Proteine NOD1 und NOD2 wurden bei 73 Sarkoidosepatienten mit 52 interstitiellen Lungenentzündungen und 215 gesunden Kontrollpersonen mit einer P. acnes-Infektion in Verbindung gebracht (Tanabe et al., 2006). NOD1 und NOD2 sind intrazelluläre Mustererkennungsrezeptoren, die bakterielle Moleküle wie z. B. Peptidoglykanbestandteile erkennen können. In diesem Sinne haben In-vitro-Experimente gezeigt, dass die Internalisierung von P. acnes in HEK293T-Zellen zu einer Aktivierung von NOD1 und NOD2 führen kann, was auf einen Krankheitsmechanismus hinweist, der auf chronischer Entzündung oder lokaler Immunsuppression beruht (Tanabe et al., 2006). Diese Ergebnisse deuten auch darauf hin, dass invasive P. acnes als bakterielle Liganden fungieren können, um eine abweichende NOD-Rezeptoraktivierung bei bestimmten Personen mit lang anhaltender Anfälligkeit für Sarkoidose zu verursachen. Zukünftige Experimente müssen jedoch den genauen zeitlichen Ablauf klären, ob oder wie die durch P. acnes vermittelte aberrante NF-κB-Aktivierung die Granulombildung in einer NOD1/NOD2-abhängigen Weise induzieren kann.
Obwohl invasive P. acnes eine mögliche Ätiologie der Sarkoidose und vielleicht auch anderer Krankheiten sein könnten, ist die Klärung der Kausalität und des Zusammenhangs zwischen P. acnes-Infektion und Pathologie ist unklar, da die Heterogenität des Bakterienstamms, die Genetik des Wirts sowie die Umgebung des Wirts berücksichtigt werden müssen, wenn eine Studie das Mikrobiom mit einem Krankheitszustand in Verbindung bringt.
Benigne Prostatahyperplasie (BPH) und Prostatakrebs
Chronische oder wiederkehrende Entzündungsprozesse werden seit langem mit dem Fortschreiten von BPH und Prostatakrebs in Verbindung gebracht (De Marzo et al., 1999; Nelson et al., 2004; Sfanos et al., 2014). Entzündungen werden mit dem Vorhandensein spezifischer Biomarker wie erhöhtem Interleukin (IL)-6, Tumor-Nekrose-Faktor alpha (TNFα) und dem Akute-Phase-Protein, C-reaktives Protein, in Verbindung gebracht (Mechergui et al., 2009; Menschikowski et al., 2013; Yu et al., 2015). Jüngste Arbeiten an urologischen Flüssigkeiten (d. h. Urin, Samenflüssigkeit, Prostatasekret) sowie Prostatabiopsien deuten auf eine signifikante bedingte Verschiebung in Richtung bestimmter mikrobieller Spezies hin, die als diagnostischer Index verwendet werden können (Yu et al., 2015; Ni et al, 2016).
Zahlreiche Arbeiten deuten darauf hin, dass die spezifische Assoziation von P. acnes mit der Prostata und insbesondere die Invasion von Prostataepithelzellen (Abbildung 3) zur Pathologie von BPH oder Prostatakrebs mit einer entzündlichen Komponente beitragen kann (Sfanos et al., 2013; Davidsson et al., 2016). Allerdings ist derzeit unklar, ob P. acnes ein echter Infektionserreger der Prostata, ein Kommensale oder ein zufälliges Prostatamikrobiom darstellt. Es ist plausibel, dass in der Prostata lokalisierte P. acnes von der Haut stammen, die beispielsweise während einer Prostatabiopsie versehentlich eingeschleppt werden – ein Gesichtspunkt, der bei bestimmten diagnostischen Aufbereitungsszenarien Bedenken aufkommen lassen sollte.
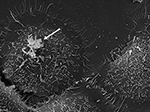
Abbildung 3. SEM von P. acnes Stamm P6 (Pfeil) in vitro auf kultivierten Prostata-Epithelzellen RWPE1. Das invasive Verhalten von P. acnes auf Prostataepithelzellen ist sowohl in in vivo als auch in zellbasierten Studien gut dokumentiert, wobei ein Vimentin-vermittelter Invasionsprozess wahrscheinlich ist (Mak et al., 2012). Mikroskopie von Volker Brinkmann, Max-Planck-Institut für Infektionsbiologie, Berlin, Deutschland. Maßstabsbalken = 2 μm.
Ungeachtet des Eintrittsweges oder des pathogenen Potenzials wurde eine beträchtliche Anzahl von Prostatageweben, die durch transurethrale Resektion für BPH oder radikale Prostatektomie für Krebs gewonnen wurden, zuvor positiv auf P. acnes-Aggregate getestet, die sich offenbar in umherwandernden Makrophagen befinden (Alexeyev et al., 2007; Bae et al., 2014). Weitere Berichte, die sich auf menschliche Proben stützen, haben weitere Beweise für einen Zusammenhang zwischen BPH oder Prostatakrebs und P. acnes geliefert, wobei verschiedene technische Ansätze verwendet wurden, darunter Kultivierung, konfokale Mikroskopie zur Visualisierung des Bakteriums und In-situ-Hybridisierung, Immunhistochemie (Abbildung 4) und PCR-basiertes Profiling der bakteriellen 16S rRNA (Hochreiter et al., 2000; Cohen et al., 2005; Sfanos et al., 2008; Fassi-Fehri et al., 2011; Bae et al., 2014; Davidsson et al., 2016). Weitere Belege stammen aus Tierstudien, die zeigen, dass die Inokulation von P. acnes in die Prostata und Blase von Mäusen oder Ratten zu einer offenen, langfristigen Entzündungsreaktion und einer Vielzahl von Zellstörungen innerhalb der Prostata führt (Olsson et al., 2012; Shinohara et al., 2013).
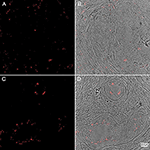
Abbildung 4. Immunhistochemie menschlicher Prostatagewebeproben, gefärbt mit P. acnes-Antikörper (rot). Adaptiert mit Genehmigung von Fassi-Fehri et al., 2011 (ergänzende Abbildung 2B). Vorhandensein von P. acnes in menschlichen Prostatagewebeproben mit gutartiger Prostatahyperplasie (A, B) oder Adenokarzinom (C, D). In beiden Fällen wurde eine hohe bakterielle Belastung festgestellt.
Versuche, krankheitsassoziierte P. acnes-Stämme aus kanzerösen Prostatadrüsen phylogenetisch zu analysieren, haben ergeben, dass die meisten Prostata-Isolate zu phylogenetischen Kladen gehören, die auf der menschlichen Haut selten sind, was darauf hindeutet, dass eine Kontamination durch die Haut während der Probenahme unwahrscheinlich ist (Mak et al., 2013; Davidsson et al., 2016). In diesem Sinne scheinen ähnliche Entzündungswege wie die für Sarkoidose beschriebenen, einschließlich NF-κB, IL-6, STAT3 und COX2, durch P. acnes sowohl unter in situ- als auch unter in vitro-Bedingungen aktiviert zu werden (Drott et al., 2010; Fassi-Fehri et al., 2011; Mak et al., 2013; Tsai et al., 2013; Bae et al., 2014). Obwohl die genaue Ätiologie für diese entzündlichen Veränderungen noch nicht klar ist, sind mehrere membrangebundene Mustererkennungsrezeptoren im Harn- und Genitalsystem von Säugetieren weit verbreitet, die bakterielle und virale Komponenten eifrig erkennen (Jorgensen und Seed, 2012; Gambara et al., 2013). Diese Wirtszellrezeptoren, z. B. TLRs, fördern die Zytokinproduktion, die ein zentrales Merkmal der angeborenen Immunität gegen mikrobielle Krankheitserreger ist. Insgesamt deuten diese Befunde darauf hin, dass eindringende P. acnes durch ihre Fähigkeit, verschiedene Aspekte der Immunität auszulösen, als primärer Treiber und/oder Verstärker der Krankheitsschwere fungieren können.
Spondylodiszitis und Rückenschmerzen
Eine von mehreren postoperativen Komplikationen, an denen P. acnes beteiligt ist, ist die Entzündung der Bandscheibe und des umgebenden Zwischenwirbelraums (Diskitis) nach einer Bandscheibenektomie (Harris et al., 2005). Eine begleitende degenerative Infektion der benachbarten Wirbel (Spondylodiszitis) kann ein häufiges Merkmal und die Ursache für schwere neurologische Schäden und Schmerzen sein, wenn die Behandlung verzögert wird (Uçkay et al., 2010). Neben der unbeabsichtigten chirurgischen Einbringung direkt in die Wirbelsäule können Krankheitserreger auch über die arterielle und venöse Blutversorgung der Wirbelsäule gelangen (hämatogene Ausbreitung). Während Staphylococcus aureus, Escherichia coli und Proteus-Spezies am häufigsten isoliert werden, ist P. acnes der häufigste anaerobe Erreger in diesem Zusammenhang und wird wahrscheinlich aufgrund der Schwierigkeiten bei der Kultivierung zu wenig erfasst. Es gibt einige klinische Hinweise darauf, dass Patienten mit Bandscheibenvorfällen (Nucleus pulposus), die mit anaeroben Erregern im Allgemeinen und P. acnes im Besonderen infiziert sind, eher Entzündungen und Ödeme der angrenzenden Wirbel (Modic-Veränderungen Typ I) und Rückenschmerzen entwickeln (Albert et al., 2013; Urquhart et al., 2015). Klinische und tierexperimentelle Folgeuntersuchungen bestätigen nun die ersten Ergebnisse, die zeigen, dass die lokale Proliferation von P. acnes eine Hochregulierung von Entzündungsmarkern und eine Bandscheibendegeneration verursacht, die mit Modic-Veränderungen übereinstimmen (Aghazadeh et al., 2016; Dudli et al., 2016). Es gibt jetzt sogar erste klinische Hinweise darauf, dass eine bakterielle Infektion der Bandscheibe mit P. acnes und/oder Staphylococcus epidermidis als Ursache für einen Bandscheibenvorfall und die damit verbundenen pathologischen Veränderungen tatsächlich allen anderen Problemen vorausgehen kann (Rajasekaran et al, 2017).
Parkinson-Krankheit (PD)
Das degenerierende Gehirn ist durch eine Schädigung des Nervensystems gekennzeichnet, die auf eine atypische Aggregation und Ablagerung mutierter oder fehlgefalteter Proteine (z. B. Lewy-Körper und Lewy-Neuriten) zurückgeführt werden kann, wie dies bei der idiopathischen Parkinson-Krankheit eindeutig belegt ist (Taylor et al., 2002). Was im Allgemeinen nicht erkannt wird, ist die Tatsache, dass das Gehirn auch anfällig für das Eindringen von Krankheitserregern ist, von Viren und Bakterien bis hin zu Pilzen. Diese Erreger, oder genauer gesagt ihre endogenen Bestandteile und/oder Metaboliten, können zentrale neurologische Defizite hervorrufen, die von subtilen Anzeichen von Demenz und Dystonie, die aus einer chronischen, wiederkehrenden Infektion resultieren (De Chiara et al., 2012; Bibi et al., 2014), bis hin zu schwerwiegenderen Erkrankungen der Motoneuronen reichen, wie sie beispielsweise bei dem humanen endogenen Retrovirus K beobachtet wurden (Li et al., 2015). Somit ist klar, dass der Mensch eine enorm hohe systemische Belastung durch Mikroben aufweist (Potgieter et al., 2015; Spadoni et al., 2015), die möglicherweise zur Pathologie fortschreitender neurodegenerativer Erkrankungen mit atypischer Proteinkomponente beitragen. Diese Arbeitshypothese gewinnt zweifellos beträchtliche Unterstützung, da kognitives, emotionales oder pathologisches Verhalten indirekt durch die räumliche und persönliche Verteilung von Mikroben beeinflusst zu werden scheint, die über die Darm-Hirn-Achse wirken (Abbildung 5) (Collins et al., 2012; Dinan et al., 2013; Mayer et al., 2014; Burokas et al., 2015). Eine kürzlich durchgeführte Fall-Kontroll-Studie hat gezeigt, dass mikrobielle Variationen im Magen-Darm-Trakt, sowohl zwischen als auch innerhalb von Individuen, am deutlichsten mit phänotypischen Variationen bei Morbus Parkinson korrespondieren (Scheperjans et al., 2015; Vizcarra et al., 2015). Obwohl die zugrundeliegenden Mechanismen, die die Zusammensetzung der Mikrobiota mit den Unterschieden bei Morbus Parkinson verknüpfen, nicht klar sind, könnte die obige Erkenntnis zumindest die hohe Prävalenz von gastrointestinalen Anomalien bei Morbus Parkinson-Patienten erklären (Dobbs et al., 2016). Ein weiterer Zusammenhang zwischen der Mikrobiota und dem Schweregrad von Morbus Parkinson besteht darin, dass Biopsien der Sigmaschleimhaut und fäkales Material von Morbus Parkinson-Patienten das Vorhandensein von opportunistischen und entzündungsfördernden Bakterienarten zeigten, die häufig chronische Verstopfung, Reizdarmsyndrom und Colitis ulcerosa verursachen (Keshavarzian et al., 2015). Insgesamt deuten diese ersten Ergebnisse darauf hin, dass Beziehungen zwischen verschiedenen mikrobiellen Gemeinschaften im Darm eine häufige Komorbidität bei Morbus Parkinson sind und dass einzigartige individuelle Signaturen des Darm-Ökosystems klassische motorische Beeinträchtigungen von Morbus Parkinson verstärken können.
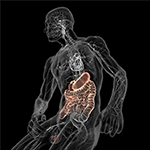
Abbildung 5. Schematische Darstellung der Darm-Hirn-Achse (farbig) mit dem mit Mikroben gefüllten Verdauungssystem auf der einen und dem Gehirn mit seinen Homöostasezentren (Hypothalamus und Hypophyse) auf der anderen Seite. Beide sind durch das kardiovaskuläre und autonome Nervensystem verbunden, einschließlich des Vagusnervs (Hirnnerv X), der den mikrobiellen Übergang in das zentrale Nervensystem (ZNS) erleichtern könnte. Mit freundlicher Genehmigung von Bryan Christie Design (http://bryanchristiedesign.com/).
Vor diesem Hintergrund stellt sich die Frage, ob es Beweise dafür gibt, dass P. acnes eine Rolle in der Pathophysiologie von Parkinson spielt. Damit diese Möglichkeit besteht, müssen zwei Bedingungen erfüllt sein: (1) Die Infektion mit P. acnes muss dem Auftreten klassischer Krankheitssymptome wie Schütteln, motorischer Beginn und Verlangsamung der Bewegungen vorausgehen; und (2) die Inokulation mit P. acnes muss in ausreichendem Maße Symptome von Morbus Parkinson auslösen und/oder zum Verlust von Dopamin-Projektionsneuronen im Mittelhirnkern, der so genannten Substantia nigra pars compacta, führen. Bisher hat unser Labor Cluster von P. acnes in Neuronen des Mittelhirns und in nahe gelegenen kortikalen Strukturen von autopsierten PD-Gehirnen entdeckt (Abbildung 6). Dieser unerwartete Befund ist ein weiterer Beleg dafür, dass P. acnes indirekt zu lokalen Entzündungsschüben beiträgt, wie sie auch bei Sarkoidose und BPH auftreten. Eine offene Frage ist, inwieweit P. acnes bestimmte pathologische Merkmale von Parkinson indirekt verstärken kann. Da es sich bei Morbus Parkinson um eine sehr heterogene Erkrankung handelt, ist es unwahrscheinlich, dass ein einziger Krankheitsmechanismus für alle Phänotypen von Morbus Parkinson gilt. Dennoch ist es interessant zu spekulieren, dass ansässige Hautmikroben das Fortschreiten von Morbus Parkinson durch entzündliche und/oder genetische Prädispositionen auslösen oder verstärken könnten.

Abbildung 6. Immunhistochemie menschlicher PD-Mittelhirngewebeproben, gefärbt für P. acnes (grün; A+B), neuronale Mikrotubuli (MAP2; rot; A) und Zellkerne (DAPI; blau; A+B). Die altersbedingte Lipofuszin-Autofluoreszenz wurde mit Sudan Black B gelöscht. Anwesenheit von P. acnes (Pfeil) im periplasmatischen Raum eines menschlichen Neurons (A) zwischen Kern (n) und Zytoskelett; oder Neutrophile (B) mit ihrem charakteristischen mehrlappigen Kern in einer Mittelhirnkapillare (Cap). Diese Befunde sind typisch für Morbus Parkinson und in den meisten Kontrollschnitten nicht vorhanden. Retrograde Bewegungen entlang von Hirnnerven, traumabedingte Mikroblutungen sowie das neu entdeckte glymphatische System stellen potenzielle mikrobielle Wege in das ZNS dar.
Wenn P. acnes Zugang zu Dopaminzellen im Mittelhirn erlangen kann, was ist dann der wahrscheinlichste Weg der Inokulation und Infektion? Obwohl die Haut physisch vom Gehirn abgegrenzt ist, bleibt die Kreuzinfektion ein Risikofaktor. So könnten beispielsweise die Nasenhöhlen pathogene P. acnes-Stämme beherbergen, die dann in das Hirnparenchym wandern und dort die lokalen Makrophagen, die Mikroglia, hyperaktivieren – ein Phänomen, das ein durchgängiges Merkmal der Parkinson-Pathologie ist (Übersicht bei Chao et al., 2014). Untersuchungen zu nosokomialen Infektionen zeigen, dass so unterschiedliche Bakterienarten wie Pneumococcus sp. (Zwijnenburg et al., 2001) und Salmonella sp. (Bollen et al., 2008) leicht entlang des Riechnervs (Hirnnerv 1; CN 1) und schließlich in den Riechkolben wandern können. Eine weitere potenzielle Eintrittspforte für schädliche Mikroben oder gefährliche fehlgefaltete Proteine ist der Vagusnerv (Hirnnerv 10; CN 10). Tatsächlich scheinen unter bestimmten Umständen fehlgefaltete Aggregate in Form von Lewy-Körpern und Lewy-Neuriten vom Vagusnerv ins Gehirn zu wandern, was ein weiterer Beleg dafür ist, dass pathogene Bakterien in Verbindung mit toxischen Proteinen möglicherweise zu einer selektiven neuronalen Anfälligkeit beitragen (Holmqvist et al., 2014). Interessanterweise gehören die Hirnkerne von CN 1 und CN 10 zu den ersten Stellen, an denen sich im Verlauf der PD-Progression bevorzugt Lewy-Körperchen und Lewy-Neuriten ablagern (Braak et al., 2004). Diese besondere Beobachtung weist nicht nur auf einen wahrscheinlichen Eintrittsweg für Bakterien in das Gehirn hin, sondern liefert auch einen potenziellen Mechanismus für die Beobachtung, dass eine Stammvagotomie das Morbus-Parkinson-Risiko signifikant senkt (Svensson et al., 2015). Der Zusammenhang zwischen Kopftrauma und Morbus Parkinson (Harris et al., 2013; Jafari et al., 2013; Pearce et al., 2015) in Verbindung mit der Vorstellung eines vielfältigen Blutmikrobioms (Potgieter et al., 2015) impliziert ein enormes Potenzial für pathogenen Opportunismus bei traumatischen Verletzungen der Blut-Hirn-Schranke. Mit der jüngsten Entdeckung eines lymphatischen Systems im Gehirn (Iliff et al., 2012; Hitscherich et al., 2016) muss ein weiterer potenzieller Infektionsweg im Gehirn in Betracht gezogen werden.
Insgesamt gibt es präklinische und einige klinische Hinweise darauf, dass P. acnes indirekt eine unabhängige Variable ist, die das Auftreten oder den Schweregrad von Parkinson beeinflusst. Diese Hinweise werden durch Berichte ergänzt, die eine schwere Hauterkrankung, die Acne inversa, mit der Alzheimer-Krankheit in Verbindung bringen (Wang et al., 2010). Aus therapeutischer Sicht stellt die Möglichkeit, dass P. acnes zentrale Merkmale von Morbus Parkinson auslöst oder verstärkt, eine wichtige Ressource für antibiotische Ansätze bei neurodegenerativen Erkrankungen dar. Und aus der Sicht der Forschung wäre es lohnenswert, Patienten mit Hauterkrankungen genauer auf Anzeichen einer Neuropathologie mit früherem Beginn und einem schwereren Krankheitsphänotyp zu untersuchen.
Zukunftsperspektive
Die in diesem Artikel vorgestellte Übersicht zeigt eine unerwartete dunkle Seite von P. acnes in Bezug auf die Pathologie auf. Die intrazelluläre Persistenz von P. acnes wird mit Erkrankungen der Lunge, der Prostata und möglicherweise des Gehirns in Verbindung gebracht. Dies ist ein klarer Beweis für die Pathogenität von Bakterien, die aus der Haut stammen, bei bestimmten Krankheitserscheinungen. Weitere Untersuchungen werden sich auf mehrere offene Fragen in der Biologie von P. acnes konzentrieren müssen: (1) Welches sind die entscheidenden P. acnes-Interaktionen bei der Krankheitsanfälligkeit? (2) Welche Mechanismen werden von P. acnes genutzt, um den Krankheitsverlauf zu beeinflussen? (3) Wenn bestimmte Populationen von P. acnes die Anfälligkeit für schwere Krankheiten erhöhen können, gibt es dann andere Konfigurationen von P. acnes, die schützend wirken? (4) Gibt es einen Beweis für das Konzept, dass eine P. acnes-Infektion direkt mit der Krankheitspathologie zusammenhängt, oder genauer gesagt, zeigt die Konzeptstudie eine Kausalität oder nur eine Korrelation? Und schließlich (5) Kann P. acnes-bedingte Krankheitspathologie mit konventioneller Antibiotikatherapie und diagnostischen Anwendungen behandelt werden?
Beiträge der Autoren
JL, KER, JC, KR, CH, AM, HB und GT haben das Manuskript verfasst. JL und MS erstellten die Abbildungen.
Finanzierung
JL wurde vom NYIT College of Osteopathic Medicine finanziert.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.