Hier ist die Sache mit der Behandlung der „Amine“ in Org 2: Es gibt keine Erzählung.
Im Gegensatz zu den meisten Kapiteln beginnt es nicht mit einer Reihe von Konzepten und baut dann auf einer Reihe von Beispielen auf, auf die man diese Konzepte anwenden kann.
Nein. Ein typisches Kapitel über Amine in einem einführenden Lehrbuch ist im Grunde nur ein Sammelsurium von scheinbar zufällig zusammengewürfelten Themen, die nirgendwo anders hineingepasst haben. Der einzige rote Faden ist, dass sie in irgendeiner Weise Stickstoff enthalten.
Beispiel: Der heutige Beitrag über Amine handelt von den Hofmann- und Curtius-Umlagerungen.
Was ist der Grund dafür, könnte man fragen? Keine gute Antwort. In den meisten Kursen werden sie irgendwann behandelt, und irgendwo müssen sie ja untergebracht werden. Also was soll’s. Warum nicht jetzt?
Inhaltsverzeichnis
- Die Hofmann- und Curtius-Umlagerungen
- Der Mechanismus der Hofmann- und Curtius-Umlagerungen, Teil Eins – Aufbau der Umlagerung
- Teil Zwei: Der wichtigste Umlagerungsschritt bei den Hofmann- und Curtius-Umlagerungen
- Teil Drei: Die Bildung des Isocyanats
- Zusammenfassung der Schritte
- Das Schicksal des Isocyanats: Bildung von Carbamaten, Aminen und Harnstoffen
- Zusammenfassung: Die Hofmann- und Curtius-Umlagerungen
- Hinweise
- (Fortgeschrittene) Referenzen und weiterführende Literatur
- Die Hofmann- und Curtius-Umlagerungen
- Der Mechanismus der Hofmann- und Curtius-Umlagerungen, Teil 1: Aufbau der Umlagerung
- Teil 1: Vorspiel
- 3. Der entscheidende Umlagerungsschritt bei Hofmann und Curtius
- Bildung des Isocyanats
- Die Schritte zusammenfügen
- Das Schicksal des Isocyanats
- Zusammenfassung: Die Hofmann- und Curtius-Umlagerungen
- Hinweise
- (Fortgeschrittene) Referenzen und weiterführende Literatur
Die Hofmann- und Curtius-Umlagerungen
Die Hofmann- und Curtius-Umlagerungen sind zwei Beispiele für eine ganze Familie von Umlagerungsreaktionen, die einen gemeinsamen mechanistischen Schritt aufweisen.
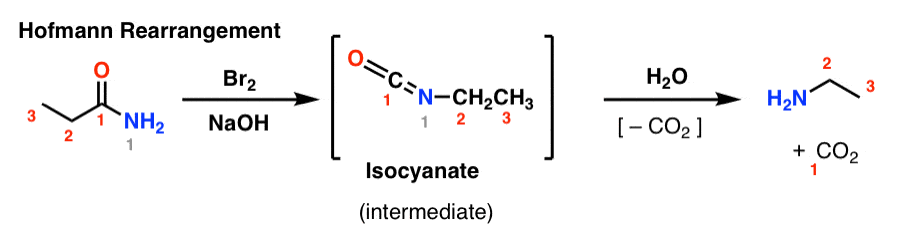
Bei der Hofmann-Umlagerung wird ein Amid mit Brom und einer Base (normalerweise NaOH oder KOH) behandelt. Beim Erhitzen bildet sich ein Isocyanat-Zwischenprodukt, das nicht isoliert wird. In Gegenwart von Wasser verliert das Isocyanat Kohlendioxid („decarboxyliert“) und bildet ein Amin.
Die wichtigste Bindung, die bei der Hofmann-Umlagerung entsteht, ist die C2-N-Bindung. Man beachte, wie die Carbonylgruppe (C1) verloren geht und Kohlendioxid (CO2) entsteht. (Hinweis: Dies ist keine IUPAC-Nummerierung, sondern nur eine Nummerierung zur Erleichterung der Diskussion)
Bei der Curtius-Umlagerung wird ein Acylazid erhitzt, und es bildet sich ein Isocyanat. Bei der Curtius-Umlagerung kann das Isocyanat isoliert werden, wird aber in der Regel in andere Spezies wie ein Carbamat, einen Harnstoff oder (durch Decarboxylierung wie bei der Hofmann-Umlagerung) in ein Amin umgewandelt (mehr dazu weiter unten).
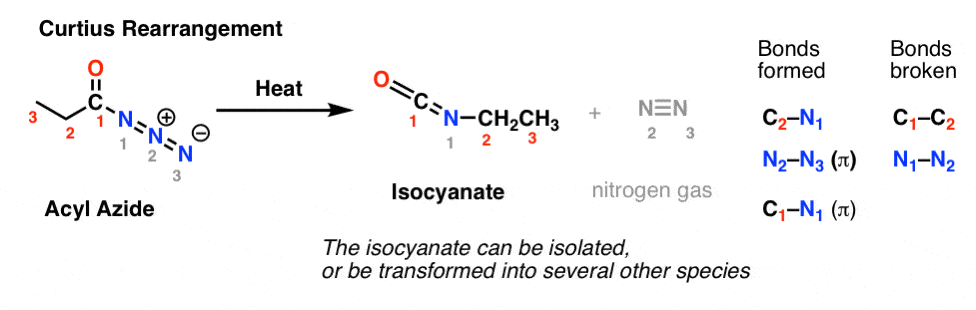
Die wichtigste Beobachtung in beiden Fällen ist, dass die C1-C2-Bindung gebrochen ist und eine neue C2-N-Bindung entstanden ist.
Die Frage ist WIE?
Der Mechanismus der Hofmann- und Curtius-Umlagerungen, Teil 1: Aufbau der Umlagerung
Es gibt vier wichtige Teile des Mechanismus der Curtius- und Hofmann-Umlagerungen, und wir werden sie alle durchgehen.
- Vorspiel (einfach)
- Schlüsselschritt der Migration (knifflig, aber weniger knifflig, wenn man weiß, dass man eine Variante davon in Org 1 gesehen hat!)
- Bildung des Isocyanats (einfach)
4. Epilog: Transformationen des Isocyanats
Teil 1: Vorspiel
- Die Hofmann-Umlagerung erfolgt mit einem Amid.
- Die Curtius-Umlagerung findet mit einem Acylazid statt.
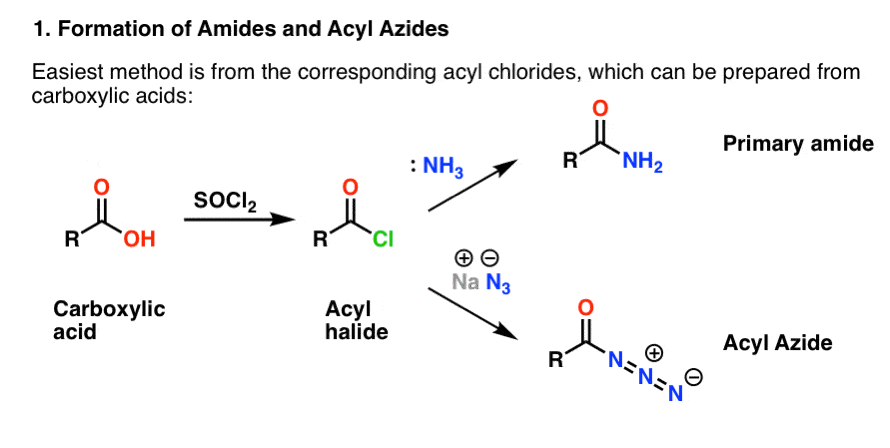
Beide werden bequem aus Acylhalogeniden durch eine Additions-Eliminierungsreaktion hergestellt. Wenn Sie sich jetzt mit Aminen beschäftigen, dann sind Carbonylreaktionen wahrscheinlich ein vertrautes Gebiet. Die Acylhalogenide können aus Carbonsäuren hergestellt werden, indem man ein Reagenz wie Thionylchlorid (SOCl2) oder Phosphorpentachlorid (PCl5) verwendet.
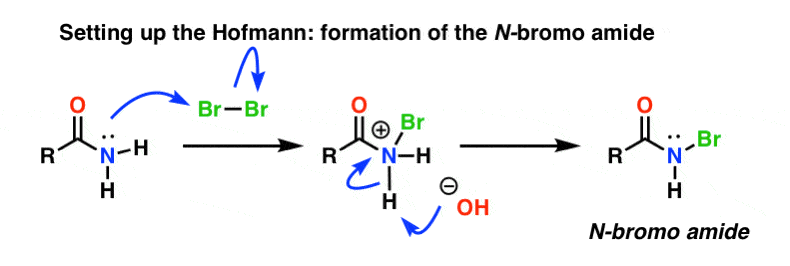
Aufbau der Hofmann-Umlagerung
Bei der Hofmann-Umlagerung wird das Amid mit Brom (Br2) und einer Base wie NaOH behandelt. Dies führt zur Abspaltung von N-H und zur Bildung von N-Br, wodurch eine gute Abgangsgruppe am Stickstoff entsteht. Wir nennen dies ein „N-Bromamid“.
Der Curtius muss nicht „eingerichtet“ werden, da das Acylazid bereits eine hervorragende eingebaute Abgangsgruppe hat: N2. Aus diesem Grund sollten organische Azide mit Vorsicht behandelt werden, da eine grobe Behandlung zu Explosionen führen kann.
3. Der entscheidende Umlagerungsschritt bei Hofmann und Curtius
Jetzt geht es zur Sache.
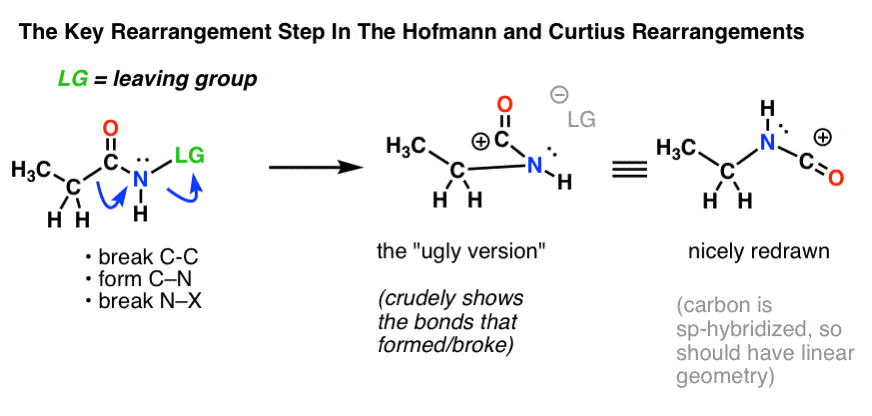
Der Schlüsselschritt bei den Hofmann- und Curtius-Umlagerungen ist die Wanderung eines Kohlenstoffatoms, um eine Abgangsgruppe an einem benachbarten Stickstoff zu verdrängen.
Dafür müssen zwei gekrümmte Pfeile gezeichnet werden, die in der Struktur ganz links (unten) dargestellt sind.
- Im ersten gebogenen Pfeil bricht die C-C-Bindung, und es bildet sich eine neue C-N-Bindung.
- Im zweiten gebogenen Pfeil bricht die N-LG-Bindung (Abgangsgruppe).
Es ist jedoch nicht immer einfach, von der Struktur ganz links zu der Struktur ganz rechts zu gelangen (die schön ordentlich gezeichnet ist!).
Jedes Jahr gehen in den Prüfungen unzählige Punkte verloren, weil die Schüler zwar die gekrümmten Pfeile richtig zeichnen, aber am Ende die falsche Struktur! Deshalb ermutige ich die Schüler, zuerst eine „hässliche Version“ zu zeichnen, die zwar scheiße aussieht, aber wenigstens alle Bindungen an der richtigen Stelle hat. Es ist immer noch Zeit, die Struktur neu zu zeichnen und sie später hübsch aussehen zu lassen.
Auf den ersten Blick sieht diese Umlagerung wahrscheinlich… seltsam aus. Aber es ist eigentlich eine Reaktion, die Sie schon einmal gesehen haben! (
Erinnert sich jemand an den Mechanismus für den „Oxidations“-Schritt bei der Hydroborierung-Oxidation?
Es ist im Grunde das Gleiche!
Hier ist eine Auffrischung:
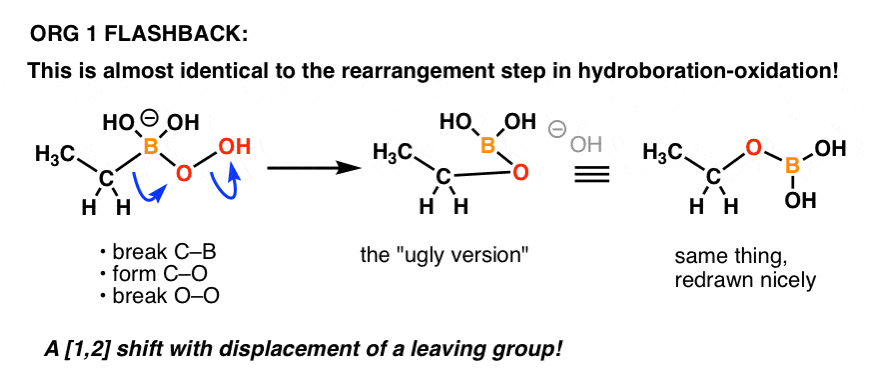
Ein weiteres Beispiel dafür, wie Dinge, die man in einem früheren Teil der organischen Chemie lernt, in einem späteren Teil des Kurses wieder auftauchen können!
Lassen Sie uns den spezifischen Umlagerungsschritt in den Hofmann- und Curtius-Umlagerungen mit konkreten Beispielen besuchen.
Hier ist der Schlüsselschritt in der Hofmann-Umlagerung, wo Erhitzen zum Bruch von C-C, zur Bildung von C-N und zum Bruch von N-Br führt.
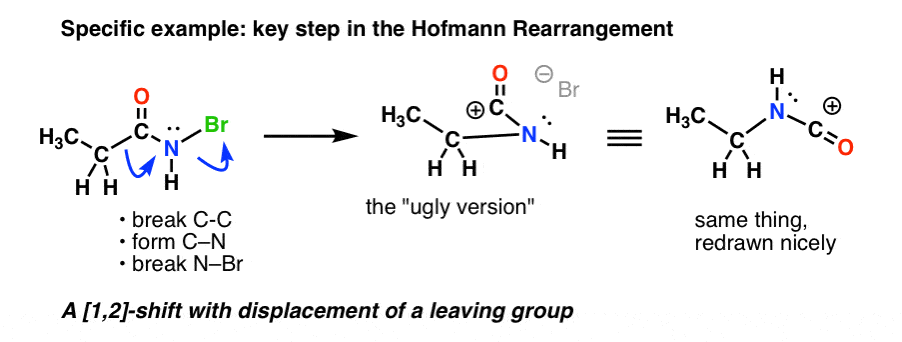
Wenn man allen Pfeilen folgt, sollte man am Ende ein seltsam aussehendes Carbokation (oben rechts) erhalten, mit dem wir uns gleich beschäftigen werden.
Beim Curtius-Verfahren führt das Erhitzen des Acylazids zu einer Umlagerung. Die austretende Gruppe ist Stickstoffgas (N2).
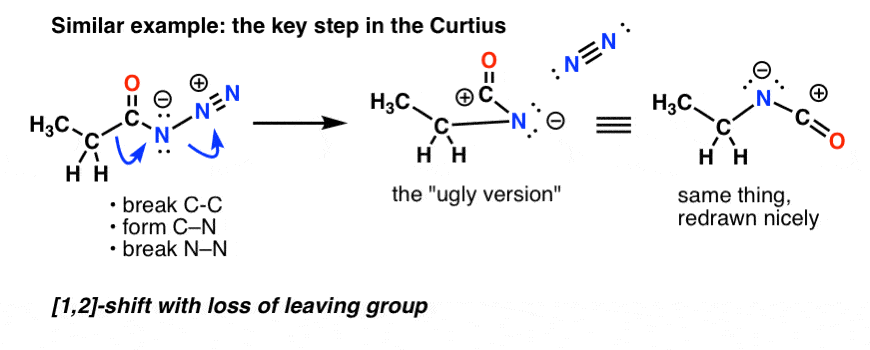
(Ein feiner Unterschied zwischen Curtius und Hofmann besteht darin, dass bei Curtius kein Wasserstoff an N gebunden ist, so dass der Stickstoff in der umgelagerten Spezies negativ geladen ist.)
Bildung des Isocyanats
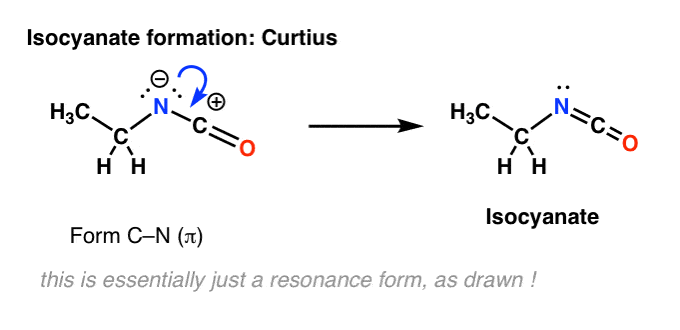
Der nächste Schritt ist der Übergang von unserer umgelagerten Spezies zum Isocyanat. Für jeden, der es gewohnt ist, Resonanzformen zu zeichnen, sollte dies nicht allzu schwierig sein.
(Wie wir weiter unten besprechen werden, haben Studien ergeben, dass die Isocyanatbildung gleichzeitig mit der Migration stattfindet. Für unsere Lehrzwecke ist es jedoch hilfreich, diesen Schritt isoliert zu betrachten. Wir können das Ganze in einer Minute zusammenfassen).
Wie Sie sich vielleicht noch aus Org 1 erinnern, ist eine Resonanzform mit vollen Oktetten einer ohne überlegen (kurze Zusammenfassung). Unser seltsam aussehendes Produkt aus der Umlagerung hat ein Carbokation neben einem Stickstoff, der ein einsames Paar enthält. Der erste Schritt besteht also darin, die Bildung einer neuen C-N-pi-Bindung zu zeichnen. Dies ist im Wesentlichen nur eine Resonanzform.
Die Hofmann-Umlagerung findet in Gegenwart einer Base statt. Nach dem Ziehen der Resonanzform ist der nächste Schritt also die Deprotonierung der N-H-Bindung, wodurch das neutrale Isocyanat entsteht.
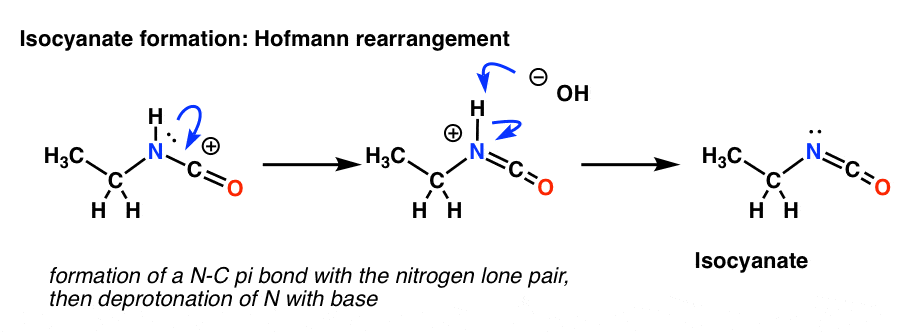
Es gibt keinen Wasserstoff am Stickstoff im Curtius. Die Isocyanatbildung erfolgt also lediglich durch die Spende eines einsamen Paares vom Stickstoff an das Carbokation. Man kann es einfach als eine Resonanzform betrachten.
Die Schritte zusammenfügen
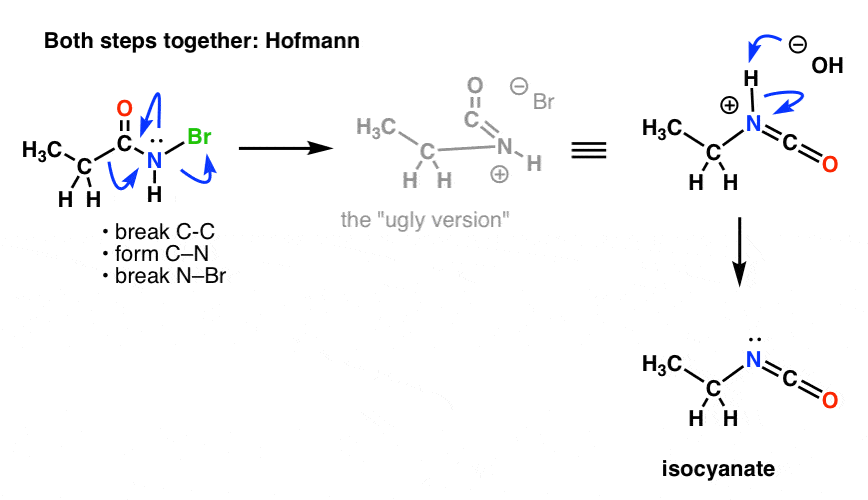
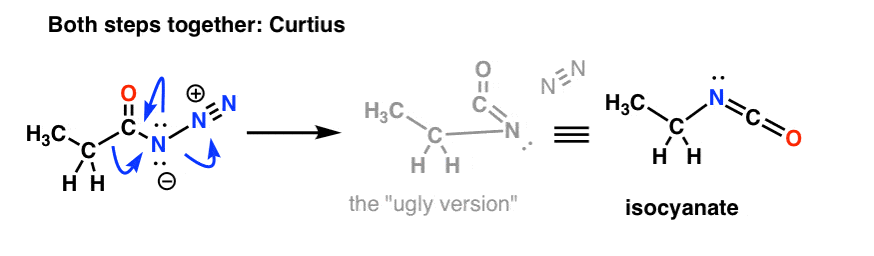
Untersuchungen des Mechanismus der Hofmann- und der Curtius-Umlagerung haben ergeben, dass diese beiden Schritte nicht nacheinander, sondern tatsächlich gleichzeitig ablaufen! (Woher wissen wir das? siehe Anmerkung 1 )
Das heißt, die Migration findet gleichzeitig mit der Isocyanatbildung statt.
Wir müssen die Mechanismen von Hofmann und Curtius neu zeichnen, um dies widerzuspiegeln, indem wir beide Schritte einbeziehen.
Hier ist der Hofmann (beachten Sie, dass das Deprotonierungsereignis tatsächlich separat ist).
Und der Curtius:
Das Schicksal des Isocyanats
Beide, Hofmann und Curtius, führen zu einem Isocyanat. Isocyanate sind dir wahrscheinlich noch nicht begegnet. Auf den ersten Blick sind sie ziemlich seltsam aussehende Spezies, aber ihre Chemie unterscheidet sich nicht so sehr von der anderer Carbonylspezies wie Ester, Amide und Acylhalogenide.
Die Isocyanatstruktur ähnelt sehr der von Kohlendioxid, CO2. Der Kohlenstoff ist an zwei stark elektronegative Atome pi-bunden. Dies macht den Kohlenstoff zu einem ausgezeichneten Elektrophil.
Durch Zugabe verschiedener Nukleophile können Isocyanate in andere nützliche Spezies umgewandelt werden.
– Durch Zugabe eines Alkohols entsteht ein Carbamat
– Durch Zugabe eines Amins entsteht ein Harnstoff
– Durch Zugabe von Wasser entsteht eine Carbaminsäure, die instabil ist. Carbaminsäuren verlieren schnell Kohlendioxid, um ein Amin zu bilden.
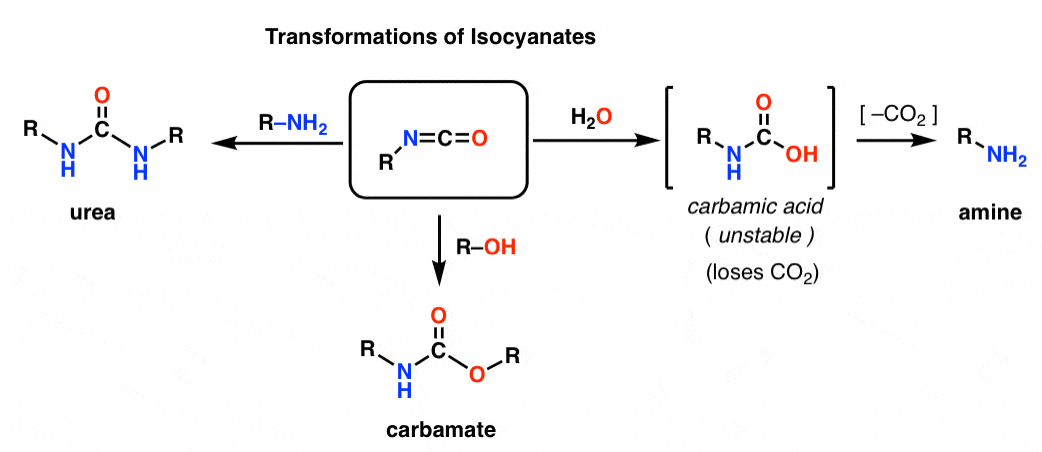
Insbesondere der Decarboxylierungsweg bietet eine raffinierte Möglichkeit, Amine herzustellen. Wir haben schon viele Wege zur Herstellung von Carbonsäuren kennengelernt, aber nicht allzu viele Wege zur Herstellung von Aminen (abgesehen von nukleophiler Substitution und reduktiver Aminierung). Hofmann ist ein guter Trick, den man in der Tasche haben sollte, wenn keine der beiden Situationen zutrifft – wie zum Beispiel bei der Herstellung von substituierten Anilinen.
Mechanismen? OK, gut. Siehe Bonusthema 1.
Zusammenfassung: Die Hofmann- und Curtius-Umlagerungen
Der Mechanismus dieser Umlagerungen ist auf den ersten Blick knifflig, wird aber wesentlich einfacher, wenn man weiß, dass man eine Variante der Migrationsreaktion schon einmal gesehen hat (z. B. bei der Hydroborierung-Oxidation).
Ich empfehle dringend, zuerst die hässliche Version zu zeichnen, denn so kann man sich auf die entstehenden und aufbrechenden Bindungen konzentrieren, bevor man versucht, sie in eine ästhetisch ansprechendere Struktur umzugestalten. Dies gilt auch für die Beckmann- und Wolff-Umlagerungen, die einen ähnlichen Schritt haben (siehe unten)
Hinweise
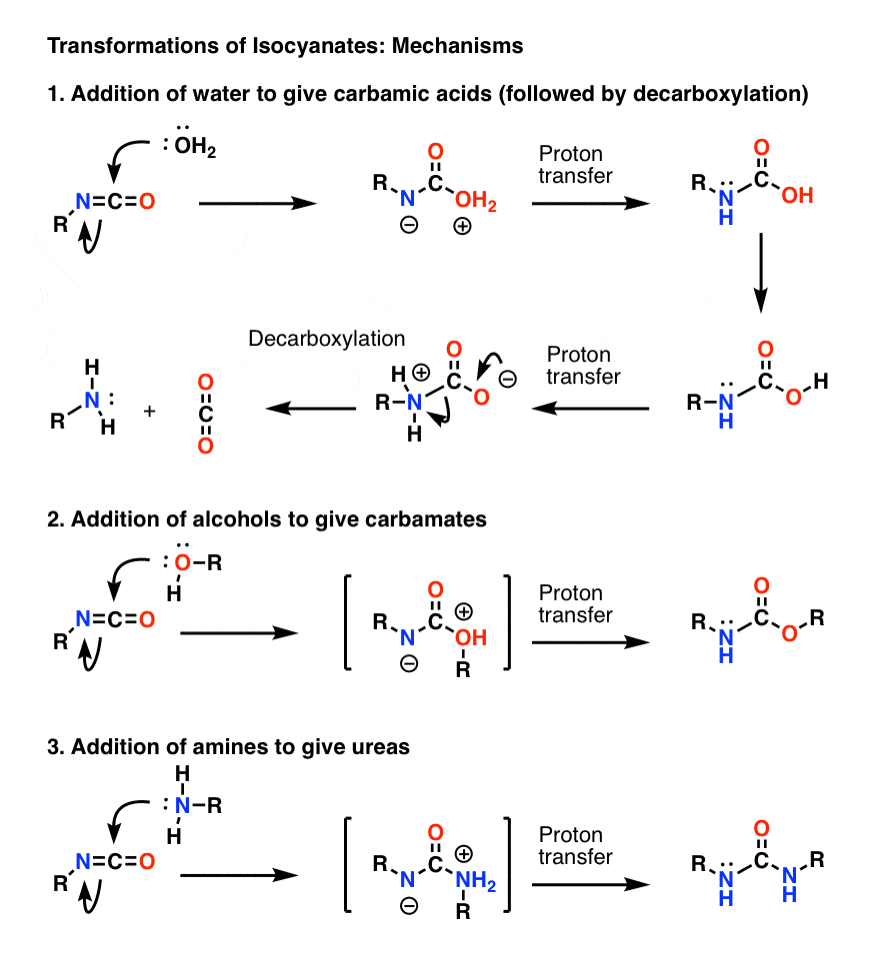
Bonusthema 1: Isocyanate
Der wichtigste Mechanismus der Isocyanate ist die elektrophile Addition (d.h. die Addition eines Nucleophils an das zentrale, elektrophile Kohlenstoffatom). Im folgenden Mechanismus habe ich gezeigt, wie das Nucleophil an den Kohlenstoff addiert, um ein Anion am Stickstoff zu bilden, obwohl dies wahrscheinlich nicht die beste Resonanzform ist (der Sauerstoff kann die negative Ladung besser stabilisieren als der Stickstoff). Der Protonentransfer von Sauerstoff auf Stickstoff führt zu einer neutralen Spezies. (Ich habe hier den Zauberstab des Protonentransfers verwendet, weil er schneller ist).
Beachten Sie, dass dem Decarboxylierungsschritt in 1) keine Deportation des Sauerstoffs vorausgehen muss, obwohl er auf jeden Fall so ablaufen muss, dass der Stickstoff während des Schritts protoniert wird (Sie wollen z. B. kein stark basisches Amidion bilden).
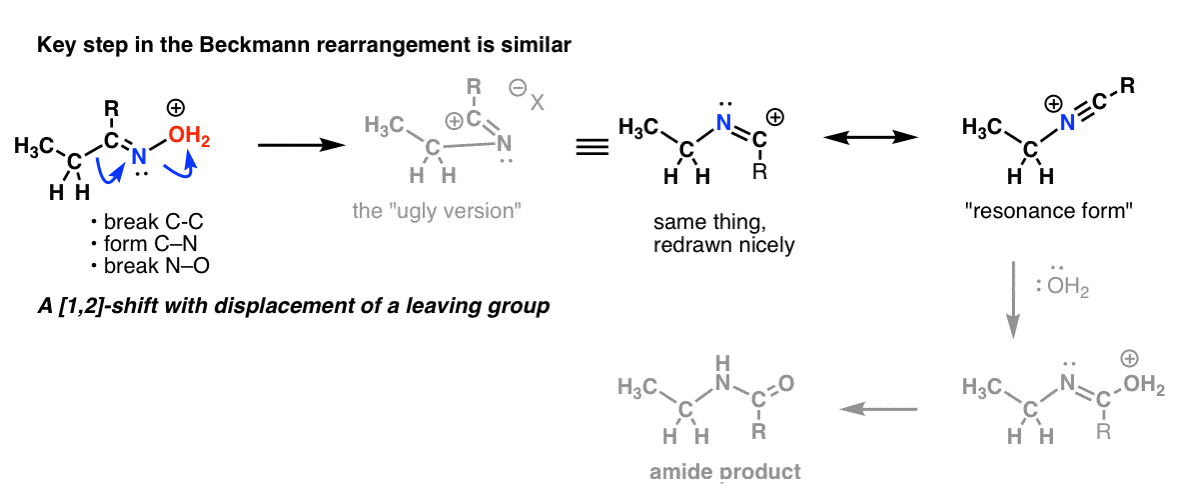
Bonusthema 2: Die Beckmann-, Wolff- und andere Umlagerungen haben einen ähnlichen Schritt
Aber halt, da ist noch mehr!
Bei der Beckmann-Umlagerung gibt es eine 1,2-Verschiebung mit Verlust einer Abgangsgruppe. Der Schlüsselschritt ist im Wesentlichen derselbe, den wir bei der Hofmann- und Curtius-Umlagerung gesehen haben.
Und bei der Wolff-Umlagerung, die üblicherweise auch behandelt wird, erkennen Sie vielleicht denselben Schlüsselschritt.
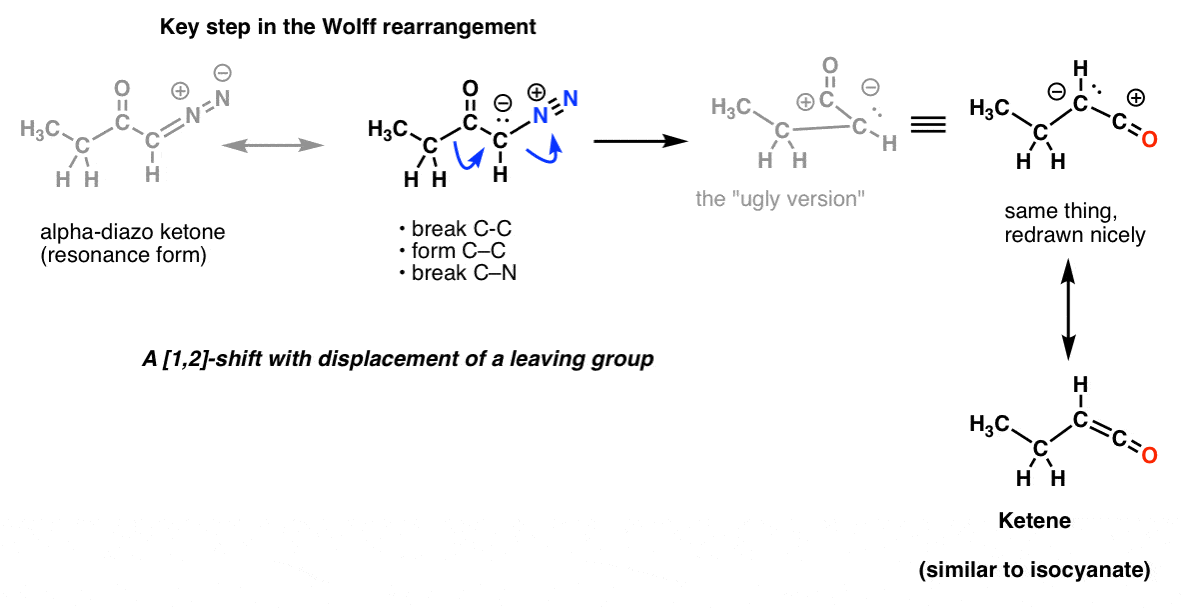
Und das ist noch nicht alles! Es gibt eine Reaktion, die Schmidt-Umlagerung, die der Curtius-Reaktion ähnelt, aber durch Zugabe von HN3 zu einem Acylchlorid (oder einer Carbonsäure) zustande kommt. Und es gibt eine weitere Reaktion, die Lossen-Umlagerung, die mit Hydroxyamidsäuren stattfindet. Wer den Schlüsselschritt in diesen beiden Prozessen errät, wird nicht belohnt. Und wir haben noch nicht einmal die Baeyer-Villiger-Umlagerung erwähnt, bei der kein Stickstoff involviert ist, die aber so ziemlich die gleiche Art von Prozess ist.
Als ich vor vielen Monden den Hydroborierungs-Oxidationsschritt in Org 1 lernte, hätte ich sicherlich nicht erwartet, dass sich dasselbe Reaktionsmuster in so vielen verschiedenen Formen wiederholen würde.
Das Fazit ist, dass es eine Menge Reaktionen gibt, die unter verschiedenen Namen laufen, aber denselben mechanistischen Prozess durchlaufen. Das unterstreicht, wie wichtig es ist, die Schlüsselmuster in der organischen Chemie zu lernen, denn sie wiederholen sich wirklich oft.
Endnote. Abgestimmt, nicht getrennt?
Wenn der Curtius-Prozess schrittweise abliefe, würde der Verlust von Stickstoff zu einem Nitren führen. Nitrene durchlaufen eine Reihe interessanter Reaktionen, wie z.B. die Insertion in C-H-Bindungen (!). Man kann also ein Experiment entwerfen, um dies zu testen: Wenn man die folgende Curtius-Umlagerung versucht, könnte man nach Hinweisen auf die Bildung eines fünfgliedrigen Rings suchen.
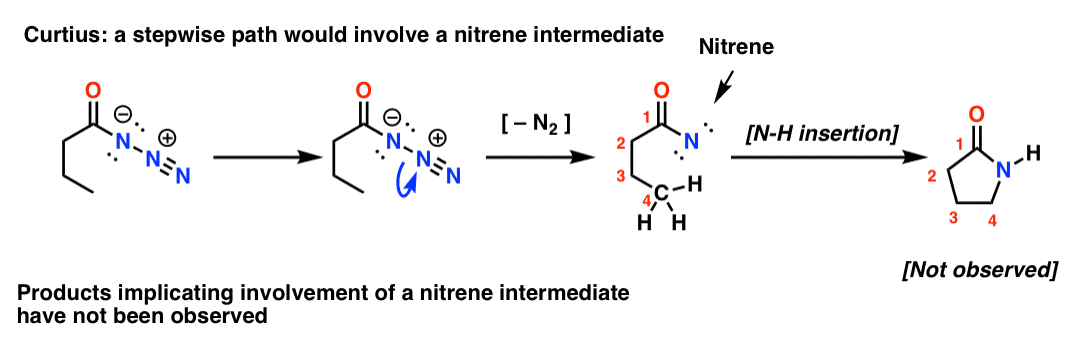
Das Fehlen solcher Produkte deutet zusammen mit anderen Hinweisen auf einen konzertierten Mechanismus hin.
(Fortgeschrittene) Referenzen und weiterführende Literatur
- Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide
W. Hofmann
Chem. Ber. 1881, 14, 2725-2736
DOI: 10.1002/cber.188101402242
Originalarbeit von A. W. Hofmann (der ein sehr produktiver Chemiker war und dessen Name mit vielen anderen Transformationen in Verbindung gebracht wird) über den Abbau von Amiden zu primären Aminen. - A Mild and Efficient Modified Hofmann Rearrangement
Xicai Huang, Mehran Seid, and Jeffrey W. Keillor
The Journal of Organic Chemistry 1997, 62 (21), 7495-7496
DOI:10.1021/jo9708553
Dies ist eine modifizierte Hofmann-Umlagerung, die in Methanol durchgeführt wird – in diesem Fall kann das Carbaminsäure-Zwischenprodukt mit dem Lösungsmittel Methanol reagieren, um Methylcarbamate in guter Ausbeute herzustellen. - METHYL CARBAMATE FORMATION VIA MODIFIED HOFMANN REARRANGEMENT REACTIONS: METHYL N-(p-METHOXYPHENYL)CARBAMATE
Jeffrey W. Keillor und Xicai Huang
Org. Synth. 2002, 78, 234
DOI: 10.15227/orgsyn.078.0234
Ein zuverlässiges und unabhängig getestetes Verfahren für die modifizierte Hofmann-Umlagerung in Ref. 2. - Die Hofmann-Reaktion
Wallis, Everett L.; Lane, John F.
Org. React. 1946, 3, 267-306
DOI: 10.1002/0471264180.or003.07
Eine alte, aber (für die damalige Zeit) umfassende Übersicht über die Hofmann-Reaktion (die Reaktion von Amid zu Amin, nicht zu verwechseln mit seinen anderen Reaktionen). - Notes – A Re-examination of the Limitations of the Hofmann Reaction
Ernest Magnien und Richard Baltzly
The Journal of Organic Chemistry 1958, 23 (12), 2029-2032
DOI:10.1021/jo01106a630
Dies ist eine interessante Arbeit, in der die Autoren versucht haben, den Umfang der Hofmann-Umlagerung über das hinaus zu erweitern, was in der ursprünglichen Arbeit beschrieben wurde, indem sie die Reaktionsbedingungen sorgfältig angepasst haben. - 20. Hydrazide und Azide organischer Säuren
Curtius, T. I. Abhandlung.
Journal Für Praktische Chemie, 50(1), 275-294. (1894).
DOI:1002/prac.18940500125 - Ueber Stickstoffwasserstoffsäure (Azoimid) N3H.
Curtius, T.
Berichte Der Deutschen Chemischen Gesellschaft, 23(2), 3023-3033.(1890).
DOI:1002/cber.189002302232
Erste Arbeiten von Theodore Curtius zur Beschreibung der Reaktivität von Acylhyraziden und Acylaziden. - Die Curtius-Reaktion
Smith, P. A. S.
Org. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Ein alter, aber umfassender Überblick über die Curtius-Reaktion, der die Geschichte der Entdeckung dieser Umlagerung, den Umfang der Substrate, die Grenzen, den Vergleich mit anderen ähnlichen Reaktionen und experimentelle Verfahren umfasst. - UNDECYL-ISOCYANAT
F. H. Allen und Alan Bell
Org. Synth. 1944, 24, 94
DOI: 10.15227/orgsyn.024.0094
Ein altes, aber reproduzierbares und erprobtes Verfahren zur Synthese von Isocyanaten durch die Curtius-Umlagerung. - Eine zweckmäßige schutzgruppenfreie Totalsynthese von (±)-Dievodiamin
William P. Unsworth, Christiana Kitsiou, und Richard J. K. Taylor
Organic Letters 2013 15 (13), 3302-3305
DOI:1021/ol4013469
Der erste Schritt in dieser Totalsynthese nutzt eine Curtius-Umlagerung, um eine intramolekulare Cyclisierung der Indol-substituierten Carbonsäure zu bewirken. - Synthetische Methoden und Reaktionen. 121. Zinkjodid-katalysierte Herstellung von Aroylaziden aus Aroylchloriden und Trimethylsilylazid
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, and George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051
Ein bequemes Verfahren zur Herstellung aromatischer Arylazide von Nobelpreisträger Prof. George A. Olah. Diese können dann für Curtius-Umlagerungen verwendet werden.