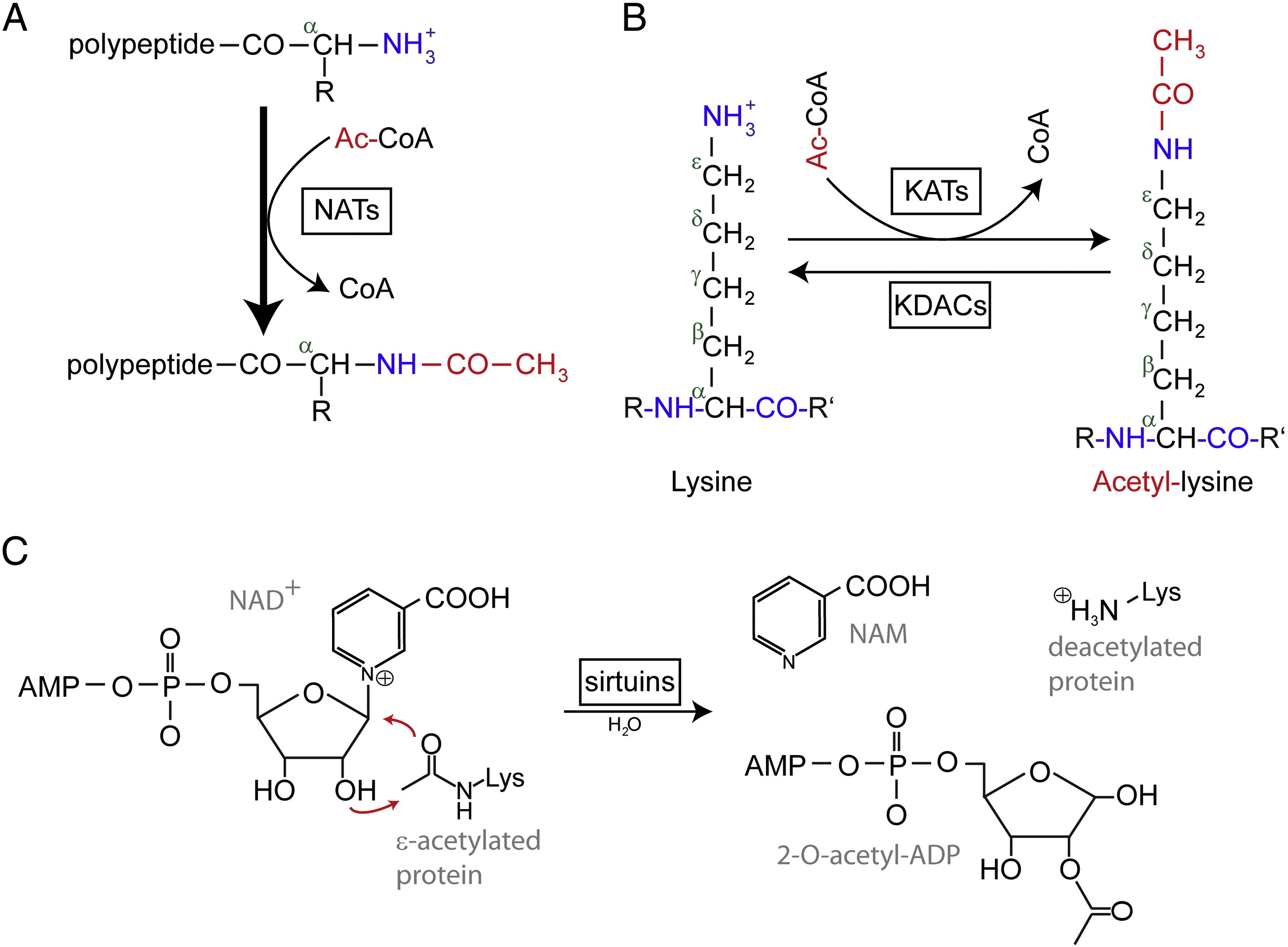
Acetylierung bezeichnet eine Reaktion, bei der eine funktionelle Acetylgruppe in eine chemische Verbindung eingeführt wird, wobei das Wasserstoffatom einer Hydroxylgruppe durch eine Acetylgruppe (CH3 CO) ersetzt wird, um einen bestimmten Ester, das Acetat, zu erhalten. Die Acetylierung von Proteinen erfolgt in zwei verschiedenen Formen. Beim Menschen werden die meisten (80-90 %) Proteine an ihren Nα-Termini der entstehenden Polypeptidketten co-translational acetyliert. Ein anderer Typ wird typischerweise an Lysinresten acetyliert.
N-terminale Acetylierung
N-terminale (Nt) Acetylierung wird durch Nt-Acetyltransferasen (NATs) katalysiert und ist bisher als irreversibel bekannt. NATs, ein- oder mehrgliedrige Enzyme, die aus einer katalytischen Untereinheit und bis zu zwei Hilfsuntereinheiten bestehen, können eine Acetylgruppe von Acetyl-Coenzym A (Ac-CoA) auf die α-Aminogruppe des ersten Aminosäurerestes des Proteins übertragen. Bei NATs moduliert die große Hilfsuntereinheit die Aktivität und Substratspezifität der katalytischen Untereinheit. Verschiedene NATs sind für die Nt-Acetylierung verantwortlich. Beim Menschen wurden bisher sechs NATs gefunden, darunter NatA, NatB, NatC, NatD, NatE und NatF. Neben der unterschiedlichen Zusammensetzung der Untereinheiten unterscheiden sich die verschiedenen NATs auch in ihrer Substratspezifität.
Die Nt-Acetylierung spielt bei molekularen Effekten unterschiedliche Rollen. Erstens bestimmt die Nt-Acetylierung die subzelluläre Lokalisierung bestimmter Proteine. So können beispielsweise Arl3 und Grh1, zwei Golgi-assoziierte Proteine, nicht mit dem Golgi-Apparat assoziieren, wenn ihnen die Nt-Acetylgruppe fehlt. Zweitens wird berichtet, dass die Nt-Acetylierung Proteine im Zytosol zurückhält und eine posttranslationale Translokation in das endoplasmatische Retikulum (ER) und den sekretorischen Weg hemmt. Darüber hinaus kann die Nt-Acetylierung die Eigenschaften des N-Terminus verändern, so dass die Protein-Protein-Wechselwirkungen moduliert werden. Für mehrere Proteine wurde gezeigt, dass die Affinität zu ihren Bindungspartnern nach der Nt-Acetylierung zunimmt. Das E2-Ubiquitin-konjugierende Enzym Ubc12 beispielsweise erfährt eine Nt-Acetylierung durch NatC, die eine erhöhte Affinität zu seinem Interaktionspartner, der E3-Ubiquitin-Ligase Dcn1, ermöglicht. Darüber hinaus kontrolliert die Nt-Acetylierung die Qualität und Lebensdauer von Proteinen und reguliert die Proteinstöchiometrie durch den N-End-Regelweg.
Die N-terminale Acetylierung hat viele Funktionen in der Physiologie. NATs sind für die normale Entwicklung sowie die Entwicklung von Knochen und Blutgefäßen unerlässlich. Die N-terminale Acetylierung kann den Blutdruck, die Proteasom-Lokalisierung, Hormone sowie die Struktur und Funktion von Organellen regulieren. Beim Menschen steht sie im Zusammenhang mit neurodegenerativen Erkrankungen (wie Alzheimer, Parkinson und Lewy-Körperchen-Demenz) und Krebs (wie Lungen-, Brust- und Darmkrebs).
Lysin-Acetylierung
Acetylierte Lysinreste wurden zuerst in Histonen entdeckt, die die Gentranskription regulieren. Die Lysinacetylierung ist jedoch nicht auf Histone beschränkt. Im Gegensatz zur Nt-Acetylierung ist die Lysin-Acetylierung reversibel. Die Acetylierung wird durch Lysin-Acetyltransferasen (KATs) katalysiert und die Deacetylierung von Lysinresten wird durch Lysin-Deacetylasen (KDACs) katalysiert.
Es wird berichtet, dass im menschlichen Genom 17-22 KAT-Gene identifiziert wurden (die genaue Anzahl der KATs ist umstritten), die in drei verschiedene Familien eingeteilt werden können, darunter die GCN5 (general control non-derepressible 5)-verwandte Acetyltransferase (GNAT)-Familie, die MYST-Familie und die p300/CBP (CREB-binding protein)-Familie. Zu den bekannten Substraten der KAT-Komplexe gehören nicht nur Histonproteine, sondern auch verschiedene Transkriptionsfaktoren, Transkriptionsko-Regulatoren und einige Proteine spezifischer zellulärer Signalwege wie p53, β-Catenin, NF-κB, MyoD oder Rb. Und sogar einige RNA-Moleküle können acetyliert werden. Es gibt vier verschiedene Arten von KDACs, darunter Klasse I, II, III und IV. Klasse I, II und IV sind Zn2 +-abhängige Amidohydrolasen, während Klasse III (auch Sirtuine genannt) NAD+ als Co-Substrat für ihre katalytische Aktivität verwendet.
Die Histone sind die ersten entdeckten acetylierten Proteine. Die Histonmoleküle werden durch verschiedene PTMs modifiziert, darunter Phosphorylierung, Methylierung und Acetylierung. Die Histonacetylierung bestimmt den Histonzusammenbau sowie die Faltung und Kompaktheit der DNA-Histon-Interaktion und stellt somit einen Schalter zwischen permissiver und repressiver Chromatinstruktur dar. Neben Histonen können KATs auch Proteine des Zytoskeletts katalysieren. Es wurden einige neue Acetylierungsstellen in anderen Proteinen identifiziert, darunter HMG-Proteine, c-Myc, Östrogen- und Androgenrezeptoren, E2F/Rb usw.
Die physiologische Rolle der Lysin-Acetylierung ist bekannt. Die Histonproteine sind an einer strengen Regulierung von im Wesentlichen allen Arten von DNA-gesteuerten Prozessen wie Transkription, Replikation, Rekombination, Reparatur sowie Translation und Bildung von spezialisierten Chromatinstrukturen beteiligt. Daher wirkt sich die Lysin-Acetylierung von Proteinen auf eine Reihe von zellulären Signalwegen sowie auf den Stoffwechsel, die Stressreaktion, die Apoptose und den Membrantransport aus.
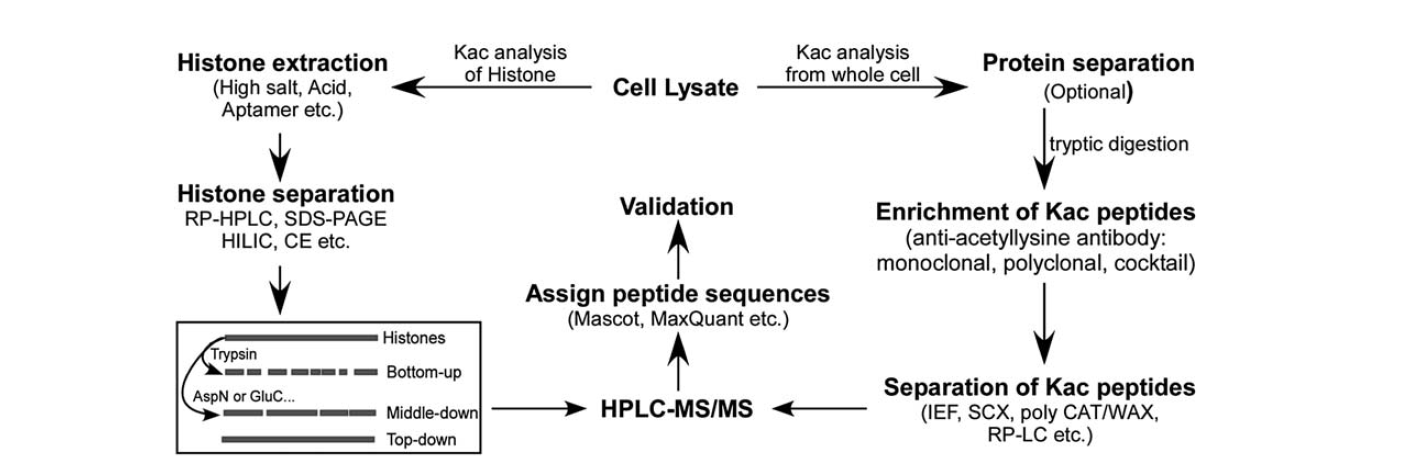
Es gibt relativ wenige Instrumente zur Identifizierung der Lysin-Acetylierung. Mit der Entwicklung der Massenspektrometrie wurde diese zu einem wichtigen Instrument für die Identifizierung und Quantifizierung der Lysinacetylierung. Für die Analyse der Histon-Lysin-Acetylierung sind mehrere Schritte erforderlich, darunter Zelllysat, Histonextraktion, Histontrennung, Massenspektrometrie und Datenanalyse. Die Schritte für die Analyse der Protein-Lysin-Acetylierung aus der ganzen Zelle umfassen Zelllysat, Proteintrennung, Anreicherung von Lysin-Acetylierungspeptiden, Trennung von Lysin-Acetylierungspeptiden, Massenspektrometrie und Datenanalyse.