
Wenn Chlorgas durch eine Flasche Tomatensaft geblasen wird, färbt sich das Chlor/Tomatensaft-Gemisch innerhalb von fünf Minuten fast vollständig weiß. Diese spektakuläre Veränderung ist das Ergebnis der chemischen Wirkung des Chlors, das als oxidierendes Bleichmittel auf die Pigmente im Tomatensaft wirkt. Wenn alte Zeitungsausschnitte, die durch Alterung und Lichteinwirkung verfärbt sind, mit einer 1 %igen wässrigen Natriumborhydridlösung behandelt werden, wird das Papier innerhalb von zwanzig Minuten drastisch aufgehellt. In diesem Fall hat das Papier durch die Wirkung von Natriumborhydrid, das als reduzierendes Bleichmittel wirkt, seine ursprüngliche weiße Farbe wiedererlangt.
Ein Bleichmittel ist ein Stoff, der andere Stoffe aufhellen oder entfärben kann. Farbige Stoffe enthalten im Allgemeinen Gruppen von Atomen, sogenannte Chromophore, die sichtbares Licht mit bestimmten, charakteristischen Wellenlängen absorbieren und den nicht absorbierten Teil des Lichts reflektieren oder durchlassen können. Wenn beispielsweise ein Chromophor blaues Licht absorbiert, reflektiert es das Licht der Komplementärfarbe, und die chromophorhaltige Substanz erscheint gelb. Bleichmittel zerstören im Wesentlichen Chromophore (und entfernen damit die Farbe) durch Oxidation oder Reduktion dieser absorbierenden Gruppen. Somit können Bleichmittel entweder als Oxidationsmittel oder als Reduktionsmittel klassifiziert werden.
Einige der Verwendungen von Bleichmitteln sind:
- Das Bleichen von Textilien und Geweben
- Das Bleichen von Zellstoff
- Das Entfernen von Flecken
- Gewerbliche und häusliche Wäsche und Reinigung
- Als Inhaltsstoffe in Scheuermitteln und Geschirrspülmitteln
- Das Bleichen von Haaren
Oxidierende Bleichmittel
Eine große Anzahl von oxidierenden Bleichmitteln wurde von Jules A. Szilard in Bleaching Agents and Techniques (1973) besprochen. Die heute gebräuchlichen oxidierenden Bleichmittel (und Bleichmittel) sind: Chlor, Chlordioxid, alkalische Hypochlorite, Wasserstoffperoxid, Persauerstoffverbindungen sowie Sonnen- und Kunstlicht.
Chlor (Cl 2 ). Die Entdeckung des Chlors durch den schwedischen Chemiker Carl Wilhelm Scheele im Jahr 1774 markierte den Beginn der modernen Ära des Bleichens. Der französische Chemiker Claude-Louis Berthollet war der erste, der Chlor zum Bleichen von Baumwoll- und Leinenstoffen einsetzte, so Sidney M. Edelstein in einem Zeitschriftenartikel von 1948 mit dem Titel „The Role of Chemistry in the Development of Dyeing and Bleaching“.
Chlor wurde auch zum Bleichen von Zellstoff verwendet. Viele Zellstofffabriken, die das Kraftzellstoffverfahren anwenden, stellen Natriumhydroxid (das zum Aufschluss von Holzspänen benötigt wird) vor Ort durch Elektrolyse von Sole, einer konzentrierten wässrigen Natriumchloridlösung, her.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Chlor ist ein Nebenprodukt. Die anschließende Chlorbleiche des braunen Zellstoffs ergibt ein Produkt, das zur Herstellung von Schreib- und Druckpapier verwendet werden kann. Leider werden die organischen Verbindungen im Zellstoff sowohl oxidiert als auch gechlort, so dass geringe Mengen an chlororganischen Verbindungen entstehen, darunter
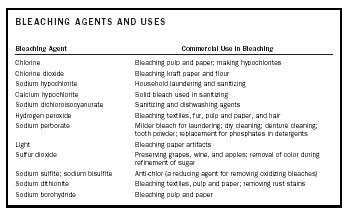
| BLEICHMITTEL UND VERWENDUNGEN | |
| Bleichmittel | Kommerzielle Verwendung beim Bleichen |
| Chlor | Bleichen von Zellstoff und Papier; Herstellung von Hypochloriten |
| Chlordioxid | Bleichen von Kraftpapier und Mehl |
| Natriumhypochlorit | Waschen und Desinfizieren von Haushalten |
| Calcium Hypochlorit | Festes Bleichmittel zur Desinfektion |
| Natriumdichlorisocyanurat | Desinfektions- und Geschirrspülmittel |
| Wasserstoffperoxid | Bleichen von Textilien, Pelze, Zellstoff und Papier sowie Haare |
| Natriumperborat | Milderes Bleichmittel für die Wäsche; Trockenreinigung; Gebissreinigung; Zahnpulver; Ersatz für Phosphate in Waschmitteln |
| Licht | Bleichen von Papierartefakten |
| Schwefeldioxid | Konservierung von Trauben, Wein und Äpfeln; Entfernung der Farbe bei der Raffination von Zucker |
| Natriumsulfit; Natriumbisulfit | Antichlor (ein Reduktionsmittel zur Entfernung oxidierender Bleichmittel) |
| Natriumdithionit | Bleichen von Textilien, Zellstoff und Papier; Entfernen von Rostflecken |
| Natriumborhydrid | Bleichen von Zellstoff und Papier |
Dioxine. Das häufigste Dioxin, das bei der Zellstoff- und Papierbleiche entsteht, 2,3,7,8-Tetrachlordibenzo- p -dioxin (2,3,7,8-TCDD), hat sich als krebserregend und tödliches Gift erwiesen. Daher wird Chlor als Bleichmittel durch die sichereren Bleichmittel Chlordioxid und Wasserstoffperoxid ersetzt. In der Tat geht der Trend in der Zellstoff- und Papierindustrie zur völlig chlorfreien Bleiche (TCF). Chlor wird in der Bleichindustrie heute hauptsächlich zur Herstellung von Hypochloritlösungen und Trockenbleichmitteln wie Calciumhypochlorit verwendet.
Chlordioxid (ClO 2 ). Chlordioxid wurde als Bleichmittel sowohl in der Gasphase als auch in wässriger Lösung verwendet. Wegen seiner Explosivität wird Chlordioxid in der Gasphase oft mit Stickstoff oder Kohlendioxid verdünnt. Bei der Lagerung oder beim Transport wird Chlordioxid durch kaltes Wasser geleitet und unter Kühlung aufbewahrt.
Chlordioxid wird industriell durch die Reduktion von Natriumchlorat mit Schwefeldioxid in wässriger Lösung hergestellt.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
Eine relativ sichere Methode zur Herstellung von ClO 2 ist die Reaktion zwischen Natriumchlorit (NaClO 2 ) und Formaldehyd (H 2 CO).
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
Im Verlauf von Reaktion 3 sinkt der pH-Wert der Lösung (durch die Bildung von Ameisensäure). Der erhöhte Säuregehalt der Lösung fördert die Bildung von ClO 2 , wie in Gleichung 4 dargestellt.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
In saurer Lösung verhält sich Chlordioxid wie ein Oxidationsmittel. Die vollständige Reduktion von ClO 2 ist in Gleichung 5 dargestellt.
ClO 2 + 4H + + 5 e – → Cl – + 2H 2 O (5)
Die einzelnen Schritte dieser Gesamtreduktionsreaktion ergeben HClO 2 , HOCl und Cl 2 , die sich alle als Oxidationsmittel verhalten. Es ist ein saures Medium erforderlich, da ClO 2 in alkalischer Lösung disproportioniert, wie in Gleichung 6 dargestellt.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Chlordioxid wird hauptsächlich zum Bleichen von Zellstoff verwendet.
Hypochlorite (OCl – ). Hypochloritbleichlösungen werden aus NaOCl und in geringerem Maße aus Ca(OCl)2 hergestellt. Hypochlorite werden in der Wäscherei, als Desinfektionsmittel, beim Bleichen von Zellstoff und Textilien und bei der Entfernung von Druckfarbe aus Recyclingpapier verwendet. Handelsübliche Bleichlösungen erhält man, indem man Chlorgas durch kaltes, verdünntes, wässriges Natriumhydroxid leitet, wie in Gleichung 7 dargestellt.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternativ kann das Hypochlorit-Ion durch die Hydrolyse von organischen Stickstoff-Chlor-Verbindungen erzeugt werden. Einige der wichtigeren Stickstoff-Chlor-Verbindungen, die auf diese Weise verwendet werden, sind die chlorierten Isocyanurate. Diese finden Verwendung in Reinigungs- und Geschirrspülmitteln.
Um ein wirksames Bleichmittel zu sein, sollte die Hypochloritlösung alkalisch gehalten werden (pH > 9,0), um die Hydrolyse von OCl – (siehe Gleichung 8) zu unterdrücken und die Bildung von instabilem HOCl zu verhindern.
OCl – + H 2 O → HOCl + OH – (8)
In sauren Lösungen bildet und zersetzt sich HOCl.
3HOCl → HClO 3 + 2HCl (9)
HOCl reagiert auch mit HCl, einem der Zersetzungsprodukte.
HOCl + HCl → H 2 O + Cl 2 (10)
Hypochlorit-Bleichlösungen dürfen keine Schwermetallkationen enthalten, da diese Kationen (wie Licht oder Wärme) die Zersetzung von HOCl fördern, wie in Gleichung 11 dargestellt.
2HOCl → 2HCl + O 2 (11)
Die Wirkstoffe in Hypochloritbleichmitteln variieren mit dem pH-Wert. Bei pH < 2 ist Cl 2 der Hauptbestandteil in der Lösung; bei pH 4 bis 6 ist HOCl die vorherrschende Spezies; bei pH > 9 ist OCl – der einzige vorhandene Bestandteil. Das Hypochlorit-Ion in basischer Lösung ist der aktive Bestandteil von Haushaltsbleichmitteln, die in der Regel etwa 5 bis 6 Prozent NaOCl enthalten. Das OCl – Ion oxidiert Chromophore in farbigen Materialien und wird selbst zu Chlorid- und Hydroxidionen reduziert.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Der durch handelsübliche Hypochloritbleiche bewirkte Aufhellungsprozess wird häufig durch die Verwendung von optischen Aufhellern verstärkt, d. h. von Verbindungen, die einfallendes ultraviolettes Licht absorbieren und sichtbares Licht emittieren, wodurch das Gewebe heller und weißer erscheint.
Wasserstoffperoxid (H 2 O 2 ) . Wasserstoffperoxid kann durch die Reaktion von Bariumperoxid und Schwefelsäure hergestellt werden (siehe Gleichung 13). Da Bariumsulfat ausfällt, lässt sich Wasserstoffperoxid leicht abtrennen.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Wasserstoffperoxid hat als Bleichmittel, das in der Zellstoff- und Papierindustrie verwendet wird, den Vorteil, dass es nicht umweltschädlich ist. Wegen der Instabilität von reinem Wasserstoffperoxid werden zum Bleichen wässrige Lösungen verwendet. Bei Raumtemperatur zerfällt Wasserstoffperoxid sehr langsam zu Wasser und Sauerstoff.
2H 2 O 2 → H 2 O + O 2 (14)
Die Anwesenheit von Übergangsmetallkationen (insbesondere Fe 3+ , Mn 2+ und Cu 2+ ) und anderen Katalysatoren beschleunigt diese Reaktion jedoch erheblich. Daher muss wässriges Wasserstoffperoxid mit Komplexbildnern stabilisiert werden, die die Übergangsmetallkationen binden.
Die aktive bleichende Spezies in Wasserstoffperoxid ist das Perhydroxylanion , OOH – , das durch die Ionisierung von H 2 O 2 gebildet wird.
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
Die saure Ionisationskonstante von Wasserstoffperoxid ist sehr niedrig ( K a = 2 × 10 -12 ), so dass H 2 O 2 -Lösungen alkalisch gemacht werden müssen, um

um die Konzentration von OOH – zu erhöhen. In Abwesenheit eines alkalischen Mediums ist Wasserstoffperoxid als Bleichmittel nicht mehr wirksam. So wird zum Beispiel in der Bleichstufe der Haarfärberei häufig Wasserstoffperoxid (5-6 %), aber auch Ammoniak verwendet, um ein alkalisches Medium bereitzustellen.
Dabei darf der pH-Wert nicht über 11 ansteigen, da an diesem Punkt die Zersetzung von OOH – beginnt.
2OOH – → O 2 + 2OH – (16)
Persauerstoff-Verbindungen. Es gibt eine Reihe von festen Persauerstoffverbindungen, die in Wasser gelöst Wasserstoffperoxid freisetzen. Dazu gehören Natriumperborat (NaBO 3 z 4H 2 O oder NaBO 2 z H 2 O 2 z 3H 2 O) und Natriumcarbonatperoxyhydrat (2Na 2 CO 3 z 3H 2 O 2 ). Die Struktur von Natriumperborat enthält das Peroxoanion B 2 (O 2 ) 2 (OH) 4 2- , das zwei O-O-Bindungen enthält, die zwei tetraedrische BO 2 (OH) 2- Gruppen verbinden. Diese Peroxoverbindungen werden in Waschmitteln, Gebissreinigern und Zahnputzmitteln verwendet.
Bleichen mit Licht. Das Bleichen mit natürlichem Sonnenlicht oder künstlichem Licht wurde zur Entfernung von Flecken aus Papierartefakten und zur Behandlung von Textilien verwendet. Das zu bleichende Material wird zunächst in eine alkalische Lösung von Kalzium- oder Magnesiumbicarbonat getaucht und dann durch Abdecken mit Plexiglas, Lexan oder Mylar vor ultravioletter Strahlung geschützt. Anschließend wird es zwei bis vier Stunden lang dem natürlichen Sonnenlicht und zwei bis zwölf Stunden lang dem künstlichen Licht ausgesetzt.
Reduktionsbleichmittel
Zu den beim Bleichen verwendeten Reduktionsmitteln gehören Sulfite, Bisulfite, Dithionite und Natriumborhydrid, die alle in der Zellstoff- und Textilbleiche verwendet werden.
Sulfite (SO 3 2- ) und Bisulfite (HSO 3 – ). Die Oxidationsstufe des Schwefels in SO 3 2- und HSO 3 – ist +4, und die Oxidation zu +6 erfolgt leicht unter Bildung von SO 4 2- bzw. HSO 4 – , wodurch Sulfite und Bisulfite gute Reduktionsmittel sind.
Dithionite (S 2 O 4 2- ) . Sowohl Natrium- als auch Zinkdithionit finden Verwendung beim Bleichen von Holzstoffen und Textilien. Die Herstellung des Dithionit-Ions erfolgt durch die Reduktion des Bisulfit-Ions und des Schwefeldioxids mit Zn-Staub.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
Das Dithionit-Ion, S 2 O 4 2- , das Schwefel in der Oxidationsstufe +3 aufweist, verhält sich in alkalischer Lösung als starkes Reduktionsmittel.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
Mit sinkendem pH-Wert nimmt die Reduktionskraft des Dithionit-Ions ab, wie es das LeChateliersche Prinzip vorhersagt.
Dithionite sind nützlich bei der Entfernung von Rostflecken, und neutrale Citratlösungen von Na 2 S 2 O 4 wurden verwendet, um Eisenkorrosionsprodukte von Gegenständen zu entfernen, die von der Titanic geborgen wurden.
Natriumborhydrid (NaBH 4 ). Natriumborhydrid wurde hauptsächlich zum industriellen Bleichen von Holzstoffen verwendet. Das BH 4 – Ion ist ein starkes Reduktionsmittel in alkalischer Lösung.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Ein Problem bei der Verwendung von Natriumborhydrid ist, dass sich das BH 4 – Ion in wässriger Lösung langsam zersetzt.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Als alternative Methode können BH 4 – Salze entweder in CH 3 OH oder dem weniger giftigen C 2 H 5 OH aufgelöst werden. Die Zersetzung des BH 4 – Ions in Alkoholen erfolgt wesentlich langsamer:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Fazit
Ein Bleichmittel kann einen Stoff aufhellen oder entfärben, indem es mit den Chromophoren reagiert, die für die Farbe des Stoffes verantwortlich sind. Je nach Art der Chromophore ist das Bleichmittel entweder ein Oxidationsmittel oder ein Reduktionsmittel. Das heißt, das Chromophor wird entweder oxidiert oder reduziert, so dass eine farblose oder geweißte Substanz entsteht. Die Bleichmittel und ihre kommerziellen Verwendungen sind in Tabelle 1 zusammengefasst.