Trend 2: Bei Oxosäuren mit einem gegebenen Zentralatom steigt der Säuregrad mit dem Oxidationszustand des Zentralatoms oder, anders ausgedrückt, mit der Anzahl der an das Zentralatom gebundenen Sauerstoffatome.
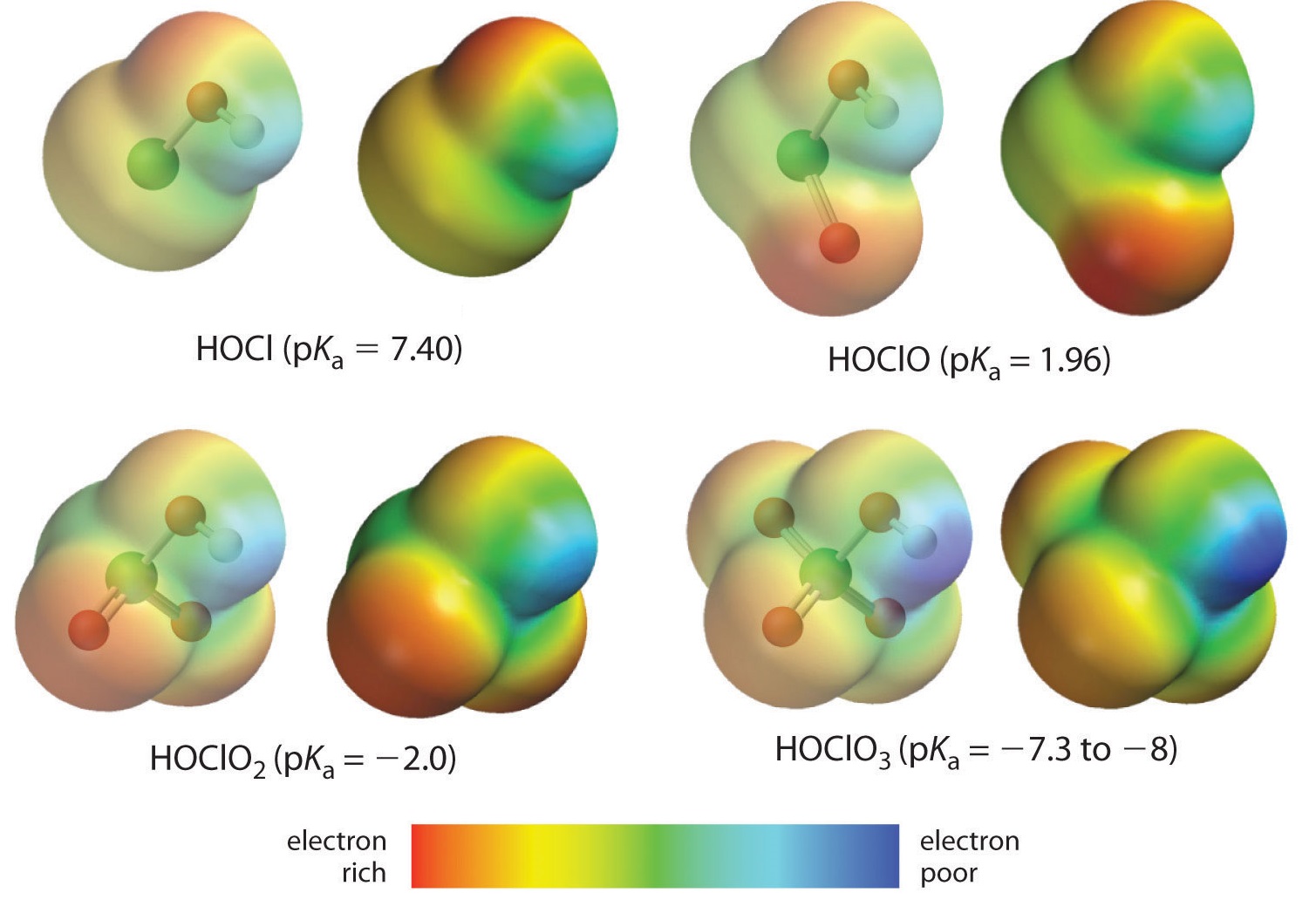
Hier betrachten wir den Trend für Säuren, bei denen eine unterschiedliche Anzahl von Sauerstoff an ein gegebenes Zentralatom gebunden ist. Ein Beispiel dafür sind die Perchlorsäure (\(\ce{ClO_4^{-}}\)), Chlorsäure (\(\ce{ClO_3^{-}}\)), Chlorsäure (\(\ce{ClO_2^{-}}\)) und Hypochlorsäure (\(\ce{ClO^{-}}\))). In solchen Reihen ist die Säure umso stärker, je größer die Anzahl der Sauerstoffatome ist. Dafür gibt es mehrere Erklärungsansätze. Aus der Sicht der Säure selbst ist der Schlüsselfaktor wiederum der induktive Effekt, in diesem Fall die Fähigkeit der an das Zentralatom gebundenen Sauerstoffatome, die Elektronendichte über die OH-Bindung anzuziehen. Dies geht aus dem Ladungsdichtediagramm für die Chloroxosäuren in Abbildung \(\PageIndex{1}\) hervor, in dem die partielle positive Ladung des sauren Wasserstoffs mit der Anzahl der vorhandenen Sauerstoffatome zunimmt.
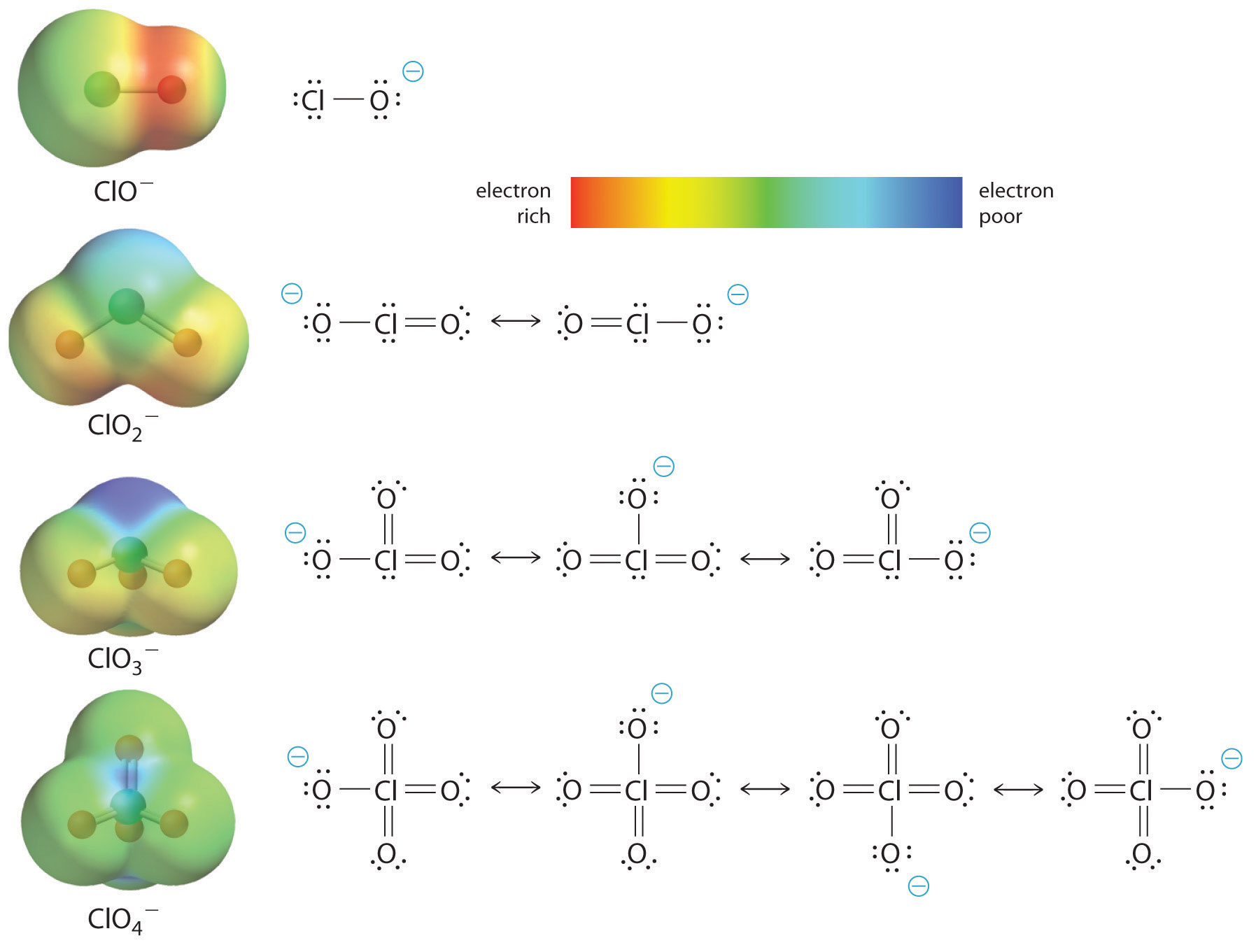
Die Zunahme der Azidität der Oxosäure mit der Anzahl der an das Zentralatom gebundenen Sauerstoffatome lässt sich auch an der Stabilität des konjugierten Oxyanions ablesen. Dass die Stabilität der konjugierten Base mit der Anzahl der Sauerstoffatome zunimmt, geht aus den Ladungsverteilungsdiagrammen und den Lewis-Bindungsmodellen für die in Abbildung \(\PageIndex{2}\) gezeigten Chlor-Oxyanionen hervor. Wenn die negative Ladung auf mehr Sauerstoffatome verteilt ist, wird sie zunehmend diffuser.
Übung \(\PageIndex{1}\)
Schwefel und Selen bilden beide Oxosäuren der Formel \(\ce{H_2EO_4}\), wobei E entweder S oder Se ist. Diese werden als schweflige bzw. selenige Säure bezeichnet. Welche Oxosäure sollte saurer sein: Selenige Säure oder Schweflige Säure?
Antwort
Schweflige Säure sollte saurer sein. Da Schwefel elektronegativer ist als Selen, wird Schwefel die OH-Bindungen stärker polarisieren, so dass sie saurer sind. Diese Vorhersage wird durch einen Vergleich der \(pK_a\)-Werte für die Säuren bestätigt:
| Säure | \(pK_{a1}\) | \(pK_{a2}\) |
|---|---|---|
| schweflige Säure, \(H_2SO_3\) | 1.85 | 7.2 |
| selenige Säure, \(H_2SeO_3\) | 2.62 | 8.32 |